α-セクレターゼ
α-セクレターゼ(英: alpha secretase)は、アミロイド前駆体タンパク質(APP)を膜貫通領域内で切断するタンパク質分解酵素のファミリーである。具体的には、α-セクレターゼによるAPPの切断部位は、APPがβ-セクレターゼとγ-セクレターゼによってプロセシングされた際に生じるアルツハイマー病関連ペプチドである、アミロイドβに含まれる部位に位置している。そのため、α-セクレターゼによって切断されることでアミロイドβの形成は阻止される(下図参照)。α-セクレターゼ経路はAPPのプロセシングにおいて優勢な経路であり、非アミロイド形成性経路であるとみなされている。α-セクレターゼはADAM(a disintegrin and metalloprotease domain)ファミリーのメンバーであり、細胞表面で発現し細胞膜に固定されている。ADAM10などいくつかのタンパク質が、α-セクレターゼ活性を持つことが特定されている。α-セクレターゼによる切断に伴い、APPは細胞外ドメイン(APPsαとして知られるフラグメント)を細胞外環境へ放出する。この過程はエクトドメイン・シェディングと呼ばれる[1]。
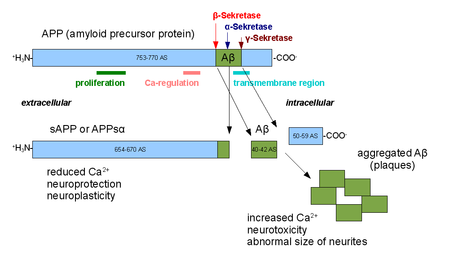
ADAM10は、ディスインテグリンドメインとプロドメイン(prodomain)の2つのタンパク質ドメインから構成されるが、APPのプロセシングに必要なのはプロドメインのみである[2]。ADAM17(TACE(tumor necrosis factor-α converting enzyme)とも呼ばれる)[3]、ADAM9[4]、ADAM19[5]など他のADAMタンパク質もα-セクレターゼとして同定されている。ADAM9(MDC9、meltrin gammaとも呼ばれる)の膜固定ドメインを欠失した変異体の細胞外発現は、α-セクレターゼ経路を利用したアルツハイマー病の予防や治療法の可能性の1つとして示唆されている[6]。細胞表面でのα-セクレターゼの活性は細胞内の機構による調節を受けないが、ゴルジ体におけるα-セクレターゼの活性はプロテインキナーゼCの活性に依存している[7]。ゴルジ体におけるα-セクレターゼの活性は、β-セクレターゼ経路と直接競合すると考えられている[7]。細胞表面でのα-セクレターゼによる切断は、APPが細胞表面に到達した後迅速に行われる[8]。
α-セクレターゼの活性は学習や記憶形成の調節への関与が示唆されている。APPsα細胞外ドメインの放出は、アポトーシスシグナル伝達に拮抗してシナプス形成を促進する神経栄養作用を示す。この過程はADAM10の過剰発現によってアップレギュレーションされる[9]。α-セクレターゼの活性はシグナル伝達ペプチドPACAPに応答してアップレギュレーションされることも観察されている[10]。
ADAM10を含む関連α-セクレターゼは、MHCクラスI分子など他の膜貫通タンパク質に対しても同様の成熟過程に関与していることが示唆されている。こうしたタンパク質の一部は、まずα-セクレターゼによって細胞外ドメインがプロセシングされ、その後、プレセニリン複合体型のγ-セクレターゼによって切断されることが近年示唆されている[11]。このプロテアーゼ複合体は、アルツハイマー病と関係している。Notchシグナリング経路はAPPのプロセシングと多くの類似性が存在し、同様にADAM10による部分的な調節を受けている[12]。
出典
[編集]- ^ Lammich, S; Kojro, E; Postina, R; Gilbert, S; Pfeiffer, R; Jasionowski, M; Haass, C; Fahrenholz, F (1999). “Constitutive and regulated alpha-secretase cleavage of Alzheimer's amyloid precursor protein by a disintegrin metalloprotease”. Proc Natl Acad Sci USA 96 (7): 3922–7. doi:10.1073/pnas.96.7.3922. PMC 22396. PMID 10097139.
- ^ Fahrenholz, F; Gilbert, S; Kojro, E; Lammich, S; Postina, R (2000). “Alpha-secretase activity of the disintegrin metalloprotease ADAM 10. Influences of domain structure”. Ann NY Acad Sci 920: 215–22. doi:10.1111/j.1749-6632.2000.tb06925.x. PMID 11193153.
- ^ Detlev Ganten, Aloys Greither : Molekularmedizinische Grundlagen von altersspezifischen Erkrankungen, 2004, Springer-Verlag, ISBN 3-540-00858-6
- ^ Asai, M; Hattori, C; Szabo, B; Sasagawa, N; Maruyama, K; Tanuma, S; Ishiura, S (2003). “Putative function of ADAM9, ADAM10, and ADAM17 as APP alpha-secretase”. Biochem Biophys Res Commun 301 (1): 231–5. doi:10.1016/S0006-291X(02)02999-6. PMID 12535668.
- ^ Tanabe, C; Hotoda, N; Sasagawa, N; Sehara-Fujisawa, A; Maruyama, K; Ishiura, S (2006). “ADAM19 is tightly associated with constitutive Alzheimer's disease APP alpha-secretase in A172 cells”. Biochem Biophys Res Commun 352 (1): 111–7. doi:10.1016/j.bbrc.2006.10.181. PMID 17112471.
- ^ Hotoda, N; Koike, H; Sasagawa, N; Ishiura, S (2002). “A secreted form of human ADAM9 has an alpha-secretase activity for APP”. Biochem Biophys Res Commun 293 (2): 800–5. doi:10.1016/S0006-291X(02)00302-9. PMID 12054541.
- ^ a b Skovronsky, DM; Moore, DB; Milla, ME; Doms, RW; Lee, VM (2000). “Protein kinase C-dependent alpha-secretase competes with beta-secretase for cleavage of amyloid-beta precursor protein in the trans-golgi network”. J Biol Chem 275 (4): 2568–75. doi:10.1074/jbc.275.4.2568. PMID 10644715.
- ^ De Strooper, B; Annaert, W (2000). “Proteolytic processing and cell biological functions of the amyloid precursor protein”. J Cell Sci 113 (11): 1857–70. PMID 10806097.
- ^ Bell, KF; Zheng, L; Fahrenholz, F; Cuello, AC (2006). “ADAM-10 over-expression increases cortical synaptogenesis”. Neurobiol Aging 29 (4): 554–65. doi:10.1016/j.neurobiolaging.2006.11.004. PMID 17187903.
- ^ Kojro, E; Postina, R; Buro, C; Meiringer, C; Gehrig-Burger, K; Fahrenholz, F (2006). “The neuropeptide PACAP promotes the alpha-secretase pathway for processing the Alzheimer amyloid precursor protein”. FASEB J 20 (3): 512–4. doi:10.1096/fj.05-4812fje. PMID 16401644.
- ^ Carey, BW; Kim, DY; Kovacs, DM (2007). “Presenilin/gamma-secretase and alpha-secretase-like peptidases cleave human MHC Class I proteins”. Biochem J 401 (1): 121–7. doi:10.1042/bj20060847. PMC 1698663. PMID 17150042.
- ^ Hartmann, D; de Strooper, B; Serneels, L; Craessaerts, K; Herreman, A; Annaert, W; Umans, L; Lubke, T et al. (2002). “The disintegrin/metalloprotease ADAM 10 is essential for Notch signalling but not for alpha-secretase activity in fibroblasts”. Hum Mol Genet 11 (21): 2615–24. doi:10.1093/hmg/11.21.2615. PMID 12354787.
