芳香族炭化水素受容体
芳香族炭化水素受容体(ほうこうぞくたんかすいそじゅようたい、英:Aryl Hydrocarbon Receptor、AhR)とはbHLH-PAS(Basic Helix-Loop-Helix-Per-Arnt-Sim)ファミリーに属する転写因子である。AhRは同ファミリーの中でも発見が最も古い分子であり、ほとんどの細胞・組織に発現が見られる。リガンドの結合により種々の遺伝子の転写活性化を引き起こすが、これまで長らくAhRの内因性リガンドは発見されていなかった。現在ではインディゴ(Indigo)やインディルビン(Indirubin)という化合物がAhRに結合して尿中に排泄されること[5]、ジオスミン(Diosmin)などの食餌性分子がAhRに対して結合能を有することがそれぞれ報告されている[6]。
構造
[編集]
AhRタンパク質はbHLH-PASファミリーと呼ばれるグループに属する転写因子であり、機能発現に重要ないくつかのドメイン構造を有する[7][8]。アミノ基末端側にはbHLHドメインが存在し、塩基性でDNAとの結合に関与している領域(b、Basic(塩基性)に由来)と二量体の形成に関与するHLHドメインに分けられる。またAhRは200-350アミノ酸残基にまたがっている2つのPASドメインを持ち、それぞれPAS-AおよびPAS-Bと呼ばれる。これらはAhRの輸送体として働くARNTに加えてショウジョウバエの遺伝子であり、概日リズムの調節に関与するPeriod(Per)および中枢神経系の発達に重要なSingle Minded(Sim)の構造と相同性を有する[9]。一方、AhRのカルボキシル基側領域は転写活性化において重要であると考えられている。
転写活性化経路
[編集]
AhRはリガンドが結合していない状態では不活性であり、分子シャペロンであるHsp90やp23、 XAP2と会合した状態で細胞質に優位に存在する[10][11]。これらの分子シャペロンの結合によりAhRタンパク質はリガンドと結合可能なコンフォメーションに保たれている。TCDDやPCBなどの多環性芳香族炭化水素化合物がリガンドとして結合することにより分子シャペロンが解離し、核内へ移行する。AhRはそれ自身でホモ二量体を形成することはできず、核内ではARNT(AhR Nuclear Translocator)と呼ばれる分子とヘテロ二量体を形成し[12]、DNA上の異物応答配列(XRE)と呼ばれるエンハンサー配列に結合することにより転写活性化が引き起こされる[13]。エンハンサー配列上のAhR/ARNT複合体に対してヒストンアセチル化酵素であるCBP/p300などのコアクチベーターがリクルートされ、これによりmRNAの合成反応に関与する酵素であるRNAポリメラーゼIIのプロモーター領域への結合が促進される。また、AhRの活性を抑制するタンパク質としてAhR抑制因子(AhRR)と呼ばれる分子が知られており、ARNTに結合する段階でAhRと競合する[14]。
機能
[編集]ヒトにおいてAhRはほとんどすべての組織で発現が見られ、特に肺および肝臓に発現が高い。AhRのノックアウトマウスの表現系として肝臓の発達や血管形成などに異常が報告されている[15]。AhRは薬物代謝酵素であるCYP1や,グルタチオンS-トランスフェラーゼ-Yaサブユニット、UDP-グルクロニルトランスフェラーゼなどの誘導に関与し、異物の代謝を行う。また、AhRのリガンドであり環境ホルモンとして知られるダイオキシン類は代謝を受けにくく体内に蓄積する性質を有し、過剰なタンパク質産生を引き起こすことにより毒性を発現するのではないかと考えられている。
リガンド
[編集]-
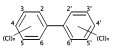
テトラクロロジベンゾジオキシン
参考文献
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000106546 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000019256 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ Adachi J, Mori Y, Matsui S, Takigami H, Fujino J, Kitagawa H, Miller CA, Kato T, Saeki K and Matsuda T.(2001)"Indirubin and Indigo are potent aryl hydrocarbon receptor ligands present in human urine."J.Biol.Chem. 276,31475-8. PMID 11425848
- ^ Ciolino HP, Wang TT and Yeh GC.(1998)"Diosmin and diosmetin are agonists of the aryl hydrocarbon receptor that differentially affect cytochrome P450 1A1 activity."Cancer Res. 58,2754-60. PMID 9661887
- ^ Burbach KM, Poland A and Bradfield CA.(1992)"Cloning of the Ah-receptor cDNA reveals a distinctive ligand-activated transcription factor."Proc.Natl.Acad.Sci.U.S.A. 89,8185-9. PMID 1325649
- ^ Fukunaga BN, Probst MR, Reisz-Porszasz S and Hankinson O.(1995)"Identification of functional domains of the aryl hydrocarbon receptor."J.Biol.Chem. 270,29270-8. PMID 7493958
- ^ Ema M, Sogawa K, Watanabe N, Chujoh Y, Matsushita N, Gotoh O, Funae Y and Fujii-Kuriyama Y.(1992)"cDNA cloning and structure of mouse putative Ah receptor."Biochem.Biophys.Res.Commun. 184,246-53. PMID 1314586
- ^ Denis M, Cuthill S, Wikstrom AC, Poellinger L and Gustafsson JA.(1988)"Association of the dioxin receptor with the Mr 90,000 heat shock protein: a structural kinship with the glucocorticoid receptor."Biochem.Biophys.Res.Commun. 155,801-7. PMID 2844180
- ^ Perdew GH.(1988)"Association of the Ah receptor with the 90-kDa heat shock protein."J.Biol.Chem. 263,13802-5. PMID 2843537
- ^ Reyes H, Reisz-Porszasz S and Hankinson O.(1992)"Identification of the Ah receptor nuclear translocator protein (Arnt) as a component of the DNA binding form of the Ah receptor."Science. 256,1193-5. PMID 1317062
- ^ Denison MS, Fisher JM and Whitlock JP Jr.(1988)"The DNA recognition site for the dioxin-Ah receptor complex. Nucleotide sequence and functional analysis."J.Biol.Chem. 263,17221-4. PMID 2846558
- ^ Mimura J, Ema M, Sogawa K and Fujii-Kuriyama Y.(1999)"Identification of a novel mechanism of regulation of Ah(dioxin)receptor function."Genes Dev. 13,20-25. PMID 9887096
- ^ Schmidt JV, Su GH, Reddy JK, Simon MC and Bradfield CA.(1996)"Characterization of a murine AhR null allele : involvement of the Ah receptor in hepatic growth and development."Proc.Natl.Acad.Sci.USA. 93,6731-6. PMID