2,5-ジケトピペラジン
| 2,5-ジケトピペラジン | |
|---|---|

| |
2,5-Piperazinedione | |
Piperazine-2,5-dione | |
別称 Cyclic dipeptides, cyclo-dipeptides, DKPs, CDPs 2,5 dioxopiperazines (DOPs), dipeptide anhydrides | |
| 識別情報 | |
| CAS登録番号 | 106-57-0 |
| PubChem | 7817 |
| ChemSpider | 7529 |
| UNII | 240L69DTV7 |
| EC番号 | 203-411-5 |
| KEGG | C02777 |
| ChEBI | |
| ChEMBL | CHEMBL125229 |
| バイルシュタイン | 112112 |
| Gmelin参照 | 217756 |
| 3DMet | B00497 |
| |
| |
| 特性 | |
| 化学式 | C4H6N2O2 |
| モル質量 | 114.1 g mol−1 |
| 融点 |
311-312 °C, 272 K, -219 °F |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
2,5-ジケトピペラジン(英: 2,5-Diketopiperazine、2,5-DKP)は化学式(NHCH2C(O))2で表される、二つのアミノ酸がペプチド結合により六員環ラクタムを形成した環状有機化合物である。 最小の環状ペプチドであり、三次元構造が完全に解明された初のペプチドである。1938年にカリフォルニア工科大学のロバート・コリーによるX線結晶構造解析を用いた研究で、ペプチド結合を有する物質として初めて特定された[1]。
2,5-ジケトピペラジンを母体骨格とした化合物群は2,5-ジケトピペラジン類 (2,5-DKPs、(NHCH(R)C(O))2(R = H, CH3等)) と総称される。あらゆる場所に見られるペプチドであり、天然化合物や医薬品の構造中にも組み込まれることがある[2]。またポリペプチドの分解物として生成され、食品や飲料中にも含まれている[3]。彗星からも検出されている[4]。
天然物中における存在
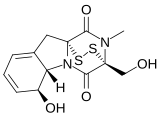
[編集]天然の生理活性物質中には、2,5-DKP構造を有するものが広く存在している。最も良く見られる構造はトリプトファンとプロリンからなる環がヘテロ環化やプレニル化反応を受けたもので、肝毒性を持つブレビアナミドF (cyclo(L-Trp-L-Pro))、痙攣誘発作用を持つベルクロゲン、有糸分裂阻害剤のスピロトリプロスタチンB、抗がん作用を持つステファシジンなどがある[2]。
- トリプトファンとプロリンからなる天然2,5-DKPs
-
(+)-ステファシジンA
他の誘導体としては、架橋構造を持つものには抗生物質であるビシクロマイシンや細胞毒性を持つグリオトキシン、不飽和構造を持つものには微小管に結合するフェニラヒスチン、マイコトキシンであるロケホルチンCなどがある[2]。
- 他の天然2,5-DKPs
食品中における存在
[編集]ポリペプチドの分解物として、食品を熱処理や化学処理する際によく生成される。食品中の2,5-DKPsは渋み、塩味、粒状感、金属味、苦みなどとして知覚されるため、最終製品の味に大きな影響を与える。プロリン、芳香族、脂肪族、極性アミノ酸など様々なアミノ酸から生成されるが、プロリンを含むものが最も一般的に見られる。例えばcyclo(L-Val-L-Pro)は焙煎したココアに含まれ、苦みに寄与する最大の要因として特定されている[3]。この分子は様々な海洋微生物からも単離されており、緑膿菌の植物成長促進作用において重要な役割を持つ、LasIクオラムセンシング信号分子としても特定されている[2]。
最も研究されている単純な2,5-DKPsはヒスチジンとプロリンからなるもの(cyclo(L-His-L-Pro)で[5]、食品、特に魚やその加工品に高濃度で含まれる。経口摂取するとよく吸収され、血液脳関門を自由に通過する。ヒトにおいても甲状腺刺激ホルモン放出ホルモン (TRH) の代謝産物として見られ[6]、中枢神経系、内分泌系、循環器系、電気生理学的機能に対し様々な作用を示す[5]。誘導体は神経変性疾患の治療薬として研究されている[7][2]。
構造
[編集]環状ジペプチドである。水素結合の受容体/供与体双方として働く、六員環はほぼ平面構造を取る、置換基を導入できる位置は6箇所あり、その内4箇所は立体化学的に制御できる、タンパク質分解作用を受けない等の特性により医薬品開発における有用な構造的基盤となっている。天然の2,5-DKPsのほとんどはL-α-アミノ酸から生合成されるcyclo(L-Xaa-L-Yaa) の構造であるため、cis-異性体となる。これは酸、塩基、加熱などによってエピマー化を起こし、生成物のcis-trans比は側鎖の大きさ、環(プロリンなど)の存在、窒素原子のアルキル化などの条件によって大きく変化する。かつては2,5-DKPs合成時のエピマー化が問題となっていたが、温和な条件での反応が開発されたことで解消されている[2]。
生合成
[編集]ヒトを含む様々な生物において、一般的にはtRNA依存性環状ジペプチド合成酵素の作用により合成されている[8]。これは環状ジペプチド酸化酵素とS-アデノシル-メチオニン依存性O/Nメチル基転移酵素の作用を受け化学的に修飾される[8]。
合成
[編集]アミド結合形成、N-アルキル化、C-アシル化の3つの典型的な合成法がある。

アミド結合形成
[編集]最も一般的な合成法はジペプチドの環化であり、エステル末端を持つジペプチドは自発的に環化しやすい。ラセミ化が問題になる可能性はある[9]。ウギ反応はイソシアニド、アミノ酸、アルデヒド、アミンを用いて、一般的なペプチド合成手法と遜色ない収率と光学的純度でジペプチドを合成できる手法である[10]。反応においては一般に、環化反応が起きやすい不安定な末端アミドを与えるようなイソシアニドが選択される。 例えば、そのような脱離基を有する物質として、安定で容易に入手できる1-イソシアノ-2-(2,2-ジメトキシエチル)-ベンゼン(4)を用いてN-置換2,5-DKPs(7)をワンポット合成可能である[11]。
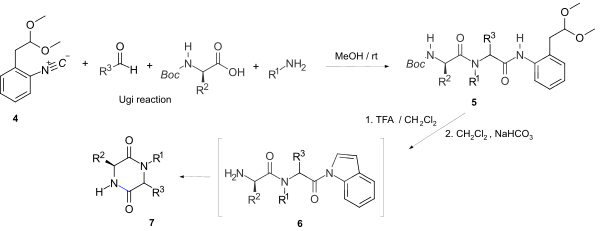
この反応では、ウギ反応の生成物(5)を選択的なインドールアミド形成とtert-ブトキシカルボニル基 (Boc) の脱離を経て活性アミド(6)に変換し、これが他のペプチドやエステル部分に影響を与えることなく環化することで、キラル中心の立体化学を保った7が得られる。
N-アルキル化
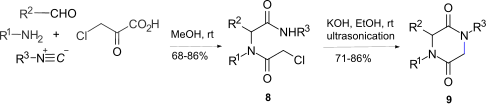
[編集]アミン、アルデヒド、イソシアニド、クロロ酢酸を用いたウギ反応によって得られた8をエタノール性水酸化カリウム中で超音波処理することで、N-アルキル化による分子内環化が起き2,5-DKPs(9)が得られる[12]。しかしこの反応は、R1がアルキル基の場合は2,5-DKP環が得られないこと、エピマー化が起こることによって適用範囲が制限される。
C-アシル化
[編集]エノラートのアシル化により2,5-DKP環を形成することもできる。例えば、フェニルカルバメート(10)を分子内環化させることで、90%の収率で11が得られる[13]。

反応
[編集]C-3とC-6の炭素
[編集]C-3とC-6位への位置、立体選択的な官能基導入は、エノラート、ラジカル、前駆体カチオン(、N-アシルイミニウムイオン)が関与する反応で、官能基の構造や極性に敏感である。
エノラートのアルキル化
[編集]ビス-pMB保護された2,5-DKP(1)をLHMDSと臭化アルキル(R1Br)でアルキル化することでモノアルキル誘導体(2)が得られ、さらなるアルキル化によってトランス二置換誘導体(3)が得られる。

ハロゲン化と置換
[編集]四塩化炭素中において、ベンジル基で保護された2,5-DKP(4)をN-ブロモスクシンイミドによってラジカルハロゲン化することで、 3-臭化物(6)や3,6-二臭化物(5)が得られる。これらの不安定な臭化物は容易にSR、OR、NR2、アルキル、アリールなどの求核剤による置換反応を受け、7が得られる[2]。

アルドール付加
[編集]N-アセチル化した2,5-DKP(8)にアルドール縮合を行うと3-デヒドロ誘導体(9)が、さらにアルドール縮合を行うと3,6-ジデヒドロ誘導体(10)が得られる。ジメチルホルムアミド中でトリエチルアミンを用いて反応させるとアルドール縮合を1段階ずつ行うことが可能で、非対称な3,6-ジデヒドロ誘導体 (R1 = Ar1, R2 = Ar2) を得ることができる[2]。

窒素
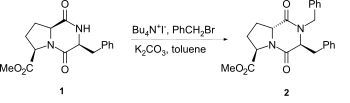
[編集]2,5-DKPsのラクタム窒素をアルキル化する場合、水素化ナトリウムを塩基として用いる手法が最も一般的である。しかし、特にプロリン誘導体においては、1→2のように相間移動触媒などを用いた穏やかな条件下であってもエピマー化が起こる可能性がある[2]。
カルボニル炭素
[編集]還元
[編集]キラルな2,5-DKPs(1、cyclo(L-Phe-L-Phe))のカルボニル基を水素化アルミニウムリチウム (LiAlH4) で還元することで、対応するキラルなピペラジン(2、(2S,5S)-ジベンジルピペラジン)が収率よく得られる[14]。

ジヒドロピラジンとピラジンの合成
[編集]2,5-DKPsのラクタムに由来するエノールリン酸 (4) に対しパラジウム触媒を用いた反応(右田・小杉・スティルカップリング)を行うことで、対応する1,4-ジヒドロピラジン誘導体(5)が得られる。これは酸の存在下で芳香族化し1,4-ピラジン誘導体(6)となる[15]

生物学的機能
[編集]異種の細菌間のクオラムセンシングに2,5-DKPsが関わっていることが示されている。例えば、cyclo(Phe-Pro)はAliivibrio fischeri、コレラ菌、ラクトバチルス・ロイテリ、黄色ブドウ球菌などの遺伝子発現の制御に関与する[8]。
用途
[編集]医薬品
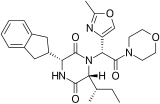
[編集]2,5-DKP構造を有する化合物の多くに対して構造活性相関 (SAR) 研究がなされており、いくつかの医薬品が生まれている。例えばタダラフィル(勃起不全に用いるPDE5阻害剤)、レトシバン(早産に用いるオキシトシン拮抗薬)、アプラビロック(HIVに用いるCCR5拮抗薬)、エペルシバン(早漏に用いるオキシトシン拮抗薬)、プリナブリン(多剤耐性 (MDR) 腫瘍に有効な研究中の抗がん剤)などがある[2]。
- 2,5-DKP構造を有する医薬品
2,5-DKPsは細菌間の情報伝達に用いられるため、感染症の治療に利用できる可能性がある。例えばcis-cyclo(Leu-Tyr)は細菌のバイオフィルム形成を妨げる。このような分子はクオラムセンシング信号を模倣したものであり、病原性細菌の遺伝子発現を制御できる[8]。
試薬
[編集]グリシルセリンから得られる2,5-DKPsは、不斉制御下での非天然アミノ酸の生産に用いられる、グリシンのC-アルキル化誘導体の合成に利用される。この手法では、2,5-DKP骨格をO-アルキル化と同時にN-脱プロトン化することで、グリシンのNとO末端の双方を保護したSchollkopf試薬を得る[16]。
出典
[編集]- ^ Corey RB (July 1938). “Crystal Structure of Diketopiperazine”. Journal of the American Chemical Society 60 (7): 1598–1604. doi:10.1021/ja01274a023.
- ^ a b c d e f g h i j Borthwick AD (May 2012). “2,5-Diketopiperazines: Synthesis, Reactions, Medicinal Chemistry, and Bioactive Natural Products”. Chemical Reviews 112 (7): 3641–3716. doi:10.1021/cr200398y. PMID 22575049.
- ^ a b Borthwick AD; Da Costa NC (2017). “2,5-Diketopiperazines in Food and Beverages: Taste and Bioactivity”. Critical Reviews in Food Science and Nutrition 57 (4): 718–742. doi:10.1080/10408398.2014.911142. PMID 25629623.
- ^ Shimoyama A, Ogasawara R (April 2002). "Dipeptides and diketopiperazines in the Yamato-791198 and Murchison carbonaceous chondrites". Origins of Life and Evolution of the Biosphere. 32 (2): 165–179. Bibcode:2002OLEB...32..165S. doi:10.1023/A:1016015319112. PMID 12185674. S2CID 21283306。
- ^ a b Minelli A, Bellezza I, Grottelli S, Galli F (August 2008). "Focus on cyclo (His-Pro): history and perspectives as antioxidant peptide". Amino Acids. 35 (2): 283–289. doi:10.1007/s00726-007-0629-6. PMID 18163175. S2CID 22563583。
- ^ Prasad C (Dec 1995). “Bioactive cyclic dipeptides”. Peptides 16 (1): 151–164. doi:10.1016/0196-9781(94)00017-Z. PMID 7716068.
- ^ Cornacchia C, Cacciatore I, Baldassarre L, Mollica A, Feliciani F, Pinnen F (January 2012). "Diketopiperazines as neuroprotective agents". Mini Reviews in Medicinal Chemistry. 12 (1): 2–12. doi:10.2174/138955712798868959. PMID 22070690。
- ^ a b c d Ilaria, Belleza (2014). “Cyclic dipeptides: from bugs to brain”. Trends in Molecular Medicine 20: 551–8.
- ^ Tullberg M, Grøtli M, Luthman K (July 2006). "Efficient synthesis of 2, 5-diketopiperazines using microwave assisted heating". Tetrahedron. 62 (31): 7484–7491. doi:10.1016/j.tet.2006.05.010。
- ^ Dömling A (January 2006). “Recent developments in isocyanide based multicomponent reactions in applied chemistry”. Chemical Reviews 106 (1): 17–89. doi:10.1021/cr0505728. PMID 16402771.
- ^ Rhoden CR, Rivera DG, Kreye O, Bauer AK, Westermann B, Wessjohann LA (October 2009). "Rapid Access to N-substituted diketopiperazines by one-pot Ugi-4CR/deprotection+ activation/cyclization (UDAC)". Journal of Combinatorial Chemistry. 11 (6): 1078–1082. doi:10.1021/cc900106u. PMID 19795905。
- ^ Marcaccini S, Pepino R, Pozo MC (April 2001). "A facile synthesis of 2, 5-diketopiperazines based on isocyanide chemistry". Tetrahedron Letters. 42 (14): 2727–2728. doi:10.1016/S0040-4039(01)00232-5。
- ^ Peng J, Clive DL (December 2008). "Asymmetric Synthesis of the ABC-Ring System of the Antitumor Antibiotic MPC1001". The Journal of Organic Chemistry. 74 (2): 513–519. doi:10.1021/jo802344t. PMID 19067592。
- ^ Nagel U, Menzel H, Lednor PW, Beck W, Guyot A, Bartholin M (May 1981). "Versuche zur Rhodium (I)-katalysierten asymmetrischen Hydrierung von α-Acetamidozimtsäure mit monomeren und polymeren Aminophosphinen/Rhodium (I) Catalyzed Asymmetric Hydrogenation of α-Acetamido Cinnamic Acid with Monomeric and Polymeric Aminophosphines". Zeitschrift für Naturforschung B. 36 (5): 578–584. doi:10.1515/znb-1981-0510. S2CID 95022362。
- ^ Chaignaud M, Gillaizeau I, Ouhamou N, Coudert G (August 2008). "New highlights in the synthesis and reactivity of 1, 4-dihydropyrazine derivatives". Tetrahedron. 64 (35): 8059–8066. doi:10.1016/j.tet.2008.06.080。
- ^ Wirth, Thomas (1997). “New Strategies toα-Alkylatedα-Amino Acids”. Angewandte Chemie International Edition in English 36 (3): 225–227. doi:10.1002/anie.199702251.