N,N'-ジシクロヘキシルカルボジイミド
| N,N'-ジシクロヘキシルカルボジイミド | |
|---|---|

| |

| |
N,N'-dicyclohexylcarbodiimide | |
別称 DCC | |
| 識別情報 | |
| CAS登録番号 | 538-75-0 |
| PubChem | 10868 |
| ChemSpider | 10408 |
| ChEBI | |
| ChEMBL | CHEMBL162598 |
| RTECS番号 | FF2160000 |
| |
| |
| 特性 | |
| 化学式 | C13H22N2 |
| モル質量 | 206.33 g mol−1 |
| 外観 | 白色結晶 |
| 密度 | 0.92 g/cm3 (20 ℃)、固体 |
| 融点 |
35 °C, 308 K, 95 °F |
| 沸点 |
122°C (395 K at 6 mmHg) |
| 水への溶解度 | 不溶 |
| 危険性 | |
| NFPA 704 | |
| Rフレーズ | R22 R24 R41 R43 |
| Sフレーズ | S24 S26 S37/39 S45 |
| 引火点 | 113 °C |
| 関連する物質 | |
| 関連するカルボジイミド | N,N'-ジイソプロピルカルボジイミド (DIC)、 1-(3-ジメチルアミノプロピル)-3-エチルカルボジイミド塩酸塩 (EDC) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
N,N'-ジシクロヘキシルカルボジイミド (N,N'-Dicyclohexylcarbodiimide, DCC) は分子式C13H22N2で表される有機化合物であり、主にペプチド合成におけるアミノ酸カップリングや、脱水縮合剤に用いられる[1]。標準状態においては、刺激臭のする白色結晶として存在している[1]。融点が低いので取り扱いを容易にするためにしばしば溶融させて利用される。ジクロロメタンやテトラヒドロフラン、アセトニトリルおよびジメチルホルムアミドなどの有機溶媒に対しては高い溶解度を示すが、水に対しては不溶である。ジシクロヘキシルカルボジイミドはしばしばDCCと略して呼ばれる。
構造およびスペクトル
[編集]DCC中のカルボジイミド基 (N=C=N) を含むC-N=C=N-Cの部分は直線構造をしており、アレンの構造と相関している。カルボジイミドを特徴づける3つの主要な共鳴構造は以下の通りである。
DCCのN=C=N結合は赤外分光スペクトルにおいて2117 cm−1に特徴的な吸収を与える[2]。15N NMRでは硝酸を標準物質として高磁場側275.0 ppmに特徴的なケミカルシフトが見られ、13C NMRではTMSを標準物質として低磁場側139 ppmに特徴的なピークが見られる[3]。
合成
[編集]DCCのいくつかの合成方法の内、Pri-Baraらは酢酸パラジウム(II)、ヨウ素、酸素をシクロヘキシルアミンとクロヘキシルイソシアニドのカップリングに用いた[4]。収率は最高で67 %であり、以下の経路で達成された。
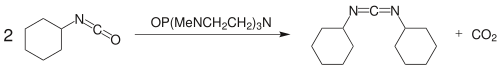
Tangらは、2つのイソシアン酸塩をOP(MeNCH2CH2)3Nを触媒として用いて縮合させる方法によって、92 %の収率でDCCを合成した[2]。
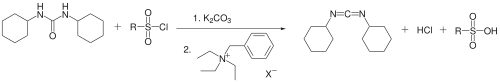
DCCはまた、Jaszayらによって相間移動触媒を用いてジシクロヘキシル尿素から合成されている。二置換尿素であるジシクロヘキシル尿素、アレーンスルホニルクロライドおよび炭酸カリウムをベンジルトリエチルアンモニウムクロリド存在下、トルエン溶媒中で反応させることによって、50 %の収率でDCCが得られている[5]。
反応
[編集]DCCはアミド、ケトン、ニトリルを合成する際の脱水剤である。これらの反応において、DCCは水和して非水溶性のジシクロヘキシル尿素 (DCU) を形成する。DCCはまた、第二級アルコールをワルデン反転させるためにも用いることができる。
フィッツナー・モファット酸化
[編集]DCCのジメチルスルホキシド (DMSO) 溶液は、いわゆるフィッツナー・モファット酸化を引き起こす。この方法は、アルコールをアルデヒドやケトンへと酸化させるために用いられる。金属が関与する酸化反応とは異なり、アルデヒドがカルボン酸にまで過剰に酸化されることを防ぐ程度に穏やかな反応条件である。通常、DMSO中で3当量のDCCおよび0.5当量プロトン源とともに一晩室温で反応させる。この反応は酸によって停止する。
脱水
[編集]アルコール類はまた、DCCを用いて脱水することもできる。この反応は、対応するアルケンを生成するために水素化分解されたO-アシルウレア中間体を与えることで進行する。
第二級アルコールのワルデン反転
[編集]第二級アルコールは、鹸化によるホルミルエステルの形成によって立体化学的に反転させることができる。第二級アルコールは、直接DCC、ギ酸、および、ナトリウムメトキシドのような強塩基と混ぜ合わされる。
エステル化
[編集]多少の第三級アルコールさえも含む範囲のアルコール類において、DCCおよび触媒量のN,N-ジメチル-4-アミノピリジン存在下でカルボン酸を用いてエステル化することができる[6]。
DCCによるペプチドカップリングの促進
[編集]例えば9-フルオレニルメチルオキシカルボニル基(Fmoc基)を利用したペプチド固相合成法のようなタンパク質合成において、N末端はしばしばアミノ酸モノマーを導入する際の結合点として用いられる。カルボキシレート基の求電子性を高めるために、マイナス電荷を持った酸素原子は初めによりよい脱離基へと「活性化」されなければならず、その目的のためにDCCが用いられる。マイナス電荷を持った酸素原子は求核剤として働き、DCCのカルボジイミド基の中心に位置する炭素を求核攻撃する。DCCは一時的にカルボキシレート基に付加して非常に求電子性の高い中間体を形成し、ペプチド結合の成長におけるN末端による求核攻撃がより効果的となる。
このようなDCCによるペプチド結合の形成は広く汎用的に用いられる手法であるが、副生するジシクロヘキシル尿素を反応系から除去する操作が困難である場合が多い。そのため、DCCに代わる副生物の除去が容易な縮合剤が開発されており、N-(3-ジメチルアミノプロピル)-N'-エチルカルボジイミド (EDC)のような水溶性カルボジイミドが普及している[7]。
安全性
[編集]DCCは強力なアレルギー誘発物質および感作物質であり、しばしば皮膚の発疹を引き起こす[1]。
出典
[編集]- ^ a b c “N,N’-ジシクロヘキシルカルボジイミド MSDS”. 厚生労働省. 2012年8月13日閲覧。
- ^ a b Jiansheng Tang, Thyagarajan Mohan, John G. Verkade (1994). “Selective and Efficient Syntheses of Perhydro-1 ,3,5-triazine-2,4,6-trioneasn d Carbodiimides from Isocyanates Using ZP(MeNCH2CH2)sN Catalysts”. J. Org. Chem. 59 (17): 4931–4938. doi:10.1021/jo00096a041.
- ^ Issa Yavari, John D. Roberts (1978). “Nitrogen-15 Nuclear Magnetic Resonance Spectroscopy. Carbodiimides”. J. Org. Chem. 43 (25): 4689–4690. doi:10.1021/jo00419a001.
- ^ Ilan Pri-Bara and Jeffrey Schwartz (1997). “N,N-Dialkylcarbodiimide synthesis by palladium-catalysed coupling of amines with isonitriles”. Chem Commun 4 (4): 347. doi:10.1039/a606012i.
- ^ Zsuzsa Jaszay, Imre Petnehazy, Laszlo Toke, Bela Szajani (1987). “Preparation of Carbodiimides Using Phase-Transfer Catalysis”. Synthesis 5 (5): 520–523. doi:10.1055/s-1987-27992.
- ^ B. Neises, W. Steglich (1990). "Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: Tert-Butyl Ethyl Fumarate". Organic Syntheses (英語).; Collective Volume, vol. 7, p. 93
- ^ “ペプチド合成”. Aldrich ChemFiles (Sigma-Aldrich) 7 (2): 5. (2007).
関連項目
[編集]外部リンク
[編集]- DCCの詳細な反応例 Peptides -- Sequencing and Synthesis - CSUDH WWW Project For Chemistry