ジュリア・リスゴーオレフィン化
ジュリア・リスゴー オレフィン化 (Julia-Lythgoe olefination) もしくは ジュリア反応 (Julia reaction) とは、有機化学における合成法のひとつで、下式のようにフェニルアルキルスルホン 1 とカルボニル化合物 を基質としてアルケン 3 を得る手法[1][2]。1 に強塩基(式では n-ブチルリチウム)、カルボニル化合物、求電子種 R3-X を順番に作用させて付加体 2 とし、ナトリウムアマルガム[3][4]またはヨウ化サマリウム(II)[5]により還元的脱離を起こして 3 とする。
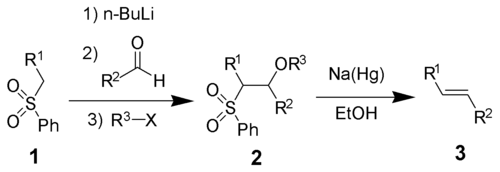
上式の多段階反応はワンポットで行うことができる。求電子剤 R3X は必ずしも使わなくとも良いが、2 の形に誘導すると高い収率や純度が得られる。通常 R3 はアセチル基かベンゾイル基であり、例えば無水酢酸や塩化ベンゾイルなどが用いられる。
生成物はトランス体のアルケンが優先する。本手法は M. Julia と J.-M. Paris によって発見され、B. Lythgoe と P. J. Kocienski によってさらなる研究と改良がなされた。
反応機構
[編集]反応機構を下のスキームに示す。スルホン 1 から強塩基によりカルバニオン 2 が発生し、アルデヒドに付加してアルコキシド 3 を生じる。これを求電子剤 R3-X で捕捉して安定な中間体 4 とする。ナトリウムアマルガムによる還元的脱離の機構ははっきりしていないが、ビニルラジカル 5 を経るといわれる[5]。最後に溶媒を水素源としてアルケン 6 が得られる。
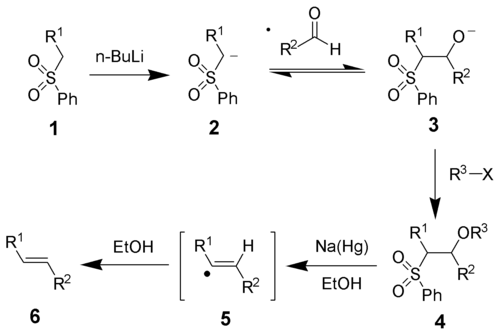
生成するアルケン 6 の立体化学と中間体 4 の立体の間に相関は無い。ラジカル的中間体の段階で何らかの平衡があり、熱的に安定なトランス体へ寄るといわれている。
関連反応
[編集]ベンゾチアゾリルスルホン
[編集]基質のフェニル基を複素芳香環に置き換えると、異なった反応が現れる[6]。よく知られているのは、2-ベンゾチアゾリルスルホンを用いた手法である[7]。下のスキームのように、ベンゾチアゾリルスルホン 1 を LDA でアニオン化した後にアルデヒド(またはケトン)と作用させるとアルコキシド中間体 2 が発生する。フェニルスルホンの場合と異なり、2 は分子内でスマイルス転位を起こし、3 を経てスルフィナート 4 となる。この 4 がさらに自発的に二酸化硫黄とベンゾチアゾロンアニオン 5 を放出し、アルケン 6 が残る。

この手法は従来の手法と異なりラジカル中間体を経ないため、生成物の立体化学は付加体 4 の立体に依存する。そのためしばしば、シス-トランス異性体の混合物が生ずる。
ジュリア・コシェンスキー オレフィン化
[編集]ジュリア・コシェンスキー オレフィン化 では、基質としてテトラゾリルスルホンが用いられる[8]。機構は上記のベンゾチアゾール法と同様である。一例では THF中、tert-ブチルテトラゾリル=メチル=スルホンへ −70 ℃ でナトリウムビス(トリメチルシリル)アミドを作用させ、ケトンをメチレン化する。もしくは炭酸セシウムを 70 ℃で用いてもよい[9]。
脚注
[編集]- ^ 総説: Kocienski, P. J. Phosphorus and Sulfur 1985, 24, 97-127.
- ^ 総説: Kelly, S. E. Comp. Org. Syn. 1991, 1, 792-806.
- ^ Julia, M.; Paris, J.-M. Tetrahedron Lett. 1973, 14, 4833-4836. DOI: 10.1016/S0040-4039(01)87348-2
- ^ Kocienski, P. J.; Lythgoe, B.; Ruston, S. J. Chem. Soc., Perkin Trans. 1 1978, 829-834. DOI: 10.1039/P19780000829
- ^ a b Keck, G. E.; Savin, K. A.; Weglarz, M. A. J. Org. Chem. 1995, 60, 3194-3204. DOI: 10.1021/jo00115a041
- ^ 総説: Blakemore, P. R. J. Chem. Soc., Perkin Trans. 1 2002, 2563–2585. DOI: 10.1039/b208078h
- ^ Baudin, J. B.; Hareau, G.; Julia, S. A.; Ruel, O. Tetrahedron Lett. 1991, 32, 1175. DOI: 10.1016/S0040-4039(00)92037-9
- ^ Blakemore, P. R.; Cole, W. J.; Kocieński, P. J.; Morley, A. Synlett 1998, 26-28. DOI: 10.1055/s-1998-1570
- ^ Aïssa, C. J. Org. Chem. 2006, 71, 360-363. DOI: 10.1021/jo051693a
