ターフェル式
この項目「ターフェル式」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en:Tafel equation) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2016年10月) |
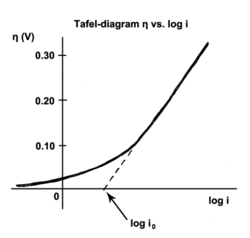
電気化学速度論において、ターフェル式 (Tafel equation) とは電気化学反応の速度と過電圧との間の関係を記述する方程式である[1]。最初は実験結果から推論された実験式だったが、後に理論的な正当化が成された。ターフェル式の名前はスイス人化学者のユリウス・ターフェルに由来する。
単一の電極に関するターフェル式は、次のように書き下される。
ここで、次のような変数を用いた。
項に関する概要
[編集]交換電流密度とは、平衡状態にある際の電流密度、すなわち酸化剤と還元剤の間でやりとりされる電子の密度を表わす。言い換えれば、交換電流密度とは可逆電極電位(定義上過電圧が零となる電位)における電流密度である。可逆電極電位においては、順反応と逆反応とが同じ速度で進行しているという意味で反応は平衡状態にある。この速度こそが交換電流密度である。
ターフェル勾配は実験的に測定される物理量である。しかし、支配的な反応機構が条件
を満たすような単一電子移動反応の場合、 A は理論的に次のように定義できる。
ここで、次のような変数および定数を用いた。
別の形式
[編集]ターフェル式は次のように書き下すこともできる。
ここで、
適用範囲
[編集]電気化学的反応が、別々の電極上で二つの半反応式として進行する場合、ターフェル式は各電極に別々に適用することができる。
ターフェル式は順反応速度に比べて逆反応速度が無視できるという仮定に立脚している。
ターフェル式は分極が大きい領域に適応することができる。分極が小さい場合には、分極の電流に対する依存性は(ターフェル式が記述するような指数関数的なものではなく)線形なものになる。
- .
この線形領域は、オームの法則との形式の類似性から「抵抗分極」領域と呼ばれる。
関連項目
[編集]出典
[編集]- ^ Bard, A. J.; Faulkner, L. R. (2001). Electrochemical Methods. Fundamentals and Applications (2nd ed.). New York.: Wiley. ISBN 0-471-04372-9
- Burstein, G.T. (2005). “A hundred years of Tafel’s Equation: 1905–2005”. Corrosion Science 47 (12): 2858–2870. doi:10.1016/j.corsci.2005.07.002. ISSN 0010-938X.





