ワルファリン
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 胎児危険度分類 | |
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 100% |
| 血漿タンパク結合 | 99.5 |
| 代謝 | Hepatic: CYP2C9, 2C19, 2C8, 2C18, 1A2 and 3A4 |
| 半減期 | 2.5 日 |
| 排泄 | 腎臓(92%) |
| データベースID | |
| CAS番号 | 81-81-2 |
| ATCコード | B01AA03 (WHO) |
| PubChem | CID: 6691 |
| DrugBank | APRD00341 |
| KEGG | D08682 |
| 化学的データ | |
| 化学式 | C19H16O4 |
| 分子量 | 308.33 |
ワルファリン(英: warfarin)は、抗凝固剤の1つ。殺鼠剤としても用いる。ワルファリンカリウムが医薬品として使われ、商品名はワーファリン、及びワルファリンK。投与方法は経口(内服)のみである。
効果・効能
[編集]血栓塞栓症の治療および予防に用いられる。心臓弁膜症に対する機械弁を用いた弁置換術後や心房細動が原因となる脳塞栓症予防、あるいは深部静脈血栓症による肺塞栓症予防のために、また抗リン脂質抗体症候群での血栓症予防のためにしばしば処方される(抗リン脂質抗体症候群での投与については副作用・禁忌の節を参照)。
欧州および日本では同剤による抗凝固療法の効果を、トロンボテスト測定により凝固活性(%)あるいはINR値をモニターする方法が普及していた。現在では世界的にプロトロンビン時間のINR値を用いることが各ガイドラインで推奨されている。服用から効果発現までに12 - 24時間かかり[1]、さらにプロトロンビン時間[PT]あるいはトロンボテスト[TT]によるINR値が安定するには3日から4日は必要である。
このため、脳塞栓症や肺塞栓症の急性期、あるいは播種性血管内凝固で緊急に凝固系の抑制を必要とする際には、効果が期待できない。このような場合にはヘパリンを経静脈投与する。ただし脳塞栓症などで早期離床を目的としたり、慢性期治療に早めに移行したいときに、急性期のうちからヘパリン投与と並行して、内服を開始することはある。
また、服用している場合は、抗血小板療法と違って、上記のような効果判定のための血液検査を定期的に実施する必要がある。抗血小板剤との違いは、抗血小板剤は動脈での血栓予防が主であり、静脈系を含めた血栓予防には、同剤を用いなくてはならないことである。
作用機序
[編集]血液凝固因子のうち第II因子(プロトロンビン)、第VII因子、第IX因子、第X因子の生合成は肝臓で行われ、ビタミンKが関与している。ビタミンKエポキシドレダクターゼのC1サブユニット(VKORC1)に結合能を持つことにより、ビタミンKと競合阻害する。これにより前述の凝固因子らの生合成を抑制し(総量で30 - 50%低下し、生物活性も10 - 40%低下する)、その結果として血液の凝固を妨げる。抗凝固作用は第II因子(プロトロンビン)の活性低下によるところが大きいと考えられている。効果は凝固因子の生合成によるため実際の効果発現に3日から4日かかり、内服中止しても4日から5日効果が継続する。
使用方法
[編集]トロンボテストで、10% - 20%、あるいはPT-INRが1.6 - 3.0になるように調整していく。維持量としては2 - 6mg/日であることが多い。目標とするINRは疾患、患者によって異なる。高度な抗凝固効果としはINR2.0 - 3.0、軽度の抗凝固効果としてはINR1.6 - 2.4と考えられている。例えば心房細動で抗凝固療法が必要と考えられる患者に対しても70歳未満ならば高度の抗凝固効果を期待した投与を行い、70歳以上ならば軽度の抗凝固効果を期待した投与を行う。70歳未満で抗凝固療法が必要な患者ではINRが2.0を下回った時点で血栓ができても仕方がないと状態と考える。INR2.0 - 3.0は常に確実に2.0を超えるようにという意味であり、INR1.6 - 2.4は基本的には2.0を上回るように投与するという意味である。実際に心房細動ではINR2.0未満になると急激に血栓症発症の危険性が高まるという報告がある。しかし、投与量と効果は単純な相関関係ではないため、管理は簡単ではない。BAATAF研究では、PT-INR 1.5 - 2.7にコントロールした低用量ワーファリン療法により非弁膜性心房細動患者の脳梗塞は86%、総死亡は62%抑制された[2]。
治療効果をモニタリングしながら投与すれば、大量出血を起こす可能性はきわめて低い。高齢者の皮下出血などは、治療域のINR範囲ならば忌避すべき副作用とは考えないのが一般的である。出血がなくともINRが4.0を超えた場合は2日間程度投与を中止した後再検査を行う。また、例えば、拮抗薬であるビタミンKを投与すると6時間ほどでINRは減少するが、拮抗効果が持続するためあまり好まれない。万が一大量出血が起こってしまったら、新鮮凍結血漿(FFP)を投与し凝固因子を補う。
入院中では5mg/日にて投与を開始し、3日目にINRを測定し、それ以後の投与を決定する医師が多いが、その時点ですでにINRが治療域を超えてしまうこともあり、維持量が決まるまでは24時間ごとに測定することが望ましい。しかし、具体的なINRに基づいた投与量の設定方法の基準がなく、医師の経験に基づいて投与量が決定されているため、INRの測定頻度も医師によってさまざまとなっている。このため、日本人用の投与開始ノモグラムの作成が強く望まれているが、個々の患者の個人差を総括して作成する必要があり、近年まで成功していなかった。最近、日本人用のノモグラムが報告され始めており[3]、これらノモグラムの第三者による検証が望まれる。上記のように効果発現に時間がかかるため、INRが上昇を始めるまでは効果発現が速いヘパリンを点滴静注することがある。疾患によって投与量が異なるが再灌流療法後ならばKN1Aなど500mlの輸液にヘパリンを体重(Kg)×12×24単位を目安に20ml/hrで投与するという簡便な方法が知られている。ヘパリンの効果判定にはAPTTが施設基準上限値の1.5 - 2.5倍内であることとされている。
モニタリングと国際標準比(INR)
[編集]血液凝固系に関する検査方法において、国際血栓止血学会の科学標準化委員会におけるトロンボプラスチン製剤の標準化により、動物あるいはヒト由来原材料を利用したPT測定のINR表記が普及してきている。PT測定による単位としてのINR表記であり、PT-INR測定法という検査方法ではないことに留意すべきである。また、INR(International Normalized Ratio)という単位をInhibition Ratioと間違った記述で報告されている日本での論文があるので、決して間違ってはいけない。
一方、日本、北欧やオーストリアなどの欧州では、トロンボテスト[注 1]によるモニタリングが検査法として利用されている。その理由は、モニタリングする検査薬の測定精度という観点で、トロンボテストの方がPT測定法よりも、投与によって生ずるビタミンK依存性凝固タンパク質(第II因子、第VII因子、第X因子)を正確に測定できるというアッセイ原理になっているからである。PT測定は、第II因子、第VII因子、第X因子だけではなく、フィブリノゲン(第I因子)の検査値(健常人200 - 400mg/dL)および第V因子の検査値やその影響を含めた凝固活性としてINRに影響を及ぼすことを考慮する必要がある。なお、トロンボテストは、PT検査の欠点を補った改良された定量性の高い血液凝固検査法である。
(引用)家庭の医学(第13版)時事通信社 細田瑳一ら監修[要検証]
PT-INRとTT(%)の関係は一般的に以下となる。
- PT-INR 2.0 = TT 17%
- PT-INR 3.0 = TT 9%
他剤との併用、食品との関係
[編集]多くの医薬品との併用によって、その作用が増強あるいは減弱する薬物相互作用のあることが知られている。例えば、三環系抗うつ剤と併用すると効果が増してしまい、副腎皮質ホルモン剤と併用すると効果が減少する。よって服用している人は、医師・歯科医師・薬剤師に、必ずその旨を伝える必要がある。
納豆、クロレラ、青汁などのビタミンKの多い食品を取ると効果は弱まるが、代謝に影響を及ぼすブコロームを併用することで、効果が増強・安定することがある。副作用ともいえるが、これを利用して処方量を減量したり、解毒することもできる。しかし、解熱鎮痛剤であるブコロームを長期間服用することになるため、胃潰瘍や腎不全などのリスクが上昇する可能性があると考えられ、本来、患者に対して説明が必要となる療法であろう[要出典]。
副作用・禁忌
[編集]催奇形性が指摘されており、妊婦に対しての投与は禁忌である。抗リン脂質抗体症候群は妊娠可能年齢の女性に多く見られ、習慣性流産を主な症状とするが、妊娠を望む場合は投与を中止し、分娩時まで低用量アスピリン[注 2] 経口投与またはヘパリンの経皮投与あるいはその併用などに変更する必要がある[4][5]。
出血している患者、出血の可能性のある患者(内臓腫瘍、消化管の憩室炎、大腸炎、亜急性細菌性心内膜炎、重症高血圧症、重症糖尿病など)のほか、中枢神経系に受傷(手術を含む)して日の浅い患者では脳・脳幹出血などの危険があるので、禁忌である[1]。重篤な肝障害や腎障害を持つ患者、メナテトレノンやイグラチモドを服用中の患者にも禁忌。
その他に重大な副作用として、脳出血などの臓器内出血、粘膜出血、皮下出血、皮膚壊死、肝機能障害、黄疸が挙げられている[1]。
併用禁忌
[編集]- メナテトレノン(ビタミンK2)は効果(ビタミンK依存性凝固因子の生合成阻害)を減弱するので、投与してはならない。
- 抗リウマチ薬のイグラチモドで効果が増強されるので、併用禁忌である。
- 抗真菌薬であるミコナゾールを併用すると、代謝が強力に阻害され、致死的に効果が増大する[1]。
殺鼠剤
[編集]ヒトの医薬品としてだけでなく、殺鼠剤(ネズミ取りの薬剤)として使われる。摂取したネズミは、網膜の内出血で視力低下するため、明るいところに出てくる。最終的には止血出来ずに、腹腔内の内出血で死亡する。ヒトが誤食した場合は、解毒のためビタミンKを経口投与する。
しかし、クマネズミでは肝臓の解毒機能の優れた、薬剤抵抗性を持つ個体は生存できる。これが繁殖し「ワルファリン抵抗性ネズミ」、NHKによる命名で一般化した呼称「スーパーラット」となり、防除の問題となっている[6]。
化学
[編集]この節の加筆が望まれています。 |
互変異性
[編集]X線結晶解析の結果より、互変異性体として存在する。すなわち、クマリン骨格4位のヒドロキシ基と3位の側鎖のケトンがヘミケタールを形成し閉環している構造とそうでない(開環している)構造の2つの構造異性体間での平衡状態として存在する[7]。しかし、抗凝固薬として側鎖にケト基のない4-ヒドロキシクマリン誘導体が多く存在する(フェンプロクモンなど)事実は、抗凝固作用を発揮するためには非ヘミケタール型となる必要があることを示している[8]。
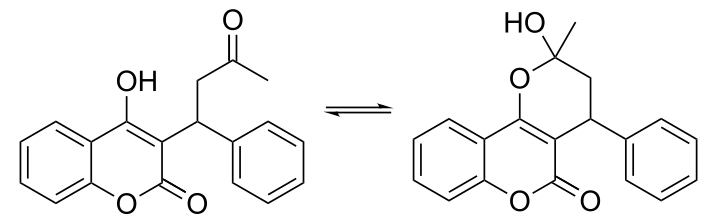
開環構造(左)とヘミケタール閉環構造(右)
鏡像異性
[編集]不斉中心が1つあり、( R )と ( S ) の2つのエナンチオマーが存在する[9]。
| ワルファリンのエナンチオマー | |
|---|---|
 CAS-Nummer: 5543-58-8 (R体) |
 CAS-Nummer: 5543-57-7 (S体) |
合成
[編集]歴史
[編集]この節の加筆が望まれています。 |

1920年代に、北アメリカでウシが内出血を起こし、止血出来ず死亡する病気が発生した。1921年にカナダの獣医病理学者フランク・スコフィールドが、その原因が腐敗したスイートクローバーを餌として与えた事が原因と突き止め、1929年にはノースダコタの獣医L.M.ロデリック博士が、トロンビン不足によって病気が発生することを突き止めた。
しかし腐敗したスイートクローバーが、なぜこの病気を引き起こしたのかは1940年まで謎であった。1933年にウィスコンシン大学マディソン校のカール・パウル・リンク(en:Karl Paul Link)の研究室で、その原因と目される物質が単離された。これがクマリンが腐敗によって変化したジクマロールであり、病気の原因物質がこれであることが確定したのは、1940年のことであった[10]。
1941年に、齧歯類の駆除剤として市販されたジクマロールより、その効果を高めるため1948年に改良されたものである。
1951年、アメリカ陸軍でワルファリンを服用して自殺を試みた者が、ビタミンKの投与で一命を取り留める事件が発生した。この一件で毒物としてだけでなく、抗凝固剤として病気の治療にも使えることが分かり、1954年に治療用の医薬品として承認された。この処方が行われた著名人として、1955年に心臓発作を起こした、アメリカ合衆国大統領ドワイト・D・アイゼンハワーが挙げられる。抗凝固剤としての作用機序が解明されたのは、1978年の事であった。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b c d “ワーファリン錠0.5mg/ワーファリン錠1mg/ワーファリン錠5mg 添付文書” (2016年10月). 2016年11月6日閲覧。
- ^ The Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators. The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation. N Engl J Med 1990; 323: 1505-11.
- ^ 五十嵐正博、石綿清雄、藤本陽、高尾麻子、小田泰弘、田村宏美、伊藤忠明、林 昌洋、竹内幸一、百村伸一、大野 実. “ワルファリン導入ノモグラム作成とその評価”. TDM研究 (日本TDM学会) 29 (4): 118-124 2016年7月18日閲覧。.
- ^ Bates et al. (2004)
- ^ Lim et al. (2006)
- ^ 田中和之, 常仁春成, 谷川力 ほか、「国内におけるワルファリン抵抗性ネズミの現況 いわゆるスーパーラットについて」『環境毒性学会誌』 2009年 12巻 2号 p.61-70, doi:10.11403/jset.12.61
- ^ Valente, E. J.; Trager, W. F.; Jensen, L. H. (1975). “The crystal and molecular structure and absolute configuration of (?)-(S)-warfarin”. Acta Crystallogr. B 31 (4): 954-960. doi:10.1107/S056774087500427X.
- ^ Karlsson BC, Rosengren AM, Andersson PO, Nicholls IA (September 2007). “The spectrophysics of warfarin: implications for protein binding”. J Phys Chem B 111 (35): 10520-8. doi:10.1021/jp072505i. PMID 17691835.
- ^ Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 - Arzneimittelverzeichnis fur Deutschland (einschlieslich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 226.
- ^ 抗凝血薬「ワルファリン」はこうして生まれた - Nature Japan
参考文献
[編集]- Bates, SM; Greer, IA; Hirsh, J; Ginsberg, JS (2004), “Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy”, Chest 126: 627S-644S, PMID 15383488full text
- Lim, Wendy; Crowther, Mark A.; Eikelboom, John W. (2006), “Management of antiphospholipid antibody syndrome: a systematic review”, JAMA 295: 1050-1057, PMID 16507806full text
- 櫻川信男・上塚芳郎・和田英夫 編『抗凝固薬の適正な使い方』(第2版)医歯薬出版、2008年10月. ISBN 978-4-263-73105-5
外部リンク
[編集]- 食品とワルファリンカリウムに関するお問い合わせについて - エーザイ
- ワーファリン関連情報 - エーザイ医療関係者のみなさまへ:Warfarin適正使用情報、患者さま用資料紹介など
- 血栓止血の臨床(日本血栓止血学会)
- 血栓症・止血異常症診療センター
- ワルファリンとINR
- 循環器病情報センター
