化学浸透
化学浸透(かがくしんとう、英: chemiosmosis)とは、イオンが電気化学的勾配に従って半透膜を越えて移動することである。例としては、細胞呼吸や光合成の過程において、膜を越えた水素イオン(H+)の移動によってアデノシン三リン酸(ATP)が産生されることなどが挙げられる。
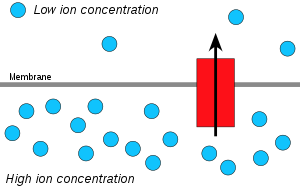
水素イオン(プロトン)は高濃度の領域から低濃度の領域へと拡散し、膜を挟んだプロトンの電気化学的勾配がATPの合成に利用される。この過程は膜を越えて水が拡散する浸透と関連しており、そのため「化学浸透」と呼ばれている。
ATP合成酵素は、化学浸透によってATPを合成する酵素である。ATP合成酵素は膜を越えてプロトンの通過を可能にし、その自由エネルギー差を利用してアデノシン二リン酸(ADP)をリン酸化してATPを合成する。化学浸透によるATP産生は、ミトコンドリアと葉緑体とともに大部分の細菌と古細菌でも起こる。
化学浸透説
[編集]ピーター・ミッチェルは1961年に化学浸透仮説を提唱した[1]。その理論は、呼吸を行う細胞でのATP合成のエネルギーの大部分は、グルコースなどの高エネルギー分子の分解によって形成されたNADHやFADH2のエネルギーを利用した、ミトコンドリア内膜を挟んだ電気化学的勾配に由来することを示唆するものであった。
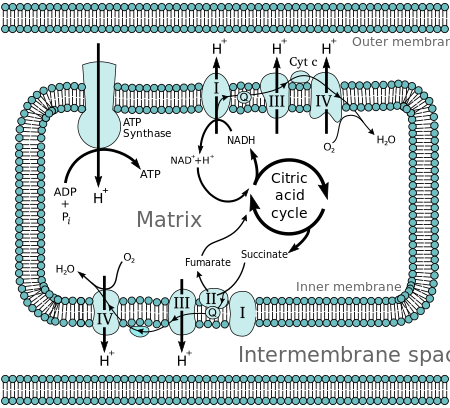
グルコースのような分子は代謝によって、高エネルギー中間体としてアセチルCoAを産生する。ミトコンドリアマトリックスにおけるアセチルCoAの酸化は、ニコチンアミドアデニンジヌクレオチド(NAD)やフラビンアデニンジヌクレオチド(FAD)といったキャリア分子の還元と共役している[2]。キャリア分子はミトコンドリア内膜の電子伝達系に電子を伝達し、その後電子伝達系の他のタンパク質へと伝達されてゆく。エネルギーはマトリックスからプロトンを汲み出すために用いられ、エネルギーは膜を挟んだ電気化学的勾配の形で貯蔵される。プロトンはATP合成酵素を通って内膜を越えてマトリックスへ戻る。ATP合成酵素を経由して戻るプロトンの流れは、ADPと無機リン酸を結合させてATPを形成するのに十分なエネルギーを提供する。電子伝達系の最後のポンプで電子とプロトンは酸素分子に取り込まれ、水分子が形成される。
この理論は当時としては急進的な提案であり、良く受け入れられなかった。当時広く行き渡っていたのは、電子伝達のエネルギーは安定な高ポテンシャル中間体として貯蔵される、というより保守的な考えであった。この古いパラダイムの問題点は、そのような高エネルギー中間体が見つかっていないこと、そして電子伝達系によるプロトンの汲み上げの証拠が無視できないほど強くなっていたことであった。次第に化学浸透仮説を支持する証拠が積み上げられていき、1978年にミッチェルはノーベル化学賞を受賞した[3]。
化学浸透との共役は、ミトコンドリア、葉緑体[4]、そして多くの細菌と古細菌[5]におけるATP産生で重要である。
プロトン駆動力
[編集]
膜を越えたイオンの移動は、2つの因子の組み合わせに依存する。
- 濃度勾配による拡散力 - すべての粒子は高濃度側から低濃度側へ拡散する傾向がある。
- 電位勾配による静電力 - プロトン(H+)のようなカチオンは電位勾配に従って陽極側から陰極側へ拡散する傾向がある。アニオンは自発的に反対方向へ拡散する。
これらの2つの勾配はまとめて電気化学的勾配と表現される。
生体膜の脂質二重層はイオンの移動の障壁となる。そのためエネルギーは膜を挟んだ2つの勾配の組み合わせとして貯蔵される。イオンチャネルのような特別な膜タンパク質だけが、時おり膜を越えてイオンを通過させることができる(膜輸送を参照)。化学浸透説においてATP合成酵素は極めて重要である。ATP合成酵素は、自身を通過するプロトンの自発的な流れによるエネルギーをATPの化学結合のエネルギーへと変換する。
そのため研究者らは、前述した電気化学的勾配から派生して、プロトン駆動力(proton-motive force、PMF)という用語を作り出した。プロトン駆動力は、プロトンの濃度勾配と電位勾配の組み合わせとして貯蔵されるエネルギーの尺度として説明される。電気的な勾配は膜を挟んだ電荷の分離(プロトンは塩化物イオンといった対イオンを伴わず移動する)によって生じる。
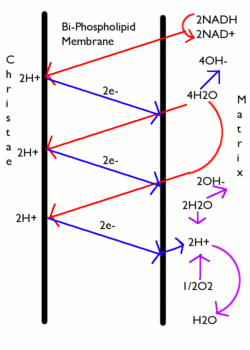
ほとんどの場合において、プロトン駆動力はプロトンポンプとして機能する電子伝達系によって生成される。電子伝達系は酸化還元反応のギブズエネルギーを利用してプロトンを汲み出し、膜を挟んで電荷を分離する。ミトコンドリアでは、電子伝達系によって放出されるエネルギーがミトコンドリアマトリックス(陰極側)からミトコンドリア膜間腔(陽極側)へプロトンを移動するために利用される。ミトコンドリア外へのプロトンの移動は正に帯電したプロトンの濃度を低下させるため、膜の内側ではより多くの負電荷が形成される。電位勾配は約 -170 mVである[6]。ミトコンドリアではプロトン駆動力はほぼ完全に電気的な要素で構成されるが、葉緑体におけるプロトン駆動力は、プロトンの電荷は塩化物イオンや他のアニオンの移動によって中和されるため、ほぼpH勾配によって形成されている。どちらの場合でも、ATP合成酵素がATPを合成するには約 460 mV(45 kJ/mol)以上のプロトン駆動力が必要である。
方程式
[編集]プロトン駆動力はギブズエネルギーに由来する。Nを細胞の内側、Pを細胞の外側とすると次のように表される[6]。
1モルあたりのギブズエネルギー変化は、しばしば1モルあたりの電気化学ポテンシャルとして解釈される。
プロトンの電気化学的勾配に関してはであり、したがって次のように表される。
ただし
- .
ミッチェルはプロトン駆動力を次のように定義した。
- .
例えば、のとき、である。では、は次のようになる。
.
P側(相対的に陽極で酸性)からN側(相対的に陰極で塩基性)への自発的なプロトンの移動に関しては、は(と同様に)負となるが、プロトン駆動力は(酸化還元電位と同様に)正となる。
他の膜輸送過程と同様、プロトン駆動力には方向性がある。膜電位は、細胞内へ流入する単位電荷あたりの電位変化を表すように選ばれる。さらに、共役部位での酸化還元反応によるプロトンの汲み上げのため、プロトン勾配は常に内側が塩基性となる。これらの理由のため、プロトン駆動力は自発的なプロトンの流入のために定義されている。共役部位でのプロトンの汲み上げといったプロトンの排出のためのプロトン駆動力は、単純に流入のためのプロトン駆動力を負にした値となる。
プロトンの(P側からN側への)流入の自発性は、すべての生体膜に共通である[8]。このことは1990年代までは認識されておらず、それは葉緑体のチラコイドルーメンが内側の相であると解釈されていたためであるが、実際にはルーメンは葉緑体外部とトポロジー的に等価である。Azzoneらは、内相(膜のN側)は、細菌では細胞質、ミトコンドリアではマトリックス、葉緑体ではストロマであり、外相(膜のP側は)、細菌ではペリプラズム、ミトコンドリアでは膜間腔、葉緑体ではルーメンであることを強調した。さらに、ミトコンドリア内膜の3Dトモグラフィーによって、内膜に多く存在する陥入部はチラコイドのディスクのようにスタッキングしており、したがってミトコンドリア膜間腔がトポロジー的に葉緑体ルーメンにきわめて類似していることが示された[9]。
ここでギブズエネルギー、電気化学的勾配、またはプロトン駆動力として表されたエネルギーは、膜を挟んだ2つの勾配、濃度勾配()と電位勾配()の組み合わせである。
系が平衡に達したとしても、必ずしも膜の両側の濃度が等しくなるわけではない。
ATP合成()の1モル当たりのギブズエネルギー()はリン酸化ポテンシャル(phosphorylation potential)とも呼ばれる。平衡濃度比は、とを比較して計算することで得られる。例えば、哺乳類のミトコンドリアの場合は、次のようになる[9][要検証]。
H+ / ATP = ΔGp / (Δp / 10.4 kJ·mol−1/mV) = 40.2 kJ·mol−1 / (173.5 mV / 10.4 kJ·mol−1/mV) = 40.2 / 16.7 = 2.4
実際にプロトンを結合するcサブユニットとATPを合成するβサブユニットのコピー数の比は 8/3 = 2.67 であり、この状況ではミトコンドリアは90%(2.4/2.67)の効率で機能することが示される[9]。
真核生物の細胞では、ATPはマトリックスから細胞質へ、ADPとリン酸は細胞質からマトリックスへ輸送される必要があるため、実際の熱力学的効率はもっと低くなる。この過程でATP1分子あたり1つのプロトンが余分に消費されるため[6][7]、実際の効率は65%(2.4/3.67)である。
ミトコンドリアにおいて
[編集]
酸素存在下でのグルコースの完全な分解は、細胞呼吸と呼ばれてている。この過程の最終段階はミトコンドリアで行われる。NADHやFADH2といった還元分子はクレブス回路、解糖系、ピルビン酸の加工によって産生される。これらの分子は電子伝達系に電子を受け渡し、そのエネルギーはミトコンドリア内膜を挟んだプロトン勾配を作り出すために利用される。その後、ATP合成酵素はプロトン勾配の形で貯蔵されたエネルギーを利用してATPを合成する。この過程は、NADHやFADH2の酸化によって放出されたエネルギーを用いてADPをATPへリン酸化することから、酸化的リン酸化と呼ばれる。
植物において
[編集]光合成の光化学反応は、化学浸透作用によってATPを産生する。日光からの光子は光化学系IIのアンテナ複合体によって受容され、電子を高エネルギー状態へ励起する。電子は電子伝達系を移動し、チラコイド膜を越えてチラコイドルーメンへのプロトンの能動輸送を引き起こす。その後、プロトンは電気化学的勾配に従ってATP合成酵素を通って移動し、ADPのリン酸化によってATPを合成する。最初の光化学反応からの電子は光化学系Iに到達し、光エネルギーによって高エネルギー状態へ励起され、電子受容体によって受容されてNADP+をNADPHへ還元する。光化学系IIから失われた電子は、水の酸化(酸素発生複合体によるプロトンと酸素への「分割」)によって置換される。1分子の二原子酸素を産生するためには、10個の光子が光化学系I、IIに吸収され、4個の電子が2つの光化学系を通過する必要があり、2分子のNADPHが産生される。NADPHはカルビン回路での二酸化炭素の固定に利用される。
原核生物において
[編集]
細菌や古細菌もまた、ATPの産生に化学浸透を利用する。シアノバクテリア、緑色硫黄細菌、そして紅色細菌は光リン酸化と呼ばれる過程でATPを合成する。これらの細菌は、光合成電子伝達系を用いてプロトン勾配を作り出すために光エネルギーを利用する。大腸菌のような非光合成細菌もATP合成酵素を有している。事実、ミトコンドリアと葉緑体は共生の産物であり、取り込まれた原核生物に由来するものである。この過程は細胞内共生説として記述されている。ミトコンドリアの起源によって真核生物の起源が生じ、色素体の起源によって真核生物の主要なスーパーグループの1つであるアーケプラスチダの起源が生じた。
出典
[編集]- ^ Peter Mitchell (1961). “Coupling of phosphorylation to electron and hydrogen transfer by a chemi-osmotic type of mechanism”. Nature 191 (4784): 144–148. Bibcode: 1961Natur.191..144M. doi:10.1038/191144a0. PMID 13771349.
- ^ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). “Proton Gradients Produce Most of the Cell's ATP”. Molecular Biology of the Cell. Garland. ISBN 0-8153-4072-9
- ^ The Nobel Prize in Chemistry 1978.
- ^ Cooper, Geoffrey M. (2000). “Figure 10.22: Electron transport and ATP synthesis during photosynthesis”. The Cell: A Molecular Approach (2nd ed.). Sinauer Associates, Inc.. ISBN 0-87893-119-8
- ^ Alberts, Bruce; Alexander Johnson; Julian Lewis; Martin Raff; Keith Roberts; Peter Walter (2002). “Figure 14-32: The importance of H+-driven transport in bacteria”. Molecular Biology of the Cell. Garland. ISBN 0-8153-4072-9
- ^ a b c d e f Nicholls D. G.; Ferguson S. J. (1992). Bioenergetics 2 (2nd ed.). San Diego: Academic Press. ISBN 9780125181242
- ^ a b c Stryer, Lubert (1995). Biochemistry (fourth ed.). New York - Basingstoke: W. H. Freeman and Company. ISBN 978-0716720096
- ^ Azzone, Giovanni; Benz, Roland; Bertl, Adam; Colombini, Marco; Crofts, Antony; Dilley, Richard; Dimroth, Peter; Dutton, P.Leslie et al. (1993-11). “Transmembrane measurements across bioenergetic membranes” (英語). Biochimica et Biophysica Acta (BBA) - Bioenergetics 1183 (1): 1–3. doi:10.1016/0005-2728(93)90002-W.
- ^ a b c Silverstein, Todd P. (2014-6). “An exploration of how the thermodynamic efficiency of bioenergetic membrane systems varies with c-subunit stoichiometry of F₁F₀ ATP synthases”. Journal of Bioenergetics and Biomembranes 46 (3): 229–241. doi:10.1007/s10863-014-9547-y. ISSN 1573-6881. PMID 24706236.
関連文献
[編集]- Biochemistry textbook reference, from the NCBI bookshelf – Jeremy M. Berg; John L. Tymoczko; Lubert Stryer, eds. “18.4. A Proton Gradient Powers the Synthesis of ATP”. Biochemistry (5th ed.). W. H. Freeman
- Technical reference relating one set of experiments aiming to test some tenets of the chemiosmotic theory – Seiji Ogawa & Tso Ming Lee (1984). “The Relation between the Internal Phosphorylation Potential and the Proton Motive Force in Mitochondria during ATP Synthesis and Hydrolysis”. Journal of Biological Chemistry 259 (16): 10004–10011. PMID 6469951.

![{\displaystyle \Delta \!G=zF\Delta \!\psi +RT\ln {\frac {[\mathrm {X} ^{z+}]_{\text{N}}}{[\mathrm {X} ^{z+}]_{\text{P}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e49984fb465bfe70fdf147d5c94b4691fde30b93)




![{\displaystyle [\mathrm {X} ^{z+}]_{\text{P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b04667620cf542631c6a2a692aefd89310230ddd)
![{\displaystyle [\mathrm {X} ^{z+}]_{\text{N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4da81b44fd243b0610ca90f2a571ffe2891ad71)





![{\displaystyle \Delta \!\mu _{\mathrm {H} ^{+}}=F\Delta \!\psi +RT\ln {\frac {[\mathrm {H} ^{+}]_{\text{N}}}{[\mathrm {H} ^{+}]_{\text{P}}}}=F\Delta \!\psi -(\ln 10)RT\Delta \mathrm {pH} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9401e1568170355be3a960a583f16f2d93c5a842)













![{\displaystyle [\mathrm {H} ^{+}]/[\mathrm {ATP} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e253bb9b194bd7dd88012ff9e7acd912dbf6931)