溶融塩電解
溶融塩電解(ようゆうえんでんかい、molten salt electrolysis)とは、イオン性の固体を高温にして融解させ、これを電気分解する方法である[1]。2010年代頃までは融解塩電解(ゆうかいえんでんかい)と呼ばれることもあった[2]。
イオン化傾向が大きく水溶液では析出しないアルミニウムやナトリウムなどのアルカリ金属類がこの方法で工業生産される。
アルミニウム[編集]
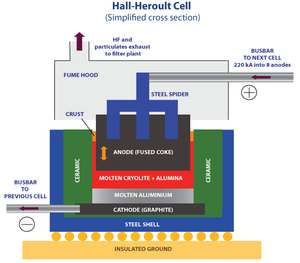
アルミニウムは世界的にホール・エルー法(Hall-Héroult process)により精錬されている[3]。氷晶石とフッ化ナトリウムを電気炉で1,010°Cで融解させ[3]、これに原料のアルミナを溶解し、黒鉛電極で電気分解を行う。分解されたアルミニウム(液体)は陰極に溜まり、酸素は陽極の黒鉛と反応して二酸化炭素となり、さらに反応して一酸化炭素となる。
このため、基本的に陰極は化学的には消耗しないのに対して [4]、陽極は化学的に消耗するため、陰極と比べて頻回の交換が必要である[4]。ただし、陰極も数千日間の長期間の使用に伴って、アルミニウムの流動に伴う磨耗などの物理的な消耗は発生し、いずれ使用不能になる[4]。
ナトリウム[編集]
ナトリウムの溶融塩電解には、カストナー法とダウンズ法がある。
カストナー法[編集]

カストナー法は、330°Cで溶融させた水酸化ナトリウムを特殊なるつぼで電気分解する方法である。分解された金属ナトリウム(液体)は水酸化ナトリウムよりも密度が低いため、るつぼ上部の採取装置 (P)に溜まる仕組みである。
- (陰極)
- (陽極)
陽極では高温にもかかわらず水が発生し反応効率が低下する。水は金属ナトリウムと反応を起こし、水素が生成する。
生成した水素は採取装置 (P)に溜まり、これも反応効率を低下させる。
カストナー法は現在ほとんど使われず、ダウンズ法が主流となっている[5]。
ダウンズ法[編集]

ダウンズ法は溶融させた塩化ナトリウムをダウンズセル(Downs cell)と呼ばれる特殊な装置で電気分解する方法である[6][7]。
- (陽極)
- (陰極)
- (全体)
金属ナトリウムは塩化ナトリウムよりも密度が低いため、鉄電極(陰極)上の採取部分に浮かび上がってくる仕組みである。
出典[編集]
- ^ “融解塩電解”. 学研キッズネット. 2012年4月2日閲覧。
- ^ 高等学校化学で用いる用語に関する提案(1)への反応(日本化学会、2018年1月25日更新版)
- ^ a b “アルミ・銅事業 やさしい技術”. 神戸製鋼グループ. 2012年4月2日閲覧。
- ^ a b c 土橋倫男, 「アルミニウムの製錬と精製」『軽金属』 軽金属学会, 1994年 44巻 7号 p.406-417, doi:10.2464/jilm.44.406
- ^ “第1節 アルカリ金属とその化合物”. 啓林館. 2012年4月2日閲覧。
- ^ JAKES CLOYD DOWNS (1924-07-15), ELECTROLYTIC PROCESS AND CELL, Patent 1501756 2011年5月28日閲覧。
- ^ 長谷川一希, 「苛性ソーダ,金属ナトリウム製造における電解技術」『化学と教育』 66巻 11号 2018年 p.524-527, doi:10.20665/kakyoshi.66.11_524
外部リンク[編集]
- 渡邊亨, 「アルミニウムの製錬と精製」『軽金属』 39巻 5号 1989年 p.403-414, doi:10.2464/jilm.39.403







