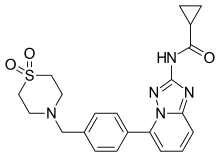
フィルゴチニブ
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | ジセレカ, Jyseleca |
| ライセンス | EMA:リンク |
| 胎児危険度分類 |
|
| 法的規制 | |
| 薬物動態データ | |
| 半減期 | 6 hours[3] |
| データベースID | |
| CAS番号 |
1206161-97-8 |
| ATCコード | L04AA45 (WHO) |
| PubChem | CID: 49831257 |
| IUPHAR/BPS | 7913 |
| DrugBank |
DB14845 |
| ChemSpider |
28189566 |
| UNII |
3XVL385Q0M |
| KEGG |
D10871 |
| ChEMBL |
CHEMBL3301607 |
| PDB ligand ID | 2HB (PDBe, RCSB PDB) |
| 別名 | GLPG0634, GS-6034[4] |
| 化学的データ | |
| 化学式 | C21H23N5O3S |
| 分子量 | 425.51 g·mol−1 |
| |
フィルゴチニブ(Filgotinib)は関節リウマチ(RA)の治療に使用されるヤヌスキナーゼ(JAK)阻害薬・分子標的治療薬。 ベルギー・オランダのバイオテクノロジー企業GalapagosNVによって開発された[5]。
最も一般的な副作用には、吐き気(気分が悪くなる)、上気道感染症(鼻と喉の感染症)、尿路感染症、めまいなど。
フィルゴチニブは、2020年9月に欧州連合(EU)と日本の両方で医療用医薬品として承認された。製品名はジセレカ(Jyseleca)[6] [7]。
医療用途
[編集]フィルゴチニブは、1つまたは複数の疾患修飾性抗リウマチ薬(DMARD)で効果が不十分、または不耐性の成人における中等度から重度の活動性関節リウマチの治療に適応される。 フィルゴチニブは、単剤療法として、またはメトトレキサート(MTX)と組み合わせて使用できる。
作用機序
[編集]フィルゴチニブは、ヤヌスキナーゼのサブタイプJAK1に対して選択性を持つヤヌスキナーゼ阻害剤。すでに市販されているウパダシチニブと同様に、JAK1を選択的に阻害するため、有望な薬剤と考えられている[要出典医学]。選択性の低いJAK阻害剤(トファシチニブやバリシチニブ)はすでに販売されている。
炎症性サイトカインのシグナル伝達は、JAK1に依存している。 JAK2の阻害も関節リウマチに対する有効性に寄与する可能性があるが、JAK2阻害はエリスロポエチン・トロンボポエチンおよび顆粒球マクロファージコロニー刺激因子との干渉により貧血と血小板減少症を引き起こす可能性があると考えられている。 したがって、主要な治療オプションとして、より選択的なJAK1阻害剤を選択することをお勧めする。 フィルゴチニブは、JAK2と比較してJAK1に対して30倍の選択性を示す[8]。しかしながら、JAK2阻害がどの程度回避されるべきかはまだ不明である。
時系列
[編集]- 2011年6月:最初の第II相試験の結果
- 2014年11月:DARWIN1および2トライアルの開始
- 2015年7月:DARWIN1の結果が発表
- 2015年8月:DARWIN2の結果が発表
- 2015年9月:アッヴィはガラパゴスNVとのコラボレーションをオプトアウトした[9]。
- 2015年12月:ガラパゴスNVはギリアドとパートナーシップを結び、さまざまな疾患に対してフィルゴチニブを共同開発および共同商業化した。
- 2019年12月:ギレアドは、フィルゴチニブの優先審査を含む新薬承認申請(NDA)を米国食品医薬品局(FDA)に提出した[10]。
- 2020年7月23日、欧州医薬品庁(EMA)のヒト用医薬品委員会(CHMP)は肯定的な意見を採択し、関節リウマチの治療を目的とした医薬品ジセレカ Jyselecaの販売承認の付与を推奨した[11]。この医薬品の申請者はギリアドサイエンシズ・アイルランドUC[12] [13]。
- 2020年8月19日:FDAは、毒性の懸念を理由にフィルゴチニブの承認を求めるギリアドの申請を拒否した[14]。
- 2020年9月:フィルゴチニブは、欧州連合と日本の両方で医療用として承認された[15] [16]。
研究
[編集]臨床試験
[編集]フィルゴチニブの有効性は、886人の関節リウマチ患者と180人のクローン病患者が関与する第IIb相プログラム(DARWIN試験1、2)で研究されている[要出典]。
フェーズI試験
[編集]フェーズIの研究では、フィルゴチニブ代謝の薬物動態が肝臓のCYP450酵素分解とは無関係であることが示された。しかし、薬物代謝はカルボキシルエステラーゼによって媒介される。メトトレキサートの代謝や調査された輸送タンパク質のいずれにも干渉は報告されていない[17]。
フェーズII研究:概念実証(2011)
[編集]2011年11月、ガラパゴスNVは、メトトレキサート治療に対して不十分な効果を示した36人の関節リウマチ患者を治療した第II相試験(同定:NCT01384422、Eudract:2010-022953-40)の結果を発表した[18][要文献特定詳細情報]。12人の患者の3つのグループが以下のいずれかで治療された。(フィルゴチニブ200mg単回投与、200mgを2回に分けて投与、プラセボ)主要エンドポイントは、患者のACR20スコアだった。予定された4週間の治療後、回答者の83%がACR20スコアの改善を示した。治療を受けた患者の半数は、疾患の完全な(またはほぼ完全な)寛解を示した。貧血や血中脂質の変化の報告は無かった。同社はプレスリリースで、フィルゴチニブは臨床効果を示す最初の選択的JAK1阻害剤であると述べている。この研究の結果、同社は「GLPG0634は関節リウマチ治療でこれまでに報告された中で最も高い初期奏効率の1つを示している」と述べた[19]。
DARWIN1試験
[編集]DARWIN 1試験は、599人の関節リウマチ患者が登録された24週間の二重盲検プラセボ対照試験だった。すべての参加者は中等度から重度の関節リウマチを患っており、標準的なメトトレキサート治療に対して不十分な反応を示した。この試験では、フィルゴチニブの3つの投与量を1日1回または2回のレジメンとして比較した[20][要文献特定詳細情報]。試験中、すべての参加者はメトトレキサート治療を続けた。試験は2015年2月に完了し、結果は2015年7月に発表された[21] [22]。ガラパゴスNVは、この薬が主要な有効性エンドポイントを満たし、最大39%のACR70応答を示し、安全性プロファイルを維持していることを発表した[23]。
ダーウィン2試験
[編集]DARWIN 2試験は、標準的なメトトレキサート治療に対して不十分な反応を示す280人の関節リウマチ患者を対象とした二重盲検プラセボ対照試験だった。以前のDARWIN1試験とは対照的に、メトトレキサートは中止された。したがって、この試験では、セカンドラインの単剤療法としてフィルゴチニブを調査する[24]。 DARWINトライアル2bの募集は2014年11月に終了した[25]。2015年8月、ガラパゴスNVは、調査により以前の結果が確認されたと発表した[26]。
DARWIN3試験
[編集]DARWIN1および2を完了した患者はDARWIN3の資格があった。2017年11月、同社は試験の84週目に一貫した安全性の発見と永続的な活動を発表した[27]。推定研究完了期間は2019年5月[28][要文献特定詳細情報]。
FINCHフェーズIII試験
[編集]FINCH 1は、メトトレキサート(MTX)による一次治療が機能していない患者を対象としている。フィルゴチニブとアダリムマブ/ヒュミラとプラセボを比較する[29]。FINCH 2は、生物学的製剤が機能していない患者を調べる。FINCH 3は、二次治療として薬剤を調査した以前の研究とは異なり、一次治療としてフィルゴチニブを検討している。
FINCH 2試験では、1つまたは複数のDMARDに対して不十分な反応または不耐性を示した活動性関節リウマチの患者が明らかになり、フィルゴチニブはプラセボと比較して治療反応に有意性を示した[30]。
MANTA研究
[編集]男性の精巣毒性に対する懸念から、MANTA研究では、潰瘍性大腸炎の治療との関連で薬剤の安全性を調べている[31][要文献特定詳細情報]。これらの懸念にもかかわらず、FDAは第III相FINCH試験で男性に200mgの1日量を許可した[32]。
SELECTION試験
[編集]中等症~重症の活動期潰瘍性大腸炎患者の治療において、フィルゴチニブは、忍容性が良好で寛解導入および寛解維持における臨床的寛解の達成割合が高いことが示された[33]。
参考文献
[編集]- ^ “Jyseleca EPAR”. European Medicines Agency (EMA) (26 May 2020). 4 October 2020閲覧。 Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ “Jyseleca 100 mg film-coated tablets - Summary of Product Characteristics (SmPC)”. (emc) (1 October 2020). 4 October 2020閲覧。
- ^ “Pharmacokinetics and Pharmacokinetic/Pharmacodynamic Modeling of Filgotinib (GLPG0634), a Selective JAK1 Inhibitor, in Support of Phase IIB Dose Selection”. Clinical Pharmacokinetics 54 (8): 859–74. (August 2015). doi:10.1007/s40262-015-0240-z. PMC 4513223. PMID 25681059.
- ^ “Pipeline”. Gilead Sciences (27 July 2020). 27 July 2020閲覧。
- ^ "European Commission Grants Marketing Authorization for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Active Rheumatoid Arthritis" (Press release). Gilead Sciences. 25 September 2020. 2020年10月4日閲覧。
- ^ "European Commission Grants Marketing Authorization for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Active Rheumatoid Arthritis" (Press release). Gilead Sciences. 25 September 2020. 2020年10月4日閲覧。"European Commission Grants Marketing Authorization for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Active Rheumatoid Arthritis" (Press release).
- ^ “Jyseleca (Filgotinib) Approved in Japan for Rheumatoid Arthritis”. Gilead Sciences (25 September 2020). 4 October 2020閲覧。
- ^ “Preclinical characterization of GLPG0634, a selective inhibitor of JAK1, for the treatment of inflammatory diseases”. Journal of Immunology 191 (7): 3568–77. (October 2013). doi:10.4049/jimmunol.1201348. PMID 24006460.
- ^ “AbbVie to Advance Once-Daily ABT-494 to Phase 3 in Rheumatoid Arthritis by Year-End | AbbVie News Center”. news.abbvie.com. 23 May 2021閲覧。
- ^ "Gilead Submits Filgotinib New Drug Application to U.S. Food and Drug Administration Under Priority Review for Rheumatoid Arthritis Treatment" (Press release). 19 December 2019. 2020年7月27日閲覧。
- ^ “Jyseleca: Pending EC decision”. European Medicines Agency (EMA) (23 July 2020). 27 July 2020閲覧。
- ^ "Gilead and Galapagos Announce Positive European CHMP Opinion for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Rheumatoid Arthritis" (Press release). 24 July 2020. 2020年7月27日閲覧。
- ^ "Gilead and Galapagos Announce Positive European CHMP Opinion for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Rheumatoid Arthritis" (Press release). 24 June 2020. 2020年7月27日閲覧。
- ^ “FDA rejects Gilead's would-be blockbuster filgotinib over toxicity concerns” (19 Aug 2020). 23 May 2021閲覧。
- ^ "European Commission Grants Marketing Authorization for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Active Rheumatoid Arthritis" (Press release). Gilead Sciences. 25 September 2020. 2020年10月4日閲覧。"European Commission Grants Marketing Authorization for Jyseleca (Filgotinib) for the Treatment of Adults With Moderate to Severe Active Rheumatoid Arthritis" (Press release).
- ^ “Jyseleca (Filgotinib) Approved in Japan for Rheumatoid Arthritis”. Gilead Sciences (25 September 2020). 4 October 2020閲覧。"Jyseleca (Filgotinib) Approved in Japan for Rheumatoid Arthritis".
- ^ "Phase 1 and Phase 2 Data Confirm That GLPG0634, a Selective JAK1 Inhibitor, Has a Low Potential for Drug-Drug Interactions". Meeting Abstracts. 2014 ACR/ARHP Annual Meeting. American College of Rheumatology. 2014. 1481。
- ^ 臨床試験番号 NCT01384422 研究名 "Safety and Preliminary Efficacy of GLPG0634 in Methotrexate-refractory Active Rheumatoid Arthritis" - ClinicalTrials.gov
- ^ "Galapagos' GLPG0634 shows excellent efficacy and safety in rheumatoid arthritis Phase II study" (PDF) (Press release). 2015年2月26日閲覧。
- ^ 臨床試験番号 NCT01888874 研究名 "Dose-finding Study of GLPG0634 as add-on to Methotrexate in Active Rheumatoid Arthritis Patients (DARWIN1)" - ClinicalTrials.gov
- ^ "Galapagos reports that the last patient in DARWIN 1 has completed 12 weeks of treatment" (PDF) (Press release). 2015年2月26日閲覧。
- ^ "Galapagos' selective JAK1 inhibitor filgotinib meets key efficacy endpoints, shows ACR70 responses up to 39%, and maintains safety profile after 24 weeks of treatment in DARWIN 1 Phase 2B study" (Press release). Galapagos NV. 29 July 2015.
- ^ “Filgotinib (GLPG0634/GS-6034), an oral JAK1 selective inhibitor, is effective in combination with methotrexate (MTX) in patients with active rheumatoid arthritis and insufficient response to MTX: results from a randomised, dose-finding study (DARWIN 1)”. Annals of the Rheumatic Diseases 76 (6): 998–1008. (June 2017). doi:10.1136/annrheumdis-2016-210104. PMID 27993829.
- ^ "Galapagos completes recruitment for Darwin 1 study with GLPG0634 (filgotinib) in RA" (Press release). Galapagos NV. 2015年2月26日閲覧。
- ^ "Galapagos completes recruitment for Darwin 2 monotherapy study with GLPG0634 (filgotinib) in RA" (Press release). Galapagos NV. 2015年2月26日閲覧。
- ^ "DARWIN 2 24-week monotherapy data in RA confirm previous results and support best-in-class potential for filgotinib" (Press release). Galapagos NV. 10 August 2015.
- ^ "Consistent safety findings and durable activity with filgotinib treatment of rheumatoid arthritis patients up to week 84 in DARWIN 3 study" (Press release). Galapagos NV. 5 November 2017.
- ^ 臨床試験番号 NCT02065700 研究名 "Long-term Follow-up Study of GLPG0634 in Active Rheumatoid Arthritis Patients" - ClinicalTrials.gov
- ^ “Filgotinib program in RA - Galapagos Annual Report 2016”. Galapagos. 2018年1月8日閲覧。
- ^ “Effect of Filgotinib vs Placebo on Clinical Response in Patients With Moderate to Severe Rheumatoid Arthritis Refractory to Disease-Modifying Antirheumatic Drug Therapy: The FINCH 2 Randomized Clinical Trial”. JAMA 322 (4): 315–325. (July 2019). doi:10.1001/jama.2019.9055. PMC 6652745. PMID 31334793.
- ^ 臨床試験番号 NCT03201445 研究名 "Study to Evaluate the Testicular Safety of Filgotinib in Adult Males With Moderately to Severely Active Ulcerative Colitis" - ClinicalTrials.gov
- ^ “Galapagos, Gilead include high dose in PhIII RA trial after talk with FDA”. FierceBiotech. 2018年1月8日閲覧。
- ^ Feagan BG, and others. Filgotinib as induction and maintenance therapy for ulcerative colitis (SELECTION): a phase 2b/3 double-blind, randomised, placebo-controlled trial. Lancet 2021;397(10292);2372-2384. pii: S0140-6736(21)00666-8.
外部リンク
[編集]- “Filgotinib”. Drug Information Portal. U.S. National Library of Medicine. 2021年5月23日閲覧。
- 臨床試験番号 NCT02889796 研究名 "Filgotinib in Combination With Methotrexate in Adults With Moderately to Severely Active Rheumatoid Arthritis Who Have an Inadequate Response to Methotrexate (FINCH 1)" - ClinicalTrials.gov
- 臨床試験番号 NCT02873936 研究名 "Filgotinib Versus Placebo in Adults With Active Rheumatoid Arthritis (RA) Who Have an Inadequate Response to Biologic Disease-modifying Anti-rheumatic Drug(s) (DMARDs) Treatment (FINCH 2)" - ClinicalTrials.gov
- 臨床試験番号 NCT02886728 研究名 "Filgotinib Alone and in Combination With Methotrexate (MTX) in Adults With Moderately to Severely Active Rheumatoid Arthritis Who Are Naive to MTX Therapy (FINCH 3)" - ClinicalTrials.gov
- 臨床試験番号 NCT02914522 研究名 "Filgotinib in the Induction and Maintenance of Remission in Adults With Moderately to Severely Active Ulcerative Colitis (SELECTION1)" - ClinicalTrials.gov
- 臨床試験番号 NCT02914561 研究名 "Filgotinib in the Induction and Maintenance of Remission in Adults With Moderately to Severely Active Crohn's Disease (Diversity1)" - ClinicalTrials.gov
- 臨床試験番号 NCT04115748 研究名 "Study to Evaluate the Efficacy and Safety of Filgotinib in Participants With Active Psoriatic Arthritis Who Are Naive to Biologic DMARD Therapy (PENGUIN 1)" - ClinicalTrials.gov
- 臨床試験番号 NCT04115839 研究名 "Study to Evaluate the Efficacy and Safety of Filgotinib in Participants With Active Psoriatic Arthritis Who Have an Inadequate Response or Are Intolerant to Biologic DMARD Therapy (PENGUIN 2)" - ClinicalTrials.gov
