テトラチアフルバレン
| Tetrathiafulvalene | |
|---|---|
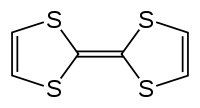
| |
別称 1,3-Dithiole, 2-(1,3-dithiol-2-ylidene)- Δ2,2-bi-1,3-dithiole | |
| 識別情報 | |
| CAS登録番号 | 31366-25-3 |
| 特性 | |
| 化学式 | C6H4S4 |
| モル質量 | 204.36 g/mol |
| 外観 | 黄色結晶 |
| 融点 |
116-119 °C |
| 構造 | |
| 双極子モーメント | 0 D |
| 危険性 | |
| 主な危険性 | 可燃性 |
| Rフレーズ | 43 |
| Sフレーズ | 36/37 |
| 関連する物質 | |
| 関連物質 | TCNQ、チオフェン |
| 出典 | |
| NIST | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
テトラチアフルバレン (Tetrathiafulvalene, TTF) は、(H2C2S2C)2で表される有機硫黄化合物である。この複素環式化合物の研究により分子エレクトロニクスの発展につながった。テトラチアフルバレンはフルバレン (C5H4)2 の誘導体であり、4つのCH基を硫黄原子で置き換えた構造をしている。このTTFとその誘導体に関して1万を超える科学論文が出ている[1]。
合成
[編集]TTFの興味深いところに、この化合物には多くの合成法がある[1]。一般的には1,3-dithiole-2-thiones や 1,3-dithiole-2-ones 誘導体のような環状C3S2のビルディングブロックをカップリングさせることで得られる。TTFは、トリチオカーボネート H2C2S2CS とS-CH3の合成で H2C2S2CH(SCH3)の中間体を経て、その後は以下のように合成される[2]。
酸化還元特性
[編集]通常状態のTTFには特徴的な電気特性は存在しない。しかしTTF+塩のような酸化体になった時には特徴的な電気伝導の性質を持つ。TTF塩の高い電気伝導度は、次のような特徴による (i) π-πスタックによる平面性、 (ii) 電荷の非局在化を大きくさせる対称性、 (iii)穏和な電位により安定なラジカルカチオンになる。
電気化学測定では、TTFは下記の2つの可逆の酸化が起こる。
TTFのジチオールイリデン環は、それぞれの硫黄原子が2つ、sp2炭素原子に1つの電子を持っている7π電子系となる。そのため各環の酸化により6π電子の芳香族性となる。結果、中央の二重結合が単結合となることで全てのπ電子で環の軌道を占めるようになる。
歴史
[編集]Wudlらにより [TTF+]Cl-塩が半導体となることが初めて発見され[3]、Ferrarisらによって電荷移動錯体の[TTF]TCNQが非常に高い導電性を示すことが示された。[4]。 この高い導電性は金属伝導であることが赤外反射の測定[5]や熱起電力の測定[6]から判明している。[TTF][TCNQ]のX線回折によって、陰イオンTTF分子のスタックが陽イオンTCNQ分子のスタックと隣接しているだけであることが明らかとなった。これは分離積層型と呼ばれ、高い電気伝導と異方的(1次元的な)電気伝導という独特の電気特性を示すことになる。これらの発見以降、数多くのTTFの類似体が合成され、さまざまな金属性有機物や超伝導体が得られている。[7]良く知られた類似体に、テトラメチルテトラチアフルバレン (Me4TTF)、テトラメチルセレナチアフルバレン (TMTSFs)、ビス(エチレンジチオ)テトラチアフルバレン (BEDT-TTF, CAS [66946-48-3])などがある[8]。多くのTTF類縁体は擬1次元や擬2次元的なバンド構造をもち、低次元における電気伝導の研究とも関係が深い。[9]
脚注
[編集]- ^ a b Bendikov, M; Wudl, F; Perepichka, D. F. (2004). “Tetrathiafulvalenes, Oligoacenenes, and Their Buckminsterfullerene Derivatives: The Brick and Mortar of Organic Electronics”. Chemical Reviews 104: 4891–4945. doi:10.1021/cr030666m.
- ^ Wudl, F.; Kaplan, M. L. (1979). “2,2'Bi-1,3-dithiolylidene (Tetrathiafulvalene, TTF) and Its Radical Cation Derivatives”. Inorg. Synth. 19: 27–30. doi:10.1002/9780470132500.ch7.
- ^ Wudl, F.; Wobschall, D.; Hufnagel, E. J. (1972). “Electrical Conductivity by the Bis(1,3-dithiole)-bis(1,3-dithiolium) System”. J. Am. Chem. Soc. 94: 670–672. doi:10.1021/ja00757a079.
- ^ Ferraris, J.; Cowan, D. O.; Walatka, V. V., Jr.; Perlstein, J. H. (1973). “Electron transfer in a new highly conducting donor-acceptor complex”. J. Am. Chem. Soc. 95: 948. doi:10.1021/ja00784a066.
- ^ C. S. Jacobsen, D. B. Tanner, A. F. Garito, and A. J. Heeger (1974). “Single-Crystal Reflectance Studies of Tetrathiafulvalene Tetracyanoquinodimethane”. Phys. Rev. Lett. 33: 1559. doi:10.1103/PhysRevLett.33.1559.
- ^ P. M. Chaikin, J. F. Kwak, T. E. Jones, A. F. Garito, and A. J. Heeger (1973). “Thermoelectric Power of Tetrathiofulvalinium Tetracyanoquinodimethane”. Phys. Rev. Lett. 31: 601. doi:10.1103/PhysRevLett.31.601.
- ^ 斎藤軍治『有機導電体の化学』丸善、2003年。ISBN 9784621072615。
- ^ Larsen, J.; Lenoir, C. (1998). "2,2'-Bi-5,6-Dihydro-1,3-Dithiolo[4,5-b][1,4]dithiinylidene (BEDT-TTF)". Organic Syntheses (英語).; Collective Volume, vol. 9, p. 72
- ^ 鹿児島誠一『低次元導体』裳華房、2000年。ISBN 9784785326104。
外部リンク
[編集]- Rovira, C. (2004). “Bis(ethylenethio)tetrathiafulvalene (BET-TTF) and Related Dissymmetrical Electron Donors: From the Molecule to Functional Molecular Materials and Devices (OFETs)”. Chemical Reviews 104: 5289–5317. doi:10.1021/cr030663.
- Iyoda, M; Hasegawa, M; Miyake, Y (2004). “Bi-TTF, Bis-TTF, and Related TTF Oligomers”. Chemical Reviews 104: 5085–5113. doi:10.1021/cr030651o.
- Frere, P.; Skabara, P. J. (2005). “Salts of Extended Tetrathiafulvalene analogues: relationships Between Molecular Structure, Electrochemical Properties and Solid State Organization”. Chemical Society Reviews 34: 69–98. doi:10.1039/b316392j.
- Gorgues, Alain; Hudhomme, Pietrick; Salle, Marc. (2004). “Highly Functionalized Tetrathiafulvalenes: Riding along the Synthetic Trail from Electrophilic Alkynes”. Chemical Reviews 104: 5151–5184. doi:10.1021/cr0306485.

![{\displaystyle {\ce {H2C2S2CH(SCH3)\ + HBF4 ->\ [H2C2S2CH^+]BF4^-\ + HSCH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1dedc424199a88b293c9433ee589cb0bd5d7a5b)
![{\displaystyle {\ce {2[H2C2S2CH+]BF4^-\ + 2 Et3N -> (H2C2S2C)2\ + 2Et3NHBF4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c056cce7134eed832d4458db973d38e500779118)



