ブルーストリパノソーマ
| ブルーストリパノソーマ Trypanosoma brucei | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
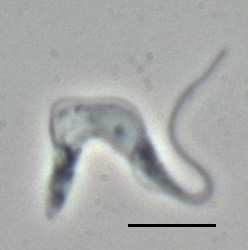 ブルーストリパノソーマ
| ||||||||||||||||||||||||
| 分類 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| 学名 | ||||||||||||||||||||||||
| Trypanosoma brucei Plimmer et Bradford, 1899 | ||||||||||||||||||||||||
| 和名 | ||||||||||||||||||||||||
| ブルーストリパノソーマ |
ブルーストリパノソーマ(Trypanosoma brucei)はトリパノソーマ属に属する寄生性原虫の1種。ツェツェバエによって媒介される住血性の鞭毛虫であり、ヒトの睡眠病、動物のアフリカトリパノソーマ症などの原因となる。
形態
[編集]形態的には錐鞭毛型と上鞭毛型に大別でき、このうち錐鞭毛型は血流型(スレンダー型とスタンピー型)・プロサイクリック型・メタサイクリック型に分類される。前鞭毛型や無鞭毛型は基本的に生じない。
生活環
[編集]
- 感染しているツェツェバエが哺乳類から吸血する際に、メタサイクリック型の原虫が皮膚に注入される。
- 原虫は宿主体内で血流型へ変態し、リンパ系から血流へと流れ込み体中へ運ばれる。
- 常に細胞外(血液・リンパ液・髄液などの体液中)で二分裂により増殖する。
- 血流型原虫
- ツェツェバエは、吸血する際に血液中の血流型原虫を取り込むことにより感染する。
- ツェツェバエの中腸でプロサイクリック型へと変態し、二分裂により増殖する。
- 中腸から脱出すると上鞭毛型へと変態し、
- 唾液腺に到達して増殖を続け、一部がメタサイクリック型へと変態する。
ツェツェバエでの発育には3週間ほどを要する。
ゲノム
[編集]ブルーストリパノソーマの細胞核ゲノムは1メガ塩基対以上の大きな染色体が11対と、それに満たない(50-500キロ塩基対)100種ほどの小さな染色体群からなっている。この小さな染色体群には主に抗原多型に関与する遺伝子が存在している。
ミトコンドリアには通常のゲノム(マキシサークル)の他に多数のミニサークルが存在している。マキシサークルDNA上のおよそ半数の遺伝子はそのままでは意味を成さず、転写後に膨大な量のRNA編集を経て初めて翻訳可能になるのだが、ミニサークルDNA上にこのRNA編集に必要なガイドRNAがコードされている。
細胞骨格
[編集]
細胞表層にはペリクル下微小管が細胞の前後軸方向に走っている。極性は細胞前方が-端、後ろが+端である。これらはほぼ均等間隔になっており、細胞の成長に伴って既存の微小管2本の間に新しい微小管が配置される。
鞭毛は一般的な9+2構造の軸糸とそれに沿った副鞭毛桿 (paraflagellar rod; paraxial rod) から成る。鞭毛は原虫の運動に用いられるほか、プロサイクリック型がツェツェバエ中腸に接着するのにも使われる。
細胞表面
[編集]細胞表面は血流型では変異性表面糖タンパク質 (variable surface glycoprotein; VSG) 、プロサイクリック型では procyclin という糖タンパク質によって密に包まれている。
VSGはブルーストリパノソーマが宿主の免疫系から継続的に逃れ続けて慢性的な感染を維持するのに中心的な役割を果たしている [1]。 VSGは原虫表面を完全に覆っており、免疫系はVSG以外の構成要素(チャネル・トランスポーター・レセプターなど)を認識することができない[2]。そのうえVSGは数千種の遺伝子の中から周期的に1つだけが選択されるので、免疫系が特定のVSGに対する免疫を獲得してもVSGが変化することで無効化されてしまう。
抗原多型
[編集]
ブルーストリパノソーマのゲノム解読により、数千種におよぶ巨大なVSG遺伝子プールの存在が明らかになった。これらのうち1度に1種類だけが発現しており、残りは全てサイレントである。VSGは抗原性が高いため、免疫系はこの特定のVSGに対する免疫応答を獲得して原虫を排除することができる。しかし原虫は細胞分裂の際に1%ほどの確率で発現するVSG遺伝子を変化させる[3]。
免疫系が新しいVSGを認識できるようになるためには数日を要するので、この間に原虫は増殖する。この原虫はその後免疫系によって排除されるが、その頃には次のVSG遺伝子にスイッチした原虫が出現することを繰り返す。こうして全ての原虫を排除することができずに慢性的な感染が継続することになる。[1]
VSG遺伝子の塩基配列は変異が非常に大きいが、防御能を発揮するためのタンパク質構造はよく保存されている。C末端100残基ほどは4つのαヘリックスが束になる構造をとり、ここは配列上もよく保存されている。そのC末端ドメインの周りを300から350残基からなるN末端ドメインが取り巻いている。N末端ドメインは配列上は変異が大きいものの、三次構造はよく保存されていて細胞表面を物理的に隠蔽できるようになっている。VSGはホモ二量体をつくり、GPIアンカーによって細胞膜に結合している。
ブルーストリパノソーマのゲノム中には多数のVSG遺伝子があるが、そのうち5%ほどがそのまま発現可能な完全長遺伝子で、それ以外は直接には発現できない偽遺伝子となっている。これら偽遺伝子は、相同組み換えによってモザイクを生じることにより利用可能になる。[4] これにより原虫は無限のVSG遺伝子群を持つことになり、それゆえワクチン開発が困難になっている。[5]
発現しているVSG遺伝子は常に染色体末端(テロメア)の発現領域に存在している。発現領域にあるVSG遺伝子は、多数の発現領域関連遺伝子群(Expression Site-Associated Genes; ESAGs)と共にポリシストロニックな転写・翻訳が行われている。ただ発現領域は20箇所ほどあるが、実際にはそのうち1箇所だけしか同時に発現されない。これはいくつかのメカニズムの組み合わせで実現されているようであるが、詳しいことは未解明である。[6]。
VSG遺伝子の発現転換は、それまで発現していなかった発現領域が発現されるようになる場合と、発現している発現領域のVSG遺伝子が変化する場合とがある。VSG遺伝子の候補は、ミニクロモソームや、染色体内部の反復部位に多数存在しており、ゲノム全体の10%ほどがこうした遺伝子候補で占められている。これらのうちいずれかが組み換えによって発現領域に移動することで、新たなVSG遺伝子が生じることになる。
分類
[編集]トリパノソーマ属は、古典的には鞭毛虫綱原鞭毛虫目トリパノソーマ科、分子系統解析に基づく分類体系ではユーグレノゾア門キネトプラスト綱トリパノソーマ目トリパノソーマ科に所属する[7]。さらに発育パターンによって2群8亜属に分類されており、ブルーストリパノソーマはサリバリア類(section Salivaria, 唾棲類)Trypanozoon亜属となる。この亜属はツェツェバエの中腸および唾液腺で増殖し、発育終末型が唾液中に排出されることを特徴とするが、後に述べるように例外的な生活環を持つものもある。
ウマ、ロバ、ラクダ、イヌで致命的なbrucei、ヒトのガンビアトリパノソーマ症(慢性の睡眠病)の原因となるgambiense、ヒトのローデシアトリパノソーマ症(急性の睡眠病)の原因となるrhodesienseの3亜種が知られている。またラクダなどのスーラ病の病原体であるT. evansiと、ウマの媾疫の病原体であるT. equiperdumも生物学的にはブルーストリパノソーマの変異株ないし亜種だと考えられている。 [8]
- ブルーストリパノソーマ T. b. brucei Plimmer and Bradford, 1899 [9]
- 家畜にナガナ病を引き起こす病原体の1つ。
- ローデシアトリパノソーマ T. b. rhodesiense Stephens and Fantham, 1910
- ヒトのアフリカ睡眠病の病原体の1つ。アフリカ南部・東部(ビクトリア湖より東)に分布しており、野生動物や家畜が主な保虫宿主である。サバンナに多い Glossina morsitans グループが媒介する。
- ガンビアトリパノソーマ T. b. gambiense Dutton, 1902
- ヒトのアフリカ睡眠病の病原体の1つ。主にアフリカの中央部・西部(ヴィクトリア湖より西)に分布しており、主な保虫宿主はヒトであるがブタやその他の動物からも見出される。水辺に多いGlossina palpalisグループが媒介する。
- エバンストリパノソーマ T. evansi Balbiani, 1888
- ラクダやウマなどのスーラ病の病原体。北アフリカから東南アジアにかけてと、南アメリカに分布している。アブやコウモリなどが機械的に媒介しており、そもそもツェツェバエ体内では増殖できない。
- 媾疫トリパノソーマ T. equiperdum Doflein, 1901
- ウマの媾疫の病原体。世界中に分布している。例外的に昆虫宿主を必要とせず、交尾によって感染する。
これまでの研究 [10] [11] [8] が示唆するとおりブルーストリパノソーマとエバンストリパノソーマが同一種だとすると、この種は国際動物命名規約における「先取権の原則」により当然Trypanosoma evansiと呼ばなければならない。
なお中南米でシャーガス病を引き起こすのはクルーズトリパノソーマ(Trypanosoma cruzi)という別種であり、同じトリパノソーマ属の原虫であるが性状にかなりの差がある。
歴史
[編集]1901年、イギリス植民地の外科医Robert Michael Forde(1861-1948)がガンビアの船長の血液から「虫」を発見し、それを数ヶ月後に内科医Joseph Everett Dutton (1874-1905) がTrypanosoma属の原虫と同定してTrypanosoma gambienseと命名した。1902年、イタリアの病理学者アルド・カステラーニ (1878-1971)がアフリカ睡眠病の患者の髄液からトリパノソーマを見出し、これが病原体であると考えた。
すでに1895年にはスコットランドの病理学者デヴィッド・ブルース (David Bruce, 1855-1931) がトリパノソーマをウシのナガナ病の病原体として発見していたが、彼は1903年にトリパノソーマがツェツェバエによって媒介されるという証拠を得る。1910年にはアフリカ睡眠病の2番目の病原体としてT. rhodesienseが発見される。
学名は、ブルースがイギリスに送った感染したイヌを調査したPlimmerとBradfordにより、ブルースへの献名として命名された(この時はT. bruciiと命名したが、この種小名は綴りが間違っており、現在ではT. bruceiと綴る)。
進化
[編集]トリパノソーマ属のうちブルーストリパノソーマの属する唾棲類の分岐はおよそ3億年前に遡ると推定されるが、媒介者であるツェツェバエの出現が3500万年前であるので、この時期に現在のものに近い原虫が現れたと考えられる。以来野生動物の寄生虫として長い時間をかけて適応しており、そのため野生動物に対してはほとんどの場合特に病原性を示さない。一方家畜がツェツェバエ生息地域に導入されたのは1万年ほどのごく最近のことであり、それゆえいまだ家畜に対して病原性を示すものと考えられる。また樹上性の霊長類がトリパノソーマ症にかかるのに対して、ヒトはたいていのトリパノソーマに対して耐性を獲得している。ブルーストリパノソーマの2亜種はごく限られた例外であり、おそらく比較的最近になってヒトに対して病原性を示すようになったものである。ガンビアトリパノソーマはより適応が進んでおり、一方ローデシアトリパノソーマはいまだヒトには適応していないため急性の症状を示すと考えられる。
参考文献
[編集]- ^ a b Barry JD, McCulloch R (2001). “Antigenic variation in trypanosomes: enhanced phenotypic variation in a eukaryotic parasite”. Adv Parasitol. 49: 1–70. doi:10.1016/S0065-308X(01)49037-3. PMID 11461029.
- ^ Overath P, Chaudhri M, Steverding D, Ziegelbauer K (February 1994). “Invariant surface proteins in bloodstream forms of Trypanosoma brucei”. Parasitol. Today (Regul. Ed.) 10 (2): 53–8. doi:10.1016/0169-4758(94)90393-X. PMID 15275499.
- ^ Turner CM (August 1997). “The rate of antigenic variation in fly-transmitted and syringe-passaged infections of Trypanosoma brucei”. FEMS Microbiol Lett. 153 (1): 227–31. doi:10.1111/j.1574-6968.1997.tb10486.x. PMID 9252591.
- ^ Marcello L, Barry JD (September 2007). “Analysis of the VSG gene silent archive in Trypanosoma brucei reveals that mosaic gene expression is prominent in antigenic variation and is favored by archive substructure”. Genome Res. 17 (9): 1344–52. doi:10.1101/gr.6421207. PMC 1950903. PMID 17652423.
- ^ Barbour AG, Restrepo BI (2000). “Antigenic variation in vector-borne pathogens”. Emerging Infect Dis. 6 (5): 449–57. doi:10.3201/eid0605.000502. PMC 2627965. PMID 10998374.
- ^ Pays E (November 2005). “Regulation of antigen gene expression in Trypanosoma brucei”. Trends Parasitol. 21 (11): 517–20. doi:10.1016/j.pt.2005.08.016. PMID 16126458.
- ^ Moreira, D., López-García, P., and Vickerman, K. (2004). “An updated view of kinetoplastid phylogeny using environmental sequences and a closer outgroup: proposal for a new classification of the class Kinetoplastea”. Int. J. Syst. Evol. Microbiol. 54 (5): 1861-1875. doi:10.1099/ijs.0.63081-0.
- ^ a b Lai et al. (2008). “Adaptations of Trypanosoma brucei to gradual loss of kinetoplast DNA: Trypanosoma equiperdum and Trypanosoma evansi are petite mutants of T. brucei”. PNAS 105 (6): 1999-2004. doi:10.1073/pnas.0711799105.
- ^ Plimmer, H.G. & Bradford, J.R. (1899). “A Preliminary Note on the Morphology and Distribution of the Organism found in the Tsetse Fly Disease”. Proc. R. Soc. Lond. 65: 274-281. doi:10.1098/rspl.1899.0032.
- ^ Claes et al. (2005). “Trypanosoma equiperdum: master of disguise or historical mistake?”. Trends. Parasitol. 21 (7): 316-321. doi:10.1016/j.pt.2005.05.010.
- ^ Gibson, W. (2007). “Resolution of the species problem in African trypanosomes”. Int. J. Parasitol. 37 (8-9): 829-838. doi:10.1016/j.ijpara.2007.03.002.
