アスペルギロペプシンII
表示
(アスパルギロペプシンIIから転送)
| アスペルギロペプシンII | |||||||||
|---|---|---|---|---|---|---|---|---|---|
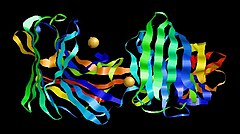 Aspergilloglutamic peptidase dimer | |||||||||
| 識別子 | |||||||||
| EC番号 | 3.4.23.19 | ||||||||
| CAS登録番号 | 9025-49-4 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
アスペルギロペプシンII(Aspergillopepsin II, EC 3.4.23.19)は、タンパク質分解酵素である[1][2]。以前はアスパラギン酸プロテアーゼと考えられていたが、後に活性部位にあるグルタミン酸残基を持つグルタミン酸プロテアーゼであることが明らかとなった[3]。
軽鎖と重鎖が非共有結合で繋がったユニークな二鎖構造を持つ。ある分子の軽鎖のC末端領域が、基質と同じような形で別の分子の活性部位の溝と結合する[4]。
この酵素は、Aspergillus niger var. macrosporusから単離される。
出典
[編集]- ^ Chang, W.J.; Horiuchi, S.; Takahashi, K.; Yamasaki, M.; Yamada, Y. (1976). “The structure and function of acid proteases. VI. Effects of acid protease-specific inhibitors on the acid proteases from Aspergillus niger var. macrosporus”. J. Biochem. 80: 975–981. PMID 12156.
- ^ Iio, K.; Yamasaki, M. (1976). “Specificity of acid proteinase A from Aspergillus niger var. macrosporus towards B-chain of performic acid oxidized bovine insulin”. Biochim. Biophys. Acta 429: 912–924. doi:10.1016/0005-2744(76)90336-3. PMID 1268233.
- ^ Takahashi K (2013). “Structure and function studies on enzymes with a catalytic carboxyl group(s): from ribonuclease T1 to carboxyl peptidases”. Proc Jpn Acad Ser B Phys Biol Sci 89 (6): 201–25. doi:10.2183/pjab.89.201. PMC 3749792. PMID 23759941.
- ^ Sasaki H, Kubota K, Lee WC, Ohtsuka J, Kojima M, Iwata S, Nakagawa A, Takahashi K, Tanokura M (2012). “The crystal structure of an intermediate dimer of aspergilloglutamic peptidase that mimics the enzyme-activation product complex produced upon autoproteolysis”. Journal of Biochemistry 152 (1): 45–52. doi:10.1093/jb/mvs050. PMID 22569035.
外部リンク
[編集]- Aspergillopepsin II - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
