エレドイシン
| エレドイシン | |
|---|---|
| |
| |
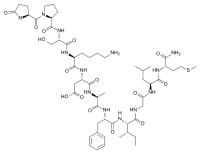
(3S)-3-[[(2S)-6-amino-2-[[(2S)-3-hydroxy-2-[[(2S)-1-[(2S)-5-oxopyrrolidine-2-carbonyl]pyrrolidine-2-carbonyl]amino]propanoyl]amino]hexanoyl]amino]-4-[[(2S)-1-[[(2S)-1-[[(2S,3S)-1-[[2-[[(2S)-1-[[(2S)-1-amino-4-methylsulfanyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-2-oxoethyl]amino]-3-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-1-oxopropan-2-yl]amino]-4-oxobutanoic acid | |
| 識別情報 | |
| PubChem | 10328936 |
| ChemSpider | 6006 |
| UNII | OKY3285J18 |
| ChEMBL | CHEMBL373569 |
| 2086 | |
| |
| |
| 特性 | |
| 化学式 | C54H85N13O15S |
| モル質量 | 1188.40 g/mol |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
エレドイシン(Eledoisin)は、軟体動物の持つウンデカペプチドで、ニューロペプチドのタキキニンファミリーに分類される。ジャコウダコ属のEledone muschataとEledone aldovandiの後部唾液腺から最初に単離された[1]。
非哺乳類起源のタキキニンとしては、他にカッシニンやフィサレミンがある。哺乳類由来のタキキニンであるP物質、NKA、NKBは、非哺乳類由来のタキキニンと似た効果を持ち、より広く研究されている。これらのペプチドは、血管拡張、血圧上昇、血管外平滑筋の刺激等、広範で複雑な薬理的・生理的活性を持つ[2]。
エレドイシンのアミノ酸配列は、pGlu-Pro-Ser-Lys-Asp-Ala-Phe-Ile-Gly-Leu-Met-NH2である。全てのタキキニンペプチドと共通するPhe-Xxx-Gly-Leu-Met-NHというC末端配列を持つ。不変の"Phe7"残基は、恐らく受容体との結合に必要である。"Xxx"は、芳香族(フェニルアラニン、チロシン)か分枝脂肪族(バリン、イソロイシン)で、受容体の選択性に重要であると考えられている。この共通領域は「メッセージドメイン」とも呼ばれ、受容体の活性化を担うと考えられている。多様なN末端領域は「アドレスドメイン」とも呼ばれ、アミノ酸配列や長さが様々で、受容体サブタイプの特異性を決定する役割を持つと考えられている[3]。
出典
[編集]- ^ DeMarco, A.; Gatti, G. (1975). “1H- and 13C-N.M.R. spectra of eledoisin and intermediate oligopeptides”. International Journal of Peptide and Protein Research 7 (6): 437–444. doi:10.1111/j.1399-3011.1975.tb02464.x. ISSN 0367-8377. PMID 1201908.
- ^ Grace, R. Christy Rani; Chandrashekar, Indu R.; Cowsik, Sudha M. (2003-01). “Solution structure of the tachykinin peptide eledoisin”. Biophysical Journal 84 (1): 655–664. doi:10.1016/S0006-3495(03)74885-1. ISSN 0006-3495. PMC 1302646. PMID 12524318.
- ^ Schwyzer, R. (1987-08). “Membrane-assisted molecular mechanism of neurokinin receptor subtype selection”. The EMBO journal 6 (8): 2255–2259. ISSN 0261-4189. PMC 553626. PMID 2822384.
