オキソアニオン
オキソアニオン(英: oxoanion)は、酸素を含む多原子陰イオン。オキシアニオン(英: oxyanion)とも表記される。いずれも酸素を意味する接頭辞 "oxo"、"oxy"と、陰イオンを意味する"anion"の組合せである。
化学式 AxOyz-(Aはある元素を指し、Oは酸素原子を指す)で表される化合物である。多くの元素がオキソアニオンを作ることができる[1]。単純なオキソアニオンの構造式はオクテット則により予想できる。縮合されたオキソアニオンの構造は AOn として、互いに辺や頂点を共有している多面体を単位にしてまとめられる。リン酸またはポリリン酸エステルである AMP、ADP、ATP は生物学において重要である。
単量体オキソアニオン
[編集]単量体オキソアニオンの化学式 は元素Aの酸化数とその周期表での位置により定まる。第2周期元素の最大配位数は4であるが、この配位数では単量体オキソアニオンを作らない。代わりに、炭酸イオン や硝酸イオン は三角形型の平面構造であり、中心原子と酸素原子との間にπ結合をもつ。中心原子と酸素原子の大きさが近いとπ結合ができやすい。
第3周期元素のオキソアニオンは四面体型である。四面体形の SiO4 はカンラン石 [Mg,Fe]SiO4 で見つかるが、固体状態ではアニオンとカチオンが分離して存在しているわけではない。リン酸イオン PO43-、硫酸イオン SO42-、過塩素酸イオン ClO4- はさまざまな塩から見つかる。酸化数の低い元素のオキソアニオンの多くはオクテット則に従い、これにより化学式を求めることができる。たとえば、塩素原子(V)は2つの価電子を持つので、酸化物イオンから3つ電子対を受け取ることができる。イオンの電荷は+5 -3×2 = -1、よって化学式は ClO3- と求まる。VSEPR理論により予想されるこのイオンの構造は、3つの結合電子対と1つの非結合電子対をもった三角錐形構造である。同様に、塩素(III)のオキソアニオンの化学式は ClO2- と求まり、これは2つの非結合電子対と2つの結合電子対により折れ線形構造をしていると分かる。
| 酸化数 | 名称 | 化学式 | イメージ |
|---|---|---|---|
| +1 | 次亜塩素酸イオン | 
| |
| +3 | 亜塩素酸イオン | 
| |
| +5 | 塩素酸イオン | 
| |
| +7 | 過塩素酸イオン | 
|
第3周期以降の元素では配位数6が取れるようになるが、単独の八面体形オキソアニオンはあまりに高い電荷を持つため、知られていない。つまり、モリブデン(VI)は MoO66- を作ることはないが、四面体型のモリブデン酸イオン MoO42- は作ることができる。縮合されたモリブデン酸イオンからは MoO6 のユニットが見つかる。完全にプロトン化された八面体型オキソアニオンは、Sn(OH)62- や Sb(OH)6- などの化学種から見つかる。
縮合反応
[編集]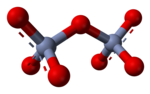
水溶液において、大きな電荷を持つオキソアニオン同士の縮合反応が起こりうる。二クロム酸イオン Cr2O72- の生成はその例で、
この反応の駆動力は水分子生成による電荷密度の減少である。エントロピーが増加するとギブズ自由エネルギーが減少し、反応が促進されるが、上の反応ではエントロピーが減少 する。これは、塩基として働く単量体オキソアニオンと、その共役酸として働く縮合されたオキソアニオンの、酸塩基反応の例である。逆反応は加水分解反応であり、塩基として働く水分子が分解される。アデノシンリン酸塩のように、アニオンが特に大きな電荷を持つときは、さらなる縮合が起こることがある。
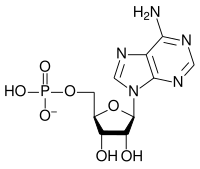
|

|
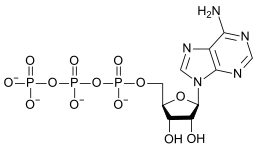
|
| AMP | ADP | ATP |
ATP と ADP の変換は加水分解反応であり、生体系の重要なエネルギー源となる。
ケイ酸塩の生成は二酸化ケイ素がLux-Floodの定義での酸として働く、酸塩基反応である。
ポリオキソアニオンの構造と化学式
[編集]

ポリオキソアニオンはオキソアニオンのポリマーで、いくつもの単量体オキソアニオンが MOn 多面体の辺と角を共有することでできる[2]。多面体の2つの角が共有されると、ポリマーの構造は鎖状か環状になる。短い鎖を持つものの例としてポリリン酸イオンが挙げられる。輝石のようなイノケイ酸塩は、SiO4 四面体の長い鎖を持っている。メタバナジン酸アンモニウム NH4VO3 のようなメタバナジン酸イオンも同じ構造を持つ。
オキソアニオンの組成式、SiO32− は次のようにして得られる。ケイ素イオン (Si4+) は4つの酸化物イオン (O2-) と結合していて、2つの Si4+ で1つの O2- を共有している。よって両原子の量的関係とその電荷は次のように求まる。
- 量的関係:
- 電荷:
環は2つの末端が結合した鎖と見なさる。環状三リン酸 P3O93- はその例である。
1つの四面体につき3つの角が他と共有されると、構造は平面的に拡張される。たとえば角閃石の内部(たとえばアスベスト)において、2つの鎖が1つおきに角を共有することにより、寄りそっている。その結果、組成式は [Si4O11]6− となる。直鎖構造はこれらの鉱物が繊維のような性質を持つことを説明できる。全ての四面体が3つの角を他と共有すると、雲母 [Si2O5]2- のような平面構造になる。つまりケイ素に結合している4つの酸素のうち、3つは他とのケイ素とも結合している。
全ての四面体につき4つの角が共有がされると、石英のように構造は3次元的になる。アルミノケイ酸塩は一部のケイ素がアルミニウムに置き換わった鉱物である。しかし、アルミニウムの酸化数はケイ素より1つ小さいので、置換には他のカチオンの追加を伴う。そのような構造の可能な組み合わせの数はとても大きい。これはアルミノケイ酸塩の種類が多いことの理由の一つである。
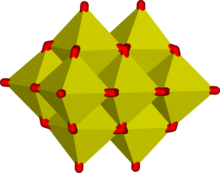
MO6 の八面体ユニットは遷移金属のオキソアニオンでよく見られる。鎖状ポリマーイオン Mo2O72- の塩など、いくつかの化合物は四面体ユニットと八面体ユニットの両方を持つ[3][4]。八面体の角だけでなく辺が共有されることがある。このとき橋渡しをしている酸素原子の歪みを減らすために、八面体は歪められることが多い。この結果ポリ酸と呼ばれる三次元構造ができあがる。典型的な例はリンモリブデン酸イオンのケギン構造である。辺の共有は電荷密度の減少に貢献する。たとえば2つの八面体の間で縮合反応が起こるとするとき、次のような反応式になる。
この反応では1つの金属原子につき電荷は2つ減っている。辺の共有の効果は、モリブデン酸イオンを含むアルカリ水溶液の酸性化で確認されている。
四面体モリブデン酸イオンは7つの角を共有するクラスターへ変わり[4][5]、モリブデンの平均電荷は6/7となる。ヘプタモリブデン酸イオンのクラスターは非常に安定であるので、2つから6つのモリブデン酸イオンクラスターは、たとえそれが中間体として生成したとしても、検出されない。
酸性度
[編集]ほとんどのオキソアニオンは弱い塩基であり、酸やその塩によりプロトン化されうる。たとえば、リン酸イオンはプロトン化されリン酸を生成する。


水溶液中でのプロトン化の度合いは酸解離定数と pH で表される。たとえば、AMP は6.21の pKa を持つ[6]。よってpH 7のとき10 %がプロトン化される。電荷はこれらのプロトン化反応で重要な因子である。対照的に、過塩素酸イオンや過マンガン酸イオンなどの一価のアニオンではプロトン化されにくく、その共役酸は強酸である。
リン酸のような酸は H3PO4 のように書かれるが、プロトンは酸素原子に結合していてヒドロキシ基を成している。よって化学式は構造を反映して OP(OH)3 のようにも書かれる。同様に硫酸は O2S(OH)2 のようにも書ける。ちなみにこれは気相中で実際に見られる分子である。
ホスホン酸イオン PO33-、は強塩基であり、常に少なくとも1つのプロトンを伴う。このケースでは、プロトンは直接リン原子に結合しているので、化学式 HPO32- は構造を反映している。このイオンが生成するとき、ホスホン酸イオンはルイス塩基として振る舞い、ルイス酸である H+ に電子対を提供する。

上で言及したとおり、縮合反応は酸塩基反応でもある。多くの系では、プロトン化と縮合反応の両方が起こりうる。クロム酸イオンの例は比較的単純なものである。クロム酸イオンの 優勢ダイアグラム において、pCr はクロムの濃度の負の対数を表す。ここで、二つの平衡が存在する。平衡定数は次のように定まる[7]。
log K1 = 5.89 log K2 = 2.05
Predominance diagram は次のように解釈される。
- クロム酸イオン CrO42- は高い pH 領域で優位な化学種である。これはpH 6.75以上の溶液でのみ存在する。
- pH < pK1 であるとき、クロム酸水素イオン HCrO4- が希釈溶液で優位になる。
- 二クロム酸イオン Cr2O72- が高濃度溶液で優位になる。ただし pH が高い場合を除く。
H2CrO4 や HCr2O7- といった化学種は非常に低いpHの下でのみ生成するので、表の外である。
バナジン酸塩、モリブデン酸塩、タングステン酸塩など場合は、ポリ酸が関わってくるので Predominance diagram は非常に複雑になる[8]。高度なポリマーになると生成速度が極端に遅くなるのも、事を複雑にしている。数か月待っても平衡状態に達さないことがあり、この場合は平衡定数や Predominance diagram が正確に求められない。
出典
[編集]- ^ グリーンウッド, ノーマン; アーンショウ, アラン (1997). Chemistry of the Elements (英語) (2nd ed.). バターワース=ハイネマン. ISBN 978-0-08-037941-8。
- ^ Mueller, U. (1993). Inorganic Structural Chemistry. Wiley. ISBN 0471937177
- ^ Lindqvist, I.; Hassel, O.; Webb, M.; Rottenberg, Max (1950). “Crystal Structure Studies on Anhydrous Sodium Molybdates and Tungstates”. Acta Chem. Scand. 4: 1066-1074. doi:10.3891/acta.chem.scand.04-1066.
- ^ a b Wells, A.F. (1962). Structural Inorganic Chemistry (3rd ed.). Oxford: Clarendon Press p446
- ^ Lindqvist, I. (1950). Arkiv Kemi 2: 325.
- ^ da Costa, C.P.; Sigel, H. (2000). “Lead(II)-Binding Properties of the 5‘-Monophosphates of Adenosine (AMP2-), Inosine (IMP2-), and Guanosine (GMP2-) in Aqueous Solution. Evidence for Nucleobase−Lead(II) Interactions”. Inorg. Chem. 39 (26): 5985-5993. doi:10.1021/ic0007207. PMID 11151499.
- ^ Brito, F.; Ascanioa, J.; Mateoa, S.; Hernándeza, C.; Araujoa, L.; Gili, P.; Martín-Zarzab, P.; Domínguez, S.; Mederos, A. (1997). “Equilibria of chromate(VI) species in acid medium and ab initio studies of these species”. Polyhedron 16 (21): 3835-3846. doi:10.1016/S0277-5387(97)00128-9.
- ^ Pope, M.T. (1983). Heteropoly and Isopoly Oxometalates. Springer. ISBN 0387118896
















![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2+}} ][\mathrm {H^{+}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba5183a196a004435f83e9cce025b6260ee6b4ed)

![{\displaystyle K_{2}={\frac {[\mathrm {Cr_{2}O_{7}^{2-}} ]}{[\mathrm {HCrO_{4}^{-}} ]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)