カウロバクター・クレセンタス
カウロバクター・クレセンタス(英:Caulobacter crescentus)は、淡水の湖や小川に広く分布しているグラム陰性の貧栄養細菌である。
この分類群は、以前はCaulobacter vibrioides (Henrici and Johnson 1935)として知られていた[1]。
解説
[編集]カウロバクターは細胞周期、非対称細胞分裂、および細胞分化の調節を研究するための重要なモデル生物である。カウロバクターの娘細胞には、2つの非常に異なる形態がある。片方の娘細胞は走化性を持ち、水泳運動を可能にするように細胞極の片方に一つのん毛を持っている、可動性のスウォーマー(遊泳)細胞である。一方、ストーカー(茎)細胞と呼ばれるもう1つの娘細胞は、一方の極から突き出た管状の軸構造を持ち、その端に粘着性の固定材料があり、ストーカー細胞が物質表面に接着できるようになっている。スウォーマー細胞は、短時間の運動性を発現した後に、ストーカー細胞へと分化する。染色体の複製と細胞分裂は、ストーカー細胞の段階でのみ発生する。クレセンタスという名称は、クレセンチンというタンパク質によって引き起こされる、その三日月形の形状に由来する。C. crescentusは、貧栄養の水生環境に生息している。低レベルの栄養素で繁栄するこの系統が持つ能力は、その二形性の発達サイクルによって促進されている。スウォーマー細胞は、単極から突き出たべん毛を持っており、ストーカー細胞に分化しない限り、DNA複製を開始することはできない。分化プロセスには、べん毛の放出と同じ極での茎の成長を特徴とする形態学的遷移が含まれます。ストーカーされた細胞は、反対の極でべん毛を成長させながら、DNAを伸長および複製し、分裂前の細胞を生じさせることができる。茎の正確な機能はまだ不明であるが、ストーカー細胞は栄養素が制限された状態での栄養素の取り込みに関与している可能性がある[2]。発生生物学者のルーシー・シャピロが最初にモデル生物として利用した[3][4]。
株
[編集]研究において、C. crescentus CB15株(淡水湖から最初に分離された株)とNA1000(主要な実験株)が主に利用される。CB15株の細胞型では、細胞分裂時にストーカー細胞と遊走細胞を実験室で物理的に分離することは困難である。しかしながら、1970年代にCB15から派生したNA1000株の樹立より、両者の分離が可能となり、さらに単離された遊走細胞を同期化された細胞培養として増殖させることも可能となった[5]。これらの細胞が細胞周期を進行する際の分子生物学的な研究により、本系統の細胞周期の調節の詳細な解析が進められてきた。この性質により、NA1000株は主要な実験株として世界中で利用されている。また、NA1000株が受けた実験室環境での選択圧によって、2つの株間の表現型の違いがさらに蓄積された。2つの株間の表現型の違いの遺伝的根拠は、5つの染色体遺伝子座でのコーディング、調節、および挿入/削除の多型に起因している[6] 。カウロバクター・クレセンタスは、カウロバクター・ビブリオイデス(Caulobacter vibrioides)と同じ系統である[1]。
ゲノム構造
[編集]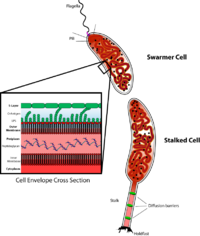
カウロバクターCB15ゲノムは3,767遺伝子をコードする、単一の円形染色体中4,016,942塩基対から構成される[7]。ゲノムには、栄養素の少ない生息地での生存に不可欠なタンパク質をコードする遺伝子の複数のクラスターが含まれている。多くの細胞質外機能シグマ因子に加えて、走化性、外膜チャネル機能、芳香環化合物の分解、および植物由来の炭素源の分解に関与するものが含まれ、生物に広範囲の環境変動への応答能力を提供している。 2010年には、カウロバクターNA1000株の配列決定がなされ、CB15株(ワイルドタイプ)との相違が明らかにされた[6]。
遊走細胞期の役割
[編集]ストーカー細胞のステージでは、細胞を表面に固定することで、バイオフィルムを形成したり栄養源を利用しやすくする。一般に、最も速く分裂する細菌種は、資源を利用したり生態学的ニッチを効果的に占有するのに最も効果的である。しかしながら、カウロバクターはスウォーマー細胞の段階を持っており、細胞増殖の速度は結果として遅くなる。この運動性細胞の段階を持つことの利点としては、細胞分散があると考えられている。同じ環境にとどまっていると、利用可能な資源が非常に急速に枯渇する可能性があるため、常に新しい環境を探す戦略を取ることは、栄養素が著しく制限されている環境で特に役立つ可能性がある。現実的には、おそらくほとんどのスウォーマー細胞は、より生産的な環境を見つけることはできないが、このような義務的な分散段階は、種全体の生殖適応度を高めることができる。
細胞周期
[編集]この細菌種で見られる細胞周期調節システムは、細胞の成長と生殖の進行を組織化する多くのサブシステムをモジュラー制御している。生化学的および遺伝的論理回路を使用して構築されたこの制御システムにおいて、いくつかのサブシステムが存在し、それぞれの開始のタイミングが制御されている。細胞周期調節の特徴は、周期的な遺伝子回路(細胞周期エンジン)であり、5つのマスター調節タンパク質(DnaA、GcrA、CtrA、SciP、およびCcrM)が連続的に相互作用することが、ルーシー・シャピロとハーレー・マカダムスによって明らかにされている[8][9][10]。これらの5つのタンパク質は、200を超える遺伝子の発現のタイミングを直接制御している。5つのマスター調節タンパク質は、細胞周期の過程で次々と合成され、そして分解される。この細胞周期エンジンが適切に機能するためには、いくつかの追加の細胞シグナル伝達経路も不可欠である。これらのシグナル伝達経路の主な役割は、細胞周期の適切な時期に細胞からCtrAタンパク質を確実に産生および排除することである。
カウロバクター細胞周期の本質的な特徴は、染色体が細胞周期ごとに一度だけ複製されることである。これは、例えば大腸菌の細胞周期で見られるように、染色体の複製(子に当たる染色体の合成)が進行中にさらに複製された染色体の複製(孫に当たる染色体の合成)が行われるような可能性があることと対照的である。DnaAとCtrAタンパク質の反対の役割は、カウロバクター染色体の複製の厳密な制御に不可欠である[11]。DnaAタンパク質は複製起点で作用し、染色体の複製を開始する。対照的に、CtrAタンパク質は複製の開始をブロックするように作用するため、染色体複製を開始する前に細胞から除去される。他にも、リン酸化シグナル伝達経路やタンパク質分解制御など、いくつかの細胞周期の調節に不可欠な複数の調節経路の存在が知られており、これらはDnaAとCtrAが必要なときに細胞内に存在することを正確に保証するように機能する[12]。
細胞周期エンジンのタンパク質によって活性化される各プロセスには、多くの反応のカスケードが含まれる。最も長いサブシステムカスケードはDNA複製である。培養条件にもよるが、カウロバクター細胞では、染色体の複製には各染色体あたり40〜80分かかり、この間に約200万回のDNA合成反応(塩基対の伸長反応)を行う。個々の合成反応の平均時間は、染色体を複製するのにかかった合計時間の平均から推定することができる、各反応の実際の反応時間は分散が大きく、平均から大きくずれていることがある。このことは、染色体の複製の完了にかかる時間には細胞間で変動があることを意味している。同様に、すべてのサブシステム反応カスケードの進行速度についても、反応速度のランダムな変動がある。そのため、一連の細胞周期を完了するのにかかる時間は、仮に細胞集団がすべて同じ環境条件下で成長している場合であっても、集団内でばらつきが発生してしまう。細胞周期調節には、各細胞の調節サブシステムレベルで、このような細胞間のばらつきを抑え、細胞周期のイベント進行度を一致させるように、細胞周期エンジンの進行をコントロールするようなフィードバックをさせるシグナルが含まれている。このように、複雑な細胞周期システムを駆動するコントローラー(セルサイクルエンジン)を備え、制御システムからのフィードバック信号による変調を備えたこの制御システム構成は、閉ループ制御システムを構成しているといえる。
細胞周期の進行速度は、環境条件(たとえば、栄養素の濃度や酸素濃度など)や細胞内部の状態(たとえばDNA損傷の有無など)を監視するような細胞センサーから生じるシグナルによっても影響を受ける[13]。
細胞周期制御システムの進化学的な保存性
[編集]カウロバクター細胞周期の進行を指示しペース調整をする制御回路は、細胞全体に統合システムとして組み込まれている。制御回路は、細胞周期サブシステムの活性化とカウロバクター・クレセンタスの非対称細胞分裂を調整するため、細胞トポロジーを含む細胞の環境と内部状態を監視する。カウロバクター細胞周期制御システムのタンパク質とその内部組織は、多くのアルファプロテオバクテリア種間で高度に保存されている、種ごとに制御機能や他細胞のシステムへの末梢接続性に大きな違いがみられる[14][15]。カウロバクター細胞周期制御システムは、内部の確率論的ノイズと環境の不確実性を克服するように強固な制御を行うトータルシステムとして、進化的選択によって絶妙に最適化されている。
この細菌細胞の制御システムは、階層的に組織されている[16]。シグナル伝達および制御サブシステムは、主に細胞表面に配置された感覚モジュールによって外部環境と接続される。遺伝子ネットワークロジックは、環境および内部のセルステータスセンサーから受信した信号に応答して、細胞を現在の状態に適応させる。トップレベルの制御の主な機能は、細胞周期に関連する操作が適切な時間的順序で発生することを保証することである。カウロバクターでは、これは5つのマスターレギュレーターと関連するリン酸化シグナル伝達ネットワークで構成される遺伝子調節回路によって達成される。リン酸化シグナル伝達ネットワークは、細胞周期の進行状態を監視し、非対称細胞分裂を達成する上で重要な役割を果たす。細胞周期制御システムは、染色体複製と細胞質分裂の開始の時間と場所、および極性細胞小器官の発達を管理する。これらすべての操作の根底にあるのは、タンパク質と構造成分の生成およびエネルギー生成のメカニズムである。「ハウスキーピング」な代謝や異化サブシステムとして、タンパク質合成や細胞壁構築、細胞にエネルギーと分子原料を提供するものなどがある。そのため、ハウスキーピング機能は、細胞周期制御システムに双方向で結合されている。しかしそれらは、細胞周期制御ロジックとは多少独立しており、利用可能な栄養源の組成や量の変化に適応することができる。
カウロバクター細胞周期制御システムのタンパク質は、アルファプロテオバクテリア全体で広く共保存されていますが、この調節システムの最終的な機能は種によって大きく異なる。これらの進化的変化は、フィットネス戦略と生態学的ニッチにおける個々の種間の大きな違いを反映している。たとえば、 Agrobacterium tumefaciensは植物病原菌、 Brucella abortusは動物病原菌、 Sinorhizobium melilotiは土壌細菌であり、カウロバクター細胞周期制御のほとんどのタンパク質である窒素を固定する植物の根の小結節に侵入して共生しているが、このような種においても同様な細胞周期制御システムが見られる。細胞周期制御ネットワークのタンパク質成分と回路の下流の読み出しとの間の特定の結合は、種ごとに異なる。すなわち、ネットワーク回路の内部機能はよく保存されているが、特定の細胞機能を制御するタンパク質への調節装置の「エッジ」での結合は、種によって大きく異なる。
カウロバクター系統群における茎の位置の進化
[編集]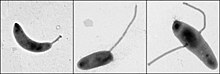
カウロバクター・クレセンタスは、細胞体からの管状が延長した茎構造を有する細菌群のメンバーである。ただし、茎の位置は、近縁種の細胞体の極でも必ず保存されているわけではない。具体的には、近縁属であるAsticcacaulisでは、茎の位置や数が変わる可能性が報告されている[17][18]。カウロバクター・クレセンタスではSpmXというタンパク質が極に偏在しているが、これがAsticcacaulis種において茎の位置を操作していると考えられている。おそらく、それは、カウロバクター・クレセンタスでは400程度のアミノ酸からなるタンパク質が、アスティカカウリス種では800以上ものアミノ酸を持つタンパク質へと巨大化し、そのことによって機能を獲得したのではないかと考えられている。
カウロバクターの老化
[編集]カウロバクターは、老化が示された最初の非対称細菌であった。生殖老化は、時間の経過とともに生成された子孫の数の減少として測定された[19][20]。実験的進化研究から、老化はおそらくすべての細胞生物の基本的な特性であることが示唆された。その後、同様の現象が、形態学的に類似した娘細胞を生じるEscherichia coli(大腸菌)でも報告された[21]。
細胞極性調節
[編集]細胞の極性は、極性オルガネラの集合と分裂面の分極によって作られる。その結果、よりスウォーマーの子孫よりも長いストーカーの子孫が生成される。分裂時の新しい細胞極性の形成により、ストーカー細胞では分裂前と同じ細胞極性が、そしてスウォーマー細胞では分裂前と逆の細胞極性が、それぞれ次世代の子孫に引き継がれることになる[22]。
C. crescentusのライフサイクルは、細胞周期タンパク質であるTipNなどの調節因子によって支配されている。イェール大学の研究データによると、TipNが前の細胞周期からの位置を手がかりに極性軸の方向を調節するモデルが強く示唆されている。このモデルでは、TipNは新しい極を識別することで、直近の細胞分割のサイトを認識する。細胞は、この位置情報を細胞内非対称性のソースとして使用して、極性軸の方向を確立し維持する。これは、極性の形態形成と分裂に重要である。分裂サイクルの終わりに、発生期の極にTipNを補充すると、極のアイデンティティが再定義され、将来の両方の娘細胞で正しい極性がリセットされます(スウォーマー細胞では極性が反転する)[22]。細胞周期によって調節されるこれらの極性局在構造の合成と除去は、適切な局在に重要なランドマークタンパク質を同定するための、有用なモデル系となっている[23]。TipNには、N末端領域に2つの膜貫通領域があり、 C末端に大きなコイルドコイルドメインがある。TipNホモログは他のアルファプロテオバクテリアにも存在する。TipNは、分裂後、両方の娘細胞の新しい極に局在し、分裂後期の細胞の細胞分裂部位に再局在する。したがって、両方の娘細胞は、分裂後の新しい方の極にTipNを持つ。
TipNは、べん毛を適切に配置するために不可欠である[24] 。TipNを欠く変異体は、細胞分裂時に正しい細胞極で単一のべん毛を作くことができず、茎の上を含む細胞上のあらゆる箇所でべん毛を作ります。 [22]

参考文献
[編集]- ^ a b Abraham, Wolf-Rainer; Carsten Strömpl; Holger Meyer; Sabine Lindholst; Edward R. B. Moore; Ruprecht Christ; Marc Vancanneyt; B. J. Tindali et al. (1999). “Phylogeny and polyphasic taxonomy of Caulobacter species. Proposal of Maricaulis gen. nov. with Maricaulis maris (Poindexter) comb. nov. as the type species, and emended description of the genera Brevundirnonas and Caulobacter”. International Journal of Systematic Bacteriology 49 (3): 1053–73. doi:10.1099/00207713-49-3-1053. PMID 10425763.
- ^ Ausmees, Nora; Kuhn, Jeffrey R.; Jacobs-Wagner, Christine (December 2003). “The bacterial cytoskeleton: an intermediate filament-like function in cell shape”. Cell 115 (6): 705–13. doi:10.1016/S0092-8674(03)00935-8. PMID 14675535.
- ^ Conger, Krista (March 31, 2009). “Top Canadian Prize Goes to Stanford Scientist Lucy Shapiro for Bringing Cell Biology into Three Dimensions”. Business Wire 14 May 2015閲覧。
- ^ “2014 Lucy Shapiro”. Greengard Prize (2014年). 14 May 2015閲覧。
- ^ Poindexter, JS (Sep 1964). “Biological Properties and Classification of the Caulobacter Group”. Microbiol. Mol. Biol. Rev. 28 (3): 231–95. doi:10.1128/mmbr.28.3.231-295.1964. PMC 441226. PMID 14220656.
- ^ a b Marks ME; Castro-Rojas CM; Teiling C; Du, L.; Kapatral, V.; Walunas, T. L.; Crosson, S. (July 2010). “The Genetic Basis of Laboratory Adaptation in Caulobacter crescentus”. J. Bacteriol. 192 (14): 3678–88. doi:10.1128/JB.00255-10. PMC 2897358. PMID 20472802.
- ^ Nierman, WC; Feldblyum, TV; Laub, MT; Paulsen, IT; Nelson, KE; Eisen, JA; Heidelberg, JF; Alley, MR et al. (Mar 27, 2001). “Complete genome sequence of Caulobacter crescentus”. Proceedings of the National Academy of Sciences of the United States of America 98 (7): 4136–41. Bibcode: 2001PNAS...98.4136N. doi:10.1073/pnas.061029298. PMC 31192. PMID 11259647.
- ^ McAdams, HH; Shapiro, L (Dec 17, 2009). “System-level design of bacterial cell cycle control”. FEBS Letters 583 (24): 3984–91. doi:10.1016/j.febslet.2009.09.030. PMC 2795017. PMID 19766635.
- ^ Collier, J; Shapiro, L (Aug 2007). “Spatial complexity and control of a bacterial cell cycle”. Current Opinion in Biotechnology 18 (4): 333–40. doi:10.1016/j.copbio.2007.07.007. PMC 2716793. PMID 17709236.
- ^ Tan, M. H.; Kozdon, J. B.; Shen, X.; Shapiro, L.; McAdams, H. H. (2010). “An essential transcription factor, SciP, enhances robustness of Caulobacter cell cycle regulation”. Proceedings of the National Academy of Sciences 107 (44): 18985–990. Bibcode: 2010PNAS..10718985T. doi:10.1073/pnas.1014395107. PMC 2973855. PMID 20956288.
- ^ Collier, J; Murray, SR; Shapiro, L (Jan 25, 2006). “DnaA couples DNA replication and the expression of two cell cycle master regulators”. The EMBO Journal 25 (2): 346–56. doi:10.1038/sj.emboj.7600927. PMC 1383511. PMID 16395331.
- ^ Jenal, U (Nov 2009). “The role of proteolysis in the Caulobacter crescentus cell cycle and development”. Research in Microbiology 160 (9): 687–95. doi:10.1016/j.resmic.2009.09.006. PMID 19781638.
- ^ Shen, X; Collier, J; Dill, D; Shapiro, L; Horowitz, M; McAdams, HH (Aug 12, 2008). “Architecture and inherent robustness of a bacterial cell-cycle control system”. Proceedings of the National Academy of Sciences of the United States of America 105 (32): 11340–45. Bibcode: 2008PNAS..10511340S. doi:10.1073/pnas.0805258105. PMC 2516238. PMID 18685108.
- ^ McAdams, Harley H.; Shapiro, Lucy (2011). “The Architecture and Conservation Pattern of Whole-Cell Control Circuitry”. Journal of Molecular Biology 409 (1): 28–35. doi:10.1016/j.jmb.2011.02.041. PMC 3108490. PMID 21371478.
- ^ Brilli, Matteo; Fondi, Marco; Fani, Renato; Mengoni, Alessio; Ferri, Lorenzo; Bazzicalupo, Marco; Biondi, Emanuele G. (2010). “The diversity and evolution of cell cycle regulation in alpha-proteobacteria: A comparative genomic analysis”. BMC Systems Biology 4: 52. doi:10.1186/1752-0509-4-52. PMC 2877005. PMID 20426835.
- ^ McAdams, HH; Shapiro, L. (May 2011). “The architecture and conservation pattern of whole-cell control circuitry”. J Mol Biol 409 (1): 28–35. doi:10.1016/j.jmb.2011.02.041. PMC 3108490. PMID 21371478.
- ^ Jiang, Chao; Brown, Pamela J.B.; Ducret, Adrien; Brun1, Yves V. (2014-02-27). “Sequential evolution of bacterial morphology by co-option of a developmental regulator”. Nature 506 (7489): 489–93. Bibcode: 2014Natur.506..489J. doi:10.1038/nature12900. ISSN 0028-0836. PMC 4035126. PMID 24463524.
- ^ Jiang, Chao; Caccamo, Paul D.; Brun, Yves V. (April 2015). “Mechanisms of bacterial morphogenesis: evolutionary cell biology approaches provide new insights”. BioEssays 37 (4): 413–25. doi:10.1002/bies.201400098. ISSN 1521-1878. PMC 4368449. PMID 25664446.
- ^ Ackermann, Martin; Stephen C. Stearns; Urs Jenal (2003). “Senescence in a bacterium with asymmetric division”. Science 300 (5627): 1920. doi:10.1126/science.1083532. PMID 12817142.
- ^ Ackermann, Martin; Alexandra Schauerte; Stephen C. Stearns; Urs Jenal (2007). “Experimental evolution of aging in a bacterium”. BMC Evolutionary Biology 7: 126. doi:10.1186/1471-2148-7-126. PMC 2174458. PMID 17662151.
- ^ Stewart, Eric J.; Richard Madden; Gregory Paul; Francois Taddei (2005). “Aging and Death in an Organism That Reproduces by Morphologically Symmetric Division”. PLOS Biology 3 (2): e45. doi:10.1371/journal.pbio.0030045. PMC 546039. PMID 15685293.
- ^ a b c H, Lam; Wb, Schofield; C, Jacobs-Wagner (2006-03-10). “A Landmark Protein Essential for Establishing and Perpetuating the Polarity of a Bacterial Cell” (英語). Cell 124 (5): 1011–23. doi:10.1016/j.cell.2005.12.040. PMID 16530047.
- ^ Treuner-Lange, Anke; Søgaard-Andersen, Lotte (2014-07-07). “Regulation of cell polarity in bacteria” (英語). Journal of Cell Biology 206 (1): 7–17. doi:10.1083/jcb.201403136. ISSN 0021-9525. PMC 4085708. PMID 25002676.
- ^ Huitema, Edgar; Pritchard, Sean; Matteson, David; Radhakrishnan, Sunish Kumar; Viollier, Patrick H. (2006-03-10). “Bacterial Birth Scar Proteins Mark Future Flagellum Assembly Site” (英語). Cell 124 (5): 1025–37. doi:10.1016/j.cell.2006.01.019. ISSN 0092-8674. PMID 16530048.
- ^ Lawler, Melanie L.; Brun, Yves V. (2006-03-10). “A Molecular Beacon Defines Bacterial Cell Asymmetry” (英語). Cell 124 (5): 891–93. doi:10.1016/j.cell.2006.02.027. ISSN 0092-8674. PMID 16530036.
