グルタチオン
| グルタチオン[1] | |
|---|---|
| |

| |
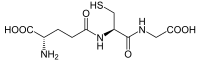
(2S)-2-アミノ-5-[[(2R)-1-(カルボキシメチルアミノ)-1-オキソ-3-スルファニルプロパン-2-イル]アミノ]-5-オキソペンタン酸 | |
別称 γ-L-グルタミル-L-システイニルグリシン | |
| 識別情報 | |
| 略称 | GSH |
| CAS登録番号 | 70-18-8 |
| PubChem | 124886 |
| KEGG | C00051 |
| MeSH | Glutathione |
| |
| 特性 | |
| 化学式 | C10H17N3O6S |
| モル質量 | 307.33 g/mol |
| 融点 |
195 °C, 468 K, 383 °F |
| 水への溶解度 | Miscible |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |


グルタチオン(Glutathione, GSH, Glutathione-SH)は、3つのアミノ酸(グルタミン酸、システイン、グリシン)から成るトリペプチドである。通常はあまり見られないシステインのアミノ基とグルタミン酸の側鎖側のカルボキシ基との間にアミド結合を有する。抗酸化物質の1つであるグルタチオンは、フリーラジカルや過酸化物といった活性酸素種から細胞を保護する補助的役割を有する[2]。また、グルタチオンは硫黄部位が求核性を有し、有毒な共役受容体にアタックする。
チオール基は、動物細胞では約5 mM以下の濃度において還元状態が維持されている。実際には、グルタチオンは電子供与体として作用することによって、細胞質性タンパク質中に形成されているあらゆるジスルフィド結合をシステインに還元する。このプロセスにおいて、グルタチオンは酸化型グルタチオン(GSSG, Glutathione-S-S-Glutathione)に変換される。グルタチオンは専ら還元型として存在することが知られているが、これは、酸化ストレスに曝されると、酸化型を還元型に変換する酵素(グルタチオンレダクターゼ)が構造的に活性化され、また誘導されるからである。事実上、細胞中の還元型グルタチオンと酸化型グルタチオンの比率は、しばしば細胞毒性の評価指標として科学的に用いられる[3]。
また、グルタチオンは日本薬局方に収載された医薬品であり、また健康や美容の維持に有用であるとして、サプリメントとして販売されている。しかし、消費者として注意すべきことは、日本では医薬品扱いであるため、日本の事業者がサプリメントとして販売できないことと、その販売行為は薬機法(旧称、薬事法)違反になることである。
グルタチオンは、細胞内に 0.5〜10 mMという比較的高濃度で存在する。一方細胞外の濃度はその1/100から1/1000程度である。グルタチオンには還元型 (GSH) と酸化型 (glutathione disulfide, GSSG)(右図)があり、酸化型は、2分子の還元型グルタチオンがジスルフィド結合によってつながった分子である。細胞内のグルタチオンは、通常、ほとんど(98%以上)が還元型として存在する。本稿では、特に注記しない限り、「グルタチオン」は還元型(GSH)を指すこととする。
構造
[編集]グルタチオンはグルタミン酸、システイン、グリシンが、この順番でペプチド結合したトリペプチドである (L-γ-glutamyl-L-cysteinyl-glycine)。ただし、グルタミン酸とシステインのアミド結合は通常のペプチド結合とは異なり、グルタミン酸側鎖のγ-カルボキシ基とシステイン主鎖のα-アミノ基からなる(γ-グルタミル結合)。このためグルタチオンは、ペプチドでありながら、ほとんどのプロテアーゼに対して耐性であり、分解されない。グルタチオンを直接分解できる酵素はγ-グルタミルトランスペプチターゼや、その近縁のごく限られた酵素のみである。
生理的機能
[編集]グルタチオンの生理的機能は多々あるが、主要な機能は大きく2つに分けることができる。
ひとつは細胞内のチオール環境を維持することである。チオールは生体内の主要な抗酸化成分である。グルタチオンは自らのチオール基を用いて過酸化物や活性酸素種を還元して消去する。また、タンパク質中のジスルフィド結合を還元して2つのチオール基に戻す。更に、グルタチオンは細胞のシステイン源でもあり、システインはチオール基を含む。
もうひとつの主要な生理機能は、様々な毒物・薬物・伝達物質等を細胞外に排出することである。グルタチオンはこれらの物質を、やはりシステイン残基のチオール基に結合させ(グルタチオン抱合)、自ら細胞外に排出されることで、細胞を解毒する。
細胞内チオール環境の維持
[編集]酸素は好気呼吸を行う生物にとって欠くことができないが、その反面、過酸化水素や酸素ラジカル(活性酸素種)が発生する原因ともなる。活性酸素種は反応性が高く、脂質やタンパク質を無秩序に酸化し(過酸化物)、生体に深刻なダメージを与える(酸化ストレス)。このため好気呼吸を行う生物は活性酸素種を消去し(還元して酸素や水に戻す)、また活性酸素種によってダメージを受けた部分を修復する機構を備えている。
細胞内で抗酸化作用を果たすものの1つとしてチオール基の働きが挙げられ、グルタチオンはチオール基を有する生体物質の中では細胞内に最も豊富に存在する。グルタチオンは、細胞内で発生した活性酸素種や、過酸化物と反応してこれを還元し、消去する。過酸化物の消去はグルタチオンペルオキシダーゼによって触媒され、活性酸素種はグルタチオンが直接反応する。いずれの反応においてもグルタチオンは相手を還元し、自らは酸化される。グルタチオン還元酵素は、NADPHの還元力を利用して酸化型グルタチオンを直ちに再還元する(参考: 酸化型グルタチオンの酸化還元電位 GSSG + 2 e → 2 GSH: −240 mV[4])。このため、還元型グルタチオンの濃度は通常一定に保たれており、これは細胞内のチオール濃度が一定に保たれていることも意味する。何らかの原因で還元型と酸化型の比率が大きく崩れた場合は、酸化型グルタチオンが細胞外に積極的に排出される。
グルタチオンは、酸化ストレスによってタンパク質中のレドックス活性なシステインとジスルフィド結合を形成するS-チオール化というレドックス翻訳後修飾を引き起こす(S-グルタチオン化)。S-グルタチオン化は、酸化ストレスに応答してチオールタンパク質の活性や機能を制御する重要なメカニズムである。酸化ストレスによって蓄積した過酸化水素 (H2O2)などによりタンパク質内チオールはスルフェン酸に酸化され、さらにスルフィン酸、スルホン酸まで順次酸化される。通常、チオールの酸化により生じたスルホン酸は不可逆的修飾であり、タンパク質の活性および機能は失われる。一方、タンパク質のスルフェン酸に対しグルタチオンが反応し、ジスルフィド結合を形成することで(S-グルタチオン化)不可逆的な過酸化を防ぐことが可能である。S-グルタチオン化は可逆的であり、細胞内レドックスが還元状態になるとグルタレドキシンおよびチオレドキシン系を介して元のチオールの状態に還元される。
グルタチオンはタンパク質中のジスルフィド結合の切断にも関与している。グルタレドキシンの触媒作用によってジスルフィド結合が還元され2つのチオール基に戻り、グルタチオンは酸化される。この反応は「チオール交換反応」と呼ばれる。
また、グルタチオンは細胞のシステイン源でもある。グルタチオンは、細胞外にあるγ-グルタミルトランスペプチターゼとジペプチターゼによって、構成アミノ酸であるグルタミン酸、システイン、グリシンにまで分解された後、細胞内に取り込まれる(大腸菌ではジペプチターゼは細胞内にある)。これらはアミノ酸源として利用される他、細胞内のグルタチオン再合成にも使われる。システインは単独で存在すると、容易に2分子が反応してシスチンとなり、その際ラジカルを発生する。このため、細胞中のシステイン濃度は比較的低く抑えられており、グルタチオンがシステインの貯蔵庫として利用されると考えられる。また酵母では、グルタチオンは、窒素源としても利用されると考えられている。
グルタチオン抱合による解毒
[編集]グルタチオンはシステイン残基のチオール基に様々な物質を結合する。これらには、毒物や、抗生物質などの薬物、ロイコトリエンやプロスタグランジン等といった各種伝達物質が含まれる。グルタチオン-S-トランスフェラーゼ (GSTs) によってこれらの結合反応が触媒される。また、ある種の金属イオンは非酵素的にグルタチオンと結合する。
グルタチオンとこれらの物質の結合物(抱合体)は細胞外に排出され、細胞から有害物質が取り除かれる。哺乳類の場合は抱合体は血中を移動し、腎臓まで運ばれる。腎臓でこの抱合体はメルカプツール酸に変換され、胆汁中や尿中に排出される。
グルタチオンは、代謝の副産物として産生するメチルグリオキサールの代謝にも必要である。メチルグリオキサールは、非酵素的にグルタチオンに抱合される。抱合されたメチルグリオキサールは、グリオキシラーゼI および II によって D-乳酸に変換され、グルタチオンから切り離される。
代謝
[編集]合成
[編集]グルタチオンは、γ-グルタミルシステイン合成酵素と、グルタチオン合成酵素の2つによって段階的に合成される。まず、γ-グルタミルシステイン合成酵素がシステインにグルタミン酸を結合し、γ-グルタミルシステインを合成する。γ-グルタミル結合はこの際に形成される。引き続いて、グルタチオン合成酵素がγ-グルタミルシステインにグリシンを結合し、グルタチオンが合成される。
分解
[編集]分解は、まず、γ-グルタミルトランスペプチターゼがγ-グルタミル結合を切断し、グルタミン酸と、ジペプチドであるシステイニルグリシンを生成する。システイニルグリシンは、更にジペプチターゼによって分解され、システインとグリシンとなる。γ-グルタミルトランスペプチターゼは細胞外に存在する酵素であるため、グルタチオンの分解は細胞外でしか行われない。
バイオマーカー
[編集]肝臓のグルタチオンが毒物や異物に結合して消費されると、γ-グルタミルシステイン合成酵素が活性化され、グルタチオンが合成される。同時にγ-グルタミルシステイン合成酵素と、グルタチオン合成酵素によって、2-アミノ酪酸を基質としてオフタルミン酸が肝臓内で生合成され、血中に排泄される。肝臓のグルタチオンが枯渇すると血中のオフタルミン酸が急増するため、血中のオフタルミン酸は肝臓のグルタチオンの枯渇を示すバイオマーカーとなる[5]。
医薬品
[編集]タチオン®(日本ジェネリック販売)、ランデールチオン®錠(鶴原製薬製造販売)として販売されている。
- 内服薬の適応症 - 薬物中毒、アセトン血性嘔吐症(自家中毒、周期性嘔吐症)、金属中毒、妊娠悪阻、妊娠高血圧症候群
- 注射の適応症 - 薬物中毒、アセトン血性嘔吐症(自家中毒、周期性嘔吐症)、慢性肝疾患における肝機能の改善、急性湿疹、慢性湿疹、皮膚炎、じんま疹、リール黒皮症、肝斑、炎症後の色素沈着、妊娠悪阻、妊娠高血圧症候群、角膜損傷の治癒促進、放射線療法による白血球減少症、放射線宿酔、放射線による口腔粘膜の炎症
美白作用
[編集]美白や色素沈着にいいと言われ作用機序からもそれは期待できるが、2016年の調査で経口摂取では有効とするランダム化比較試験 (RCT) が2件、ローションの外用で有効とするRCTが1件でメラニン指数の低下などで特定の疾患に有効だったというものはなく、静脈注射では研究なしだがフィリピンでは安価に偽造されたグルタチオン注射により命を脅かすことがあると注意喚起されている[6]。
欠乏症状
[編集]貧血、アシドーシス(5-オキソプロリン尿症) がある、神経学的な問題があると発作や知的障害、運動失調(アタキシア)などの問題を抱える。[7]。詳しくはグルタチオン合成酵素あるいは出典を参照。
その他
[編集]ホロン (phorone) は強力なグルタチオン枯渇剤 (glutathione depletor) として知られている。ホロンをラットなどに投与すると、体内にあるグルタチオンのチオール基と強力に反応し、これを不活性化する。このため、ホロンを投与された個体はグルタチオン欠乏の症状を呈する。これを利用してグルタチオンの生理作用、例えば喘息との関係などが調べられている[8]。
また、グルタチオンはカルシウム感知受容体に作用することにより[9]、うま味成分と共に摂取すると「コク味」を強く感じさせることが判明している[10]。グルタチオンのシステインをバリンに変えたグルタミルバリルグリシンはグルタチオンの10倍以上コクを感じさせる。グルタミルバリルグリシンはホタテガイや醤油、魚醤などに微量存在するが、味の素により工業化され、2014年8月8日に厚生労働省による食品添加物としての認可を受けた[11]。
参考文献
[編集]出典
[編集]- ^ Merck Index, 11th Edition, 4369.
- ^ Pompella, Alfonso; Visvikis, Athanase; Paolicchi, Aldo; De Tata, Vincenzo; Casini, Alessandro F (2003). “The changing faces of glutathione, a cellular protagonist”. Biochemical pharmacology (Elsevier) 66 (8): 1499-1503. doi:10.1016/S0006-2952(03)00504-5c. PMID 14555227.
- ^ Pastore, Anna; Piemonte, Fiorella; Locatelli, Mattia; Lo Russo, Anna; Gaeta, Laura Maria; Tozzi, Giulia; Federici, Giorgio (2001). “Determination of blood total, reduced, and oxidized glutathione in pediatric subjects”. Clinical chemistry (Oxford University Press) 47 (8): 1467-1469. doi:10.1093/clinchem/47.8.1467. PMID 11468240.
- ^ Åslund, Fredrik; Berndt, Kurt D; Holmgren, Arne (1997). “Redox potentials of glutaredoxins and other thiol-disulfide oxidoreductases of the thioredoxin superfamily determined by direct protein-protein redox equilibria”. Journal of Biological Chemistry (ASBMB) 272 (49): 30780-30786. doi:10.1074/jbc.272.49.30780. PMID 9388218.
- ^ Soga, Tomoyoshi; Baran, Richard; Suematsu, Makoto; Ueno, Yuki; Ikeda, Satsuki; Sakurakawa, Tadayuki; Kakazu, Yuji; Ishikawa, Takamasa; Robert, Martin; Nishioka, Takaaki; others (2006). “Differential metabolomics reveals ophthalmic acid as an oxidative stress biomarker indicating hepatic glutathione consumption”. Journal of Biological Chemistry (ASBMB) 281 (24): 16768-16776. doi:10.1074/jbc.M601876200. PMID 16608839.
- ^ Sonthalia, Sidharth; Daulatabad, Deepashree; Sarkar, Rashmi (2016). “Glutathione as a skin whitening agent: Facts, myths, evidence and controversies”. Indian Journal of Dermatology, Venereology, and Leprology 82 (3): 262. doi:10.4103/0378-6323.179088. PMID 27088927.
- ^ NIH (2022年4月12日). “Glutathione synthetase deficiency”. NIH/GARD. 2022年4月12日閲覧。
- ^ Thesis Joris Kloek 2001
- ^ “日本農芸化学会 2012年度大会トピックス賞 発表番号:2J16p09 「コク味」を有する新規γグルタミルペプチドの創出” (PDF). 日本農芸化学会 (2012年). 2019年3月11日閲覧。
- ^ 「コク味」の分子、有機化学美術館、2014年8月26日、同年8月28日閲覧
- ^ ~帆立貝や本醸造醤油などに含まれるコク味物質~味の素(株)が初めて工業化に成功した「グルタミルバリルグリシン」が食品添加物認可を取得、味の素、2014年8月19日、同年8月28日閲覧
関連文献
[編集]- Metacyc glutathione
- The antioxidant glutathione peroxidase family and spermatozoa: A complex story.
- The Role of Glutathione in Cell Defense.
- Glutathione metabolism and its implications for health.
- The changing faces of glutathione, a cellular protagonist.
- 診断と治療社『グルタチオン研究の進歩』、1969年
- 木下祝郎『グルタチオン』、講談社、1985年、ISBN 4061396269
- 坂本幸哉 ほか『グルタチオン研究のエポック : バイオサイエンスとしての新しい展開』共立出版〈蛋白質核酸酵素〉、1988年。 NCID BN02326285。
関連項目
[編集]外部リンク
[編集]- グルタチオン - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
