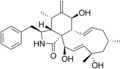
サイトカラシン
サイトカラシン(cytochalasin)類は、アクチンフィラメントへの結合活性を有し、アクチンの重合と伸長を阻害する菌代謝物である。アクチン重合の阻害の結果、サイトカラシン類は細胞形態を変化させ、細胞分裂といった細胞過程を阻害し、アポトーシスをも引き起こす[1]。サイトカラシン類は細胞膜を透過することができ、細胞輸送を妨げ、細胞の除核を引き起こす[2]。また、アクチン重合とは関連のないその他の生物学的過程にも影響する。例えば、サイトカラシンAおよびサイトカラシンBは細胞膜を超える単糖類の輸送を阻害し[2]、サイトカラシンHは植物生長を調節することが明らかになっており[3]、サイトカラシンDはタンパク質合成を阻害し[4]、サイトカラシンEは血管新生を妨げる[5]。
アクチンフィラメントへの結合
[編集]サイトカラシン類はマイクロフィラメントのとげのある成長側プラス端に結合することが知られており、個々のアクチンモノマーの会合および脱会合の両方を妨げる。結合すると、サイトカラシン類は新たなアクチンフィラメントの末端に実質的に蓋をする。サイトカラシン1分子が1本のアクチンフィラメントに結合する[2]。サイトカラシンDを用いた研究で、サイトカラシンD-アクチン二量体の形成がATP結合型アクチンを含むことが明らかにされている[6]。これらのサイトカラシンD-アクチンダイマーはATPの加水分解の結果、サイトカラシンD-アクチンモノマーへと縮小する。得られたサイトカラシンD-アクチンモノマーはATP結合型アクチンモノマーに結合し、サイトカラシンD-アクチンダイマーを再形成できる[2]。サイトカラシンDは活性が高く、低濃度(0.2 μM)で細胞膜の波打ち現象を妨げ、トレッドミル現象の邪魔をする[7]。アクチンフィラメントに対する様々なサイトカラシン類の効果が調べられ、ストレスファイバーの除去にはより高濃度(2-20 μM)のサイトカラシンDが必要であることが明らかにされた[7]。
対照的に、ラトルンクリンはアクチンモノマーに結合することによってアクチンフィラメントの重合を阻害する。
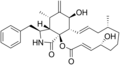
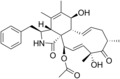
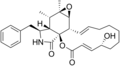
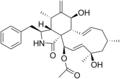
化学構造
[編集]脚注
[編集]- ^ Haidle, A. M.; Myers, A. G. (2004). “An Enantioselective, Modular, and General Route to the Cytochalasins: Synthesis of L-696,474 and Cytochalasin B” (pdf). Proceedings of the National Academy of Sciences 101 (33): 12048–12053. doi:10.1073/pnas.0402111101. PMC 514432. PMID 15208404.
- ^ a b c d Cooper, J. A. (1987). “Effects of Cytochalasin and Phalloidin on Actin” (pdf). Journal of Cell Biology 105 (4): 1473–1478. doi:10.1083/jcb.105.4.1473. PMC 2114638. PMID 3312229.
- ^ Cox, R. H.; Cutler, H. G.; Hurd, R. E.; Cole, R. J. (1983). “Proton and Carbon-13 Nuclear Magnetic Resonance Studies of the Conformation of Cytochalasin H Derivatives and Plant Growth Regulating Effects of Cytochalasins”. Journal of Agricultural and Food Chemistry 31 (2): 405–408. doi:10.1021/jf00116a055.
- ^ Ornelles, D. A.; Fey, E. G.; Penman, S. (1986). “Cytochalasin Releases mRNA from the Cytoskeletal Framework and Inhibits Protein Synthesis” (pdf). Molecular and Cellular Biology 6 (5): 1650–1662. PMC 367692. PMID 3785175.
- ^ Udagawa, T.; Yuan, J.; Panigrahy, D.; Chang, Y.-H.; Shah, J.; D’Amato, R. J. (2000). “Cytochalasin E, an Epoxide Containing Aspergillus-Derived Fungal Metabolite, Inhibits Angiogenesis and Tumor Growth” (pdf). Journal of Pharmacology and Experimental Therapeutics 294 (2): 421–427. PMID 10900214.
- ^ Goddette, D. W.; Frieden, C. (1987). “Actin Polymerization - The Mechanism of Action of Cytochalasin D” (pdf). Journal of Biological Chemistry 261 (34): 15974–15980. PMID 3023337.
- ^ a b Yahara, I.; Harada, F.; Sekita, S.; Yoshihira, K.; Natori, S. (1982). “Correlation between effects of 24 different cytochalasins on cellular structures and cellular events and those on actin in vitro”. Journal of Cell Biology 92 (1): 69–78. doi:10.1083/jcb.92.1.69. PMC 2112011. PMID 7199054.