チオ尿素
表示
(チオウレアから転送)
| チオ尿素 | |
|---|---|
|

|
Thiourea | |
別称 Thiocarbamide | |
| 識別情報 | |
| CAS登録番号 | 62-56-6 |
| PubChem | 2723790 |
| ChemSpider | 2005981 |
| UNII | GYV9AM2QAG |
| 国連/北米番号 | 2811 |
| KEGG | C14415 |
| ChEBI | |
| ChEMBL | CHEMBL260876 |
| RTECS番号 | YU2800000 |
| |
| |
| 特性 | |
| 化学式 | CH4N2S |
| モル質量 | 76.12 g/mol |
| 外観 | 白色固体 |
| 密度 | 1.405 g/ml |
| 融点 |
182 °C, 455 K, 360 °F |
| 水への溶解度 | 14.2 g/100ml (25°C) |
| 危険性 | |
| EU分類 | Carc. Cat. 3 Repr. Cat. 3 有害(Xn) 環境への危険性(N) |
| EU Index | 612-082-00-0 |
| NFPA 704 | |
| Rフレーズ | R22, R40, R51/53, R63 |
| Sフレーズ | (S2), S36/37, S61 |
| 関連する物質 | |
| 関連物質 | 尿素 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
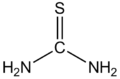
チオ尿素(チオにょうそ)は、尿素の酸素原子を硫黄原子に置き換えた構造をもつ、分子式 CH4N2S で表される有機化合物。>N-C(=S)-N< という構造をもつ化合物の一般名としても使われる。チオウレア、チオカルバミドとも呼ぶ。
性質
[編集]常温では無色の固体。水に易溶(142 g/L, 25℃)。強熱すると分解し、窒素酸化物、硫黄酸化物などを発生する。
加水分解されにくく、環境中に排出されると特に藻類に対して高い毒性を示す。ヒトが摂取すると、代謝されて生じるシアナミドによって甲状腺機能が低下することが知られている[1]。
生産と利用
[編集]シアナミドと硫化水素から合成する[2]。2001年度の日本国内製造・輸入量合計は約 2000 トンで、約半分がウレタン樹脂の原料として使われる[3]他、加硫促進剤[4]や薬剤原料などに使用される。銀製品の錆落としにも使用される。
有機化学
[編集]ハロゲン化アルキルと反応させてイソチオウロニウムとした後、加水分解すると対応するチオールが生じる[5]。硫黄源として硫化水素やその塩を用いる場合と異なり、スルフィドが生成しない利点がある。近年では有機分子触媒の基本骨格としても注目されている。
脚注
[編集]- ^ CERI有害性評価書
- ^ C. Wayne Bills, Anthony R. Ronzio, "Micro Syntheses with Tracer Elements. III. The Synthesis of Thiourea Labeled with C14 and of Thiourea Labeled with S35", J. Am. Chem. Soc. 1950 72, 5510-5511. [1]
- ^ http://www.safe.nite.go.jp/japan/sougou/data/pdf/risk/pdf_gaiyou/181gaiyou.pdf
- ^ https://warp.da.ndl.go.jp/info:ndljp/pid/10342974/www.jpo.go.jp/shiryou/s_sonota/hyoujun_gijutsu/golf_ball/page042.htm
- ^ Speziale, A. J. "Ethanedithiol." Org. Synth., Coll. Vol. 4, p. 401 (1963); Vol. 30, p. 35 (1950). [2]

