ツニカマイシン
| ツニカマイシン | |
|---|---|
| |
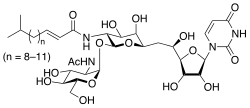
(E)-N-[(2S,3R,4R,5R,6R)-2-[(2R,3R,4R,5S,6R)- 3-acetamido-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy- 6-[2-[(2R,3S,4R,5R)-5-(2,4-dioxopyrimidin-1-yl)- 3,4-dihydroxyoxolan-2-yl]-2-hydroxyethyl]-4,5-dihydroxyoxan- 3-yl]-5-methylhex-2-enamide | |
別称 NSC 177382 | |
| 識別情報 | |
| CAS登録番号 | 11089-65-9 |
| PubChem | 6433557 |
| UNII | 55W4525Q2E |
| MeSH | Tunicamycin |
| ChEMBL | CHEMBL505513 |
| |
| 特性 | |
| 化学式 | C39H64N4O16 |
| モル質量 | N/A |
| 危険性 | |
| Rフレーズ | 28 |
| Sフレーズ | 28-37/39-45 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ツニカマイシン (tunicamycin) は、UDP-HexNAc:polyprenol-P HexNAc-1-P transferaseファミリーの酵素を阻害するヌクレオシド系抗生物質の同族体の混合物である。1971年にStreptomyces lysosuperificusから単離され[1]、1977年に構造決定された[2] 。真核生物では、糖タンパク質の合成の最初の段階でUDP-N-アセチルグルコサミンからN-アセチルグルコサミン-1-リン酸をドリコールリン酸へ転移するのを触媒する酵素である、N-アセチルグルコサミンリン酸転移酵素 (GlcNAc phosphotransferase (GPT)) がこのファミリーに含まれる。ツニカマイシンはN-結合型グリコシル化を防ぎ、ツニカマイシンで処理されたヒト培養細胞はG1期で細胞周期が停止する。ツニカマイシンは生物学の実験ツールとして、小胞体ストレスを誘導するためなどに利用される[3]。ツニカマイシンは、Streptomyces clavuligerusやStreptomyces lysosuperificusなどのいくつかの細菌によって産生される。
ツニカマイシンの同族体は、連結された脂肪酸側鎖に応じてさまざまな分子量を持つ[4][5]。
生合成
[編集]ツニカマイシンの生合成は Streptomyces chartreusis で研究されており、推定生合成経路が特定されている。この細菌は、ツニカマイシンの合成のためにtun遺伝子クラスターの酵素 (TunA–N) を利用する[6]。
TunAは、開始ユニットであるウリジン二リン酸-N-アセチルグルコサミン (UDP-GlcNAc) を利用して6位のヒドロキシル基の脱水反応を触媒する (反応はGlcNAc部分にのみ起こるので ’ などは簡略化のため省く)。まず、TunAのチロシン残基が4位のヒドロキシル基から水素を引き抜き、その位置にケトンが形成される。その後、NAD+によって4位の炭素からヒドリドが引き抜かれ、NADHが形成される。ケトンはチロシン残基と近傍のスレオニン残基との水素結合によって安定化される。その後、グルタミン酸残基が5位の炭素からプロトンを引き抜き、5位と6位の炭素の間に二重結合が形成される。近傍のシステイン残基が6位のヒドロキシル基にプロトンを供与し、水分子となって脱離する。NADHは4位の炭素にヒドリドを供与し、その部位にヒドロキシドが再形成されてUDP-6-deoxy-5,6-ene-GlcNAcとなる。その後、TunFによるエピマー化によって4位のヒドロキシル基がequatorial位からaxial位に変化し、UDP-6-deoxy-5,6-ene-GalNAcとなる[7]。
ツニカマイシンの他の開始ユニットは、ウリジン三リン酸 (UTP) から産生されるウリジンである。TunNはヌクレオシドジホスファターゼで、UTPからピロリン酸を除去してウリジン一リン酸を形成するのを触媒する。最後のリン酸基は、モノホスファターゼと推定されるTunGによって除去される。
ウリジンとUDP-6-deoxy-5,6-ene-GalNAcが産生されると、TunBはUDP-6-deoxy-5,6-ene-GalNAcの6位の炭素の連結を触媒する。TunBは、ウリジンのリボース部分の5’位の炭素にラジカルを形成するためにS-アデノシルメチオニン (SAM) を利用する。TunMは、ウリジンのラジカルとUDP-6-deoxy-5,6-ene-GalNAcの二重結合電子の1つを用いて、ウリジンの5’位の炭素とUDP-6-deoxy-5,6-ene-GalNAcの6位の炭素の間の新たな結合の形成を触媒すると考えられている。その後、UDP-6-deoxy-5,6-ene-GalNAcのラジカルは、SAMから水素を引き抜くことで消滅する[8]。結果として形成される分子は、UDP-N-アセチル-ツニカミン (UDP-N-acetyl-tunicamine) である。その後、TunHはUDP-N-アセチル-ツニカミンの加水分解を触媒しUDPを遊離させる。他のUDP-GlcNAc分子がもたらされ、TunDに触媒されてGlcNAc間にβ-1,1-グリコシド結合が形成され、UDP部分は除去される。その後、TunEによってUDP-N-アセチル-ツニカミン側のGlcNAcが脱アセチル化される。TunLと脂肪酸-ACPリガーゼがアシル輸送タンパク質 (ACP) であるTunKに脂肪酸を付加する。その後、TunCが脂肪酸をアミン部分に転移し、ツニカマイシンが産生される。
出典
[編集]- ^ Takatsuki, Akira; Arima, Kei; Tamura, Gakuzo (1971). “TUNICAMYCIN, A NEW ANTIBIOTIC. I. ISOLATION AND CHARACTERIZATION OF TUNICAMYCIN”. J. Antibiot. (Tokyo) 24 (4): 215–223. doi:10.7164/antibiotics.24.215. PMID 5572750.
- ^ Takatsuki, Akira; Kawamura, Kenji; Okina, Masao; Kodama, Yoshio; Ito, Teiichiro; Tamura, Gakuzo (1977). “Structural elucidation of tunicamycin. II. The structure of tunicamycin.”. Agric. Biol. Chem. 41 (11): 2307–2309. doi:10.1271/bbb1961.41.2307.
- ^ Hepatitis C virus envelope proteins regulate CHOP via induction of ...
- ^ Ito, Teiichiro; Takatsuki, Akira; Kawamura, Kenji; Sato, Katsuki; Tamura, Gakuzo (1980). “Isolation and structures of components of tunicamycin.”. Agric. Biol. Chem. 44 (3): 695–698. doi:10.1271/bbb1961.44.695.
- ^ [1] Tunicamycin product details]
- ^ Wyszynski, Filip; Hesketh, Andrew; Bibb, Mervyn; Davis, Benjamin (2010). “Dissecting tunicamycin biosynthesis by genome mining: cloning and heterologous expression of a minimal gene cluster”. Chemical Science 1 (5): 581. doi:10.1039/c0sc00325e.
- ^ Wyszynski, Filip; Lee, Seung; Yabe, Tomoaki; Wang, Hua; Gomez-Escribano, Juan Pablo; Bibb, Mervyn (July 2012). “Biosynthesis of the tunicamycin antibiotics proceeds via unique exo-glycal intermediates”. Nature Chemistry 4 (7): 539–546. doi:10.1038/nchem.1351. PMID 22717438.
- ^ Giese, Bernd (August 1989). “The Stereoselectivity of Intermolecular Free Radical Reactions [New Synthetic Methods (78)]”. Angewandte Chemie International Edition in English 28 (8): 969–980. doi:10.1002/anie.198909693.
関連項目
[編集]- グリコシル化 - ツニカマイシンはタンパク質の全てのN-グリコシル化を防ぐ
- 糖タンパク質
- ストレプトマイセス属 (Streptomyces)
外部リンク
[編集]- Book section of Essentials in Glycobiology (1999) Tunicamycin: Inhibition of DOL-PP-GlcNAc Assembly
- Tunicamycin data sheet prepared by a student of the Open University, UK
