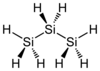
トリシラン
| トリシラン | |
|---|---|
|

|
Trisilane | |
| 識別情報 | |
| CAS登録番号 | 7783-26-8 |
| ChemSpider | 122661 |
| 国連/北米番号 | 3194 |
| |
| 特性 | |
| 化学式 | H8Si3 |
| モル質量 | 92.32 g mol−1 |
| 外観 | 無色の液体 |
| 匂い | 不快臭 |
| 密度 | 0.743 g cm−3 |
| 融点 |
-117 °C, 156 K, -179 °F |
| 沸点 |
53 °C, 326 K, 127 °F |
| 蒸気圧 | 12.7 kPa |
| 危険性 | |
| 主な危険性 | 自然発火性 |
| Sフレーズ | S3 |
| 引火点 | −40 °C (−40 °F; 233 K) |
| 発火点 | <50 °C (122 °F; 323 K) |
| 関連する物質 | |
| 関連するhydrosilicons | ジシラン ジシリン シラン シリレン |
| 関連物質 | プロパン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
トリシラン(英: trisilane、[traɪsaɪleɪn][要出典])は、3ケイ素シランである。化学式はSi3H8で、標準温度と標準圧力で液体である。プロパンのケイ素に相当するものである。
発見
[編集]1916年、Carl SomieskiとAlfred Stockにより塩酸とケイ化マグネシウムの反応の研究中に発見された。この反応は早くは1857年にフリードリヒ・ヴェーラーとHeinrich Buffにより研究され、1902年にはアンリ・モアッサンとSamuel Smilesにより研究されている。ケイ化マグネシウムの分解により様々なシランが生成するが、トリシランはSomieskiとStockにより明確に同定された。初めはシリコプロパンと呼ばれており、シリコブタン(Si4H10)、シリコペンタン(Si5H12)、シリコヘキサン(Si6H14)などのアルカンに相当するものの1つとして同定された。
合成
[編集]トリシランはSiH2とHClの反応から生じる微量の生成物である。この反応は赤外レーザーを用いて行われる。レーザーを質量分析計に垂直にして、ステンレスの円筒形のセルに設置した。Schlesinger過程を用いて製造することもできる。この過程は水素化リチウムアルミニウムとオクタクロロトリシランを1-ブトキシブタン中で反応させる。60年代にBowrey, Purnell, Walshにより実証されたように、モノシランとジシランの高温での熱分解によっても生成される。
分解
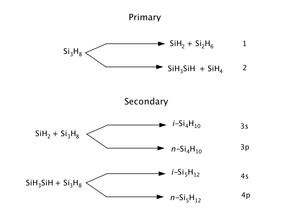
[編集]トリシランの分解は1,2水素シフトであり、ジシラン、通常のおよびイソテトラシラン、通常のおよびイソペンタシランを生成する。提案されているメカニズムは、Si上の4sと3dの低い状態にある空軌道を含む[1]。
用途
[編集]運搬
[編集]トリシランは、プラズマガン用のシリコンのキャリアとして研究されている。このプロセスは半導体や同様の用途に対して薄膜のシリコンに適用することができる。より有望な用途の1つは、ソーラーパネルを造るための安価なプロセスであろう。トリシランは20°Cで液体であるため、気体のシリコンキャリアよりも流量あたりのシリコンの量が多い。用途により気体、液体および/または固体の混合物が望ましいであろう。キャリアの組成を変化させることにより、膜厚の変化や材料上で固化することのできるスプレーからの液滴が得られ、これはコインと呼ばれる。コインの形成はキャリアが慎重に選ばれなければならない理由であり、コイン間のギャップは材料へのシリコンの不完全な適用につながる可能性がある[2]。
ナノワイヤ
[編集]シリコンは多くの多くのコンピュータハードウェアに使われる半導体として有用である。これは安定しており、そのような状況で良く機能する。シリコンの性質上、小さいスケールで動く方が良く、ナノワイヤを使用することが望ましいことになっている。ナノワイヤの成長のための以前の方法は、温度400 °C以上、圧力100bar以上、有機溶媒中の超臨界流体-液体-固体(SFLS)材料を必要としていた。高いエネルギーが必要なことや特殊な装置、および望ましくない副産物によりナノワイヤの製造が制限される可能性がある。トリシランを用いる方法はSFLS法に比べて多くの利点がある。大気圧で行うことができるだけでなく、ビスマスシードを用いては363 °C、金シードを用いては264 °Cで行うことができる。トリシランの方法は水溶液-液体-固体(SLS)であり、アモルファスや微粒子の副生成物が少なく、比較的きれいである。このプロセスはまだ生まれたばっかりであるが、利点は探究する価値がある。プロセスの微調整にはさらなる実験が必要であるが、予備的な結果は有望と考えられる[3]。
脚注
[編集]- ^ Kinetics of the Thermal Decomposition of Methyldisilane and Trisilane. A.J. Vanderwielen, M.A. Ring, H.E. O’Neal. JACS, 97:5, March 5, 1975
- ^ United States Patent Application Publication. Pub No. US 2012/0252190 A1, OCT, 4, 2012. Zehavi et al.
- ^ "Solution-Liquid-Solid (SLS) Growth of Silicon Nanowires". Andrew T. Heitsch, Dayne D. Fanfair, Hsing-Yu Taun, and Brian A. Korgel. JACS, March, 29,[要説明] 2008.
