フェニル基

フェニル基(フェニルき、phenyl group)またはフェニル環 (phenyl ring) は化学式 C6H5 で表されるベンゼンに似た原子団である。6つの炭素原子が平面をつくり、そのうち5つは水素と結合している。フェニル基は有機化学の分野で頻繁に登場する[1]。石炭から得られる物質によく見られるため、ギリシャ語のpheno(明かりを灯す)に由来する。
命名法
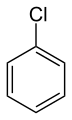
[編集]フェニル基はしばしば Ph と略され、たとえばベンゼンを PhH と表記することができる。Φと略記することも可能。フェニル基は分子内のほかの原子と結合している。トリフェニルメタン (Ph3CH) はその一例である。フェニル化合物は複数の名称を持つ事が多く、中には"フェニル"という文字を含まないものもある。たとえば塩素と結合した C6H5Cl はふつうはクロロベンゼンと呼ばれるが、塩化フェニルと呼ぶこともできる。稀なケースでは、フェニルアニオン (C6H5−)、フェニルカチオン (C6H5+)、フェニルフリーラジカル (C6H5) のような単独のフェニル基が検出される。
C6H5 と表される原子団はフェニル基ぐらいしかないので、その置換体の示性式でフェニル基の存在を強調することができる。たとえば O2NC6H4 はニトロフェニル基 (3つの異性体を持つ) で、F5C6 はペンタフルオロフェニル基である
化学的性質
[編集]フェニル化合物はベンゼンから (C6H6) 誘導されたとみなすことができる。電子的性質に着目したとき、フェニル基はビニル基と似ている。フェニル基は疎水性である。フェニル化合物は非常に安定なので、酸化・還元を受けにくい。
フェニル化合物はたいてい、フェニルアニオンやフェニルカチオンを供給する試薬から誘導される。代表的な試薬はフェニルリチウム (C6H5Li) と フェニルマグネシウムブロミド (C6H5MgBr) である。求電子試薬はベンゼンを攻撃し、フェニル化合物を与える。
- E+ (electrophile、求電子試薬) として代表的なものは、Cl+、NO2+、SO3H+である。これらの反応は芳香族求電子置換反応と呼ばれる。
- 代表的なフェニル化合物
-
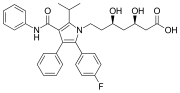
アトルバスタチンは画期的新薬で、2つのフェニル基と1つのp-フルオロフェニル基を持つ。
-
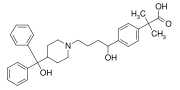
フェキソフェナジンも画期的新薬で、ジフェニルメチル基を持つ。
-
フェニルアラニンはα-アミノ酸の代表である。
-
ビフェニルは2つのフェニル基を持ち、2つの環は同一平面上には無い。
-
クロロベンゼンは溶媒として使われる。
フェニル基は多くの天然・合成有機化合物に含まれている。天然物の中で最も多量に存在するのはフェニルアラニンで、これはフェニル基を持つアミノ酸である。石油化学工業における主要生成物であるベンゼン、トルエン、キシレンは、フェニル化合物の骨格を担う。ポリスチレンはフェニル基を持つモノマーから合成され、その剛性や疎水性はフェニル環の存在によるものである。
フェノール、C6H5OH は最も単純なフェニル化合物の1つである。フェノールはエタノールのような脂肪族アルコールより酸性度が強い。フェノールとエタノールのpKaはそれぞれ 9.95 と 15.9 である。このことはしばしば共鳴理論により説明されるが、フェノールのsp2α炭素と脂肪族アルコールのsp3α炭素の電気陰性度の違いも重要である[2]。
出典
[編集]- ^ March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2.
- ^ "Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens." Pedro J. Silva J. Org. Chem. 2009 (Solvation effects on the relative acidities of acetaldehyde enol and phenol described in the Supporting Information)