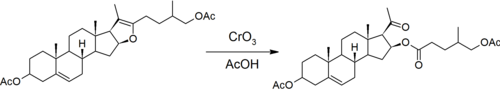マーカー分解
マーカー分解 (マーカーぶんかい、Marker degradation) は、アメリカの化学者ラッセル・マーカー(Russell Earl Marker) が1938年 - 1940年に開発したステロイド化学における 3ステップの合成ルートである。その方法は、植物ステロイドからコルチゾンおよび哺乳類性ホルモン (プロゲステロン、エストラジオールなど) の生産に使用され、メキシコを 第二次世界大戦直後の数年間のステロイド生産の世界センターにした[1]。マーカー分解の発見により、初めて大量のステロイドホルモンの生産が可能になり、経口避妊薬およびコルチコステロイド抗炎症薬の開発の基礎となった。1999年、アメリカ化学会 (American Chemical Society) とメキシコ化学協会 (Sociedad Químicade México) は、このルートを国際歴史化学ランドマークに指定した[1]。このルートの最初の大規模な適用は、1943年にマーカーが10トンのヤム 塊茎を集めて3キログラム (6.6ポンド) のプロゲステロンを合成したときに行われた。これは、その時までに生産されたプロゲステロンの最大の単一量であった[1]。その単一のバッチは、合成時に米ドルで 240,000ドル (2009年には約300万ドル[2] )の価値があった[1]。マーカー分解の発見は、メキシコのファインケミカル産業の発展につながった。この産業は、ゼロから始めて、米国で10年以内に販売された人間の性ホルモンの半分以上を供給した。活況を呈している産業は、メキシコの化学教育の大幅な拡大を引き起こした。
初期の開発
[編集]ペンシルベニア州立カレッジ (現在ペンシルベニア州立大学) でのマーカーの研究は「比較的安価な出発物質」からステロイドホルモンへの合成経路を見つけることに向けられた[3]。彼がサポゲニンと呼ばれる一連の植物ステロイドに取り組んでいる間、化合物の1つであるサルササポゲニンの側鎖[注 1]の構造が、はるかに反応性の高い「ケトン スピロ アセタール」であるのに、文献には非反応性の「二重テトラヒドロフラン」であると誤って記載されていることに気付いた[3]。ケトンスピロアセタールは塩基性または中性条件では反応しなかったが、酸性条件下では分解する可能性がある。実際、マーカーはそれを「異常な反応性」と表現した[3]。サルササポゲニン側鎖の本質を示すことにおいて、マーカーは、のちにマーカー分解として知られるようになるステップの最初のステップを発見した。サルササポゲニンは他のステロイドの市販の前駆体には高価すぎるため、マーカーはプロゲステロンに密接に関連するサポゲニンのより豊富な供給源を探すことに着手した。彼は、Trillium erectum ("Beth root" or "Wake-robin") の中のジオスゲニンと呼ばれるサポゲニンを一つの候補として特定した。それは、以前日本産ヤム (オニドコロ、Dioscorea tokoro) から見出されたものである[1][4]。マーカーは、サルササポゲニンとジオスゲニンの両方ともプロゲステロン[5]や他のステロイドに変換できることを示した[6][注 2]。T. erectumから得られるジオスゲニンの量は不十分なので、マーカーはより含有量の多いソースを探した。彼は最終的に別の種のDioscorea (ヤマノイモ属)、地元では「cabeza de negro」[注 3]として知られるメキシコ産ヤムイモに遭遇した。その塊茎は重量100キログラム (220ポンド) にも育つと報告されている[1]。
ジオスゲニンからの合成経路
[編集]多くのステロイド化学と同様に、マーカー分解は速度論的制御に大きく依存してサポゲニン側鎖を分解するが、ステロイド核上の同様の官能基は(比較的)影響を受けない。
最初のステップは、サポゲニンが側鎖にケトンスピロアセタール構造を持っていることをマーカーが発見した反応である[7]。アセタールは塩基性条件では不活性だが、酸性条件では加水分解することができる。マーカーは無水酢酸を使用して、六員のピラン環を開くことによって形成されるヒドロキシル基をブロックする[8]。
クロム酸による酸化で五員のフラン環が開く。これにより、プロゲステロンのアセチル側鎖とステロイド核上のエステル化ヒドロキシル基が形成される。
次いで強い塩基条件でエステルが加水分解される。エタノール性水酸化ナトリウムを使用すると水が脱離して二重結合が形成される。
得られた16-デヒドロプレグネノロンアセテート (3-ヒドロキシプレグナ-5,16-ジエン-20-オン)は、2段階でプロゲステロンに変換できる。最初に、D環の二重結合が水素化され、続いてヒドロキシル基のオッペナウアー酸化が行われ、残りのオレフィンがB環からA環に同時に移動して3位にケトカルボニル基が結合する[1][5]。
テストステロン、エストロン、エストラジオールに変換することもできる[1][6]。
メキシコのステロイド産業
[編集]マーカーの初期の開発作業は、現在ファイザーの一部であるアメリカの大手製薬会社であるパークデービスによってサポートされていた[1]。しかし、マーカーは、原材料に近いメキシコでステロイドを生産する方が商業的に理にかなっていることに気づいた (メキシコの Discorea sp;D.composita[1])が塊茎を米国に返送するよりも好ましい種になると考えられた。パークデービスは、メキシコでファインケミカル製造施設を運営することが科学的に実現可能であるとは考えていなかったため、コラボレーションが創設された[1]。代わりに、マーカーは自分でメキシコのパートナーを探すことに決め、1943年12月1日に学業を辞任した[1]。この分裂の一つの結果は、マーカー分解の特許が取得されていなかったことである[1]。
マーカーは、1944年の初めに、2人のメキシコ人投資家であるEmericSomloとFedericoLehmannと共同でメキシコの会社シンテックス (Syntex)[注 4]を設立した。マーカーは、シンテックスの40%の株式をプロゲステロン (1グラムあたり約80ドルの価値がある)で部分的に支払ったと言われている[1]。1年以内に、シンテックスはプロゲステロンを1グラムあたり50ドルで販売していた[1]。しかし、マーカーは1945年5月に利益をめぐってパートナーと決別し、ボタニカメックス (Botanica-mex)と呼ばれる新しい会社を設立した。この会社は後にGedeon Richter Ltd.に売却され、Hormonosynth(後のDiosynth)に改名された[1]。
メキシコでのファインケミカル製造の難しさは確かにかなりのものであった。訓練を受けた化学者が大幅に不足しており、メキシコのどの大学でも化学の博士課程がなかった。マーカーがシンテックスを離れたとき、残った彼の協業者は、製造プロセスの指示書とコードでラベル付けされた試薬ボトルを見つけられなかった[1]。彼らはマーカーの後任としてローゼンクランツ (George Rosenkranz) を雇った[1]。彼はETH Zurich (チューリッヒ工科大学)で訓練を受けたハンガリーの有機化学者で米国の第二次世界大戦への参入によってキューバで立ち往生していた。ローゼンクランツは、ジオスゲニンからのプロゲステロンの製造プロセスを事実上再発明する必要があった。彼はまた、メキシコ国立自治大学 (National Autonomous University of Mexico)) に化学研究所を設立した[1]。最初の研究生の1人はルイス・ミラモンテスで、彼はその後、シンテックスの中心的な研究者になった。
ローゼンクランツはまた、オーストリア系ユダヤ人の難民で帰化アメリカ人のカール・ジェラッシ (Carl Djerassi) やウルグアイ人のアレハンドロザファローニ (Alejandro Zaffaroni)などの外国人のスタッフを雇った。1951年、ジェラッシ、、ミラモンテス、ローゼンクランツはシンテックスでノルエチステロンを合成した。これは、最初の経口活性プロゲステロン類似体であり、最初の経口避妊薬の重要な成分である.[9]。この時までに、シンテックスとそのメキシコの競合他社 (パーシー・レイボン・ジュリアン (Percy Lavon Julian) (米国科学アカデミー (National Academy of Sciences)に入った最初のアフリカ系アメリカ人化学者) を含む) は 米国で販売されている人間の性ホルモンの半分以上を供給し[注 5]、プロゲステロンの価格は2ドル/グラムに下がっていた[1]。フォーチュン誌は、同じ年(1951)に「シンテックスは国境の南でこれまでに聞いた中で最大の技術ブームを起こす」という見出しの記事を掲載した:1999年までに、そして後知恵の恩恵を受けて、これは米国科学アカデミーによって、特にシンテックスの生産と研究が真にグローバルな影響を及ぼしているため、控えめな表現であると見なされた[1]。シンテックスの研究の影響は、ルイス・フィーザー (Louis Fieser) とメアリー・ピーターズ・フィーザー (Mary Peters Fieser) による1959年の権威あるモノグラフ「Steroids」[10] から見ることがでる。シンテックスは、工業研究所から引用されたすべての論文の30%を占めた[1] 。1959年、シンテックスはパナマ企業としての地位を再構築し、本社を米国のパロアルト (カリフォルニア州)に移転した[11]。
注と脚注
[編集]注
[編集]- ^ ステロイドは、4つの縮合環の炭素原子(3つの6員環と1つの5員環)によって特徴付けられる。多くのステロイドには、炭素原子の側鎖もあり、通常は5員環に結合している。
- ^ 当時は知られていなかったが、他のステロイドホルモンの前駆体としてのプロゲステロンの使用は、生合成経路を厳密に模倣している。人間の男性はテストステロンの前駆体としてプロゲステロンを合成し、人間の女性はさまざまなエストロゲンの前駆体としてテストステロンを合成する。 コルチゾンも、マーカー分解の発見後に開発された工業プロセスのように、人体のプロゲステロンから合成される。
- ^ cabeza de negro or ilama (Annona purpurea) として知られる果実と混同しないように.
- ^ 現在のエフ・ホフマン・ラ・ロシュ(F. Hoffmann-La Roche, Ltd.)の一部門
- ^ 比較的)安価なプロゲステロンが(比較的)大量に入手できることで市場が生まれ、他のメーカーがステロイドホルモンの製造プロセスを改善することに拍車をかけた。これはコルチゾンの場合に最もよく見られる。Merck&Co.去勢牛の胆汁からのオリジナルの36ステップ合成は、メキシコのヤムから調製されたコルチゾンとの競争力を維持するために改善された。
脚注
[編集]- ^ a b c d e f g h i j k l m n o p q r s t u v “Russell Marker and the Mexican Steroid Hormone Industry”. American Chemical Society. June 5, 2012閲覧。
- ^ “The Inflation Calculator”. 2011年7月18日時点のオリジナルよりアーカイブ。2010年3月6日閲覧。
- ^ a b c Marker, Russell E.; Rohrmann, Ewald (1939), “Sterols. LIII. The Structure of the Side Chain of Sarsasapogenin”, J. Am. Chem. Soc. 61 (4): 846–51, doi:10.1021/ja01873a020.
- ^ Tsukamoto; Ueno; Ohta (1936), “Glycosides of Dioscorea tokoro I. Diocin, dioscoreasapooxin and diosgenin”, J. Pharm. Soc. Jpn. 56: 135. Tsukamoto; Ueno; Ohta (1937), “Über die Konstitution des Diosgenins II”, J. Pharm. Soc. Jpn. 57 (11): 985, doi:10.1248/yakushi1881.57.11_985.
- ^ a b Marker, Russell E.; Rohrmann, Ewald (1939), “Sterols. LXXXI. Conversion of Sarsasapogenin to Pregnanediol-3(α),20(α)”, J. Am. Chem. Soc. 61 (12): 3592–93, doi:10.1021/ja01267a513. Marker, Russell E.; Rohrmann, Ewald (1940), “Sterols. LXXXVIII. Pregnanediols from Sarsasapogenin”, J. Am. Chem. Soc. 62 (3): 518–20, doi:10.1021/ja01860a017. Marker, Russell E.; Tsukamoto, Takeo; Turner, D. L. (1940), “Sterols. C. Diosgenin”, J. Am. Chem. Soc. 62 (9): 2525–32, doi:10.1021/ja01866a072.
- ^ a b Marker, Russell E. (1940), “Sterols. CV. The Preparation of Testosterone and Related Compounds from Sarsasapogenin and Diosgenin”, J. Am. Chem. Soc. 62 (9): 2543–47, doi:10.1021/ja01866a077.
- ^ Myers, Rusty L.; Myers, Richard L. (2007), The 100 most important chemical compounds: a reference guide, Westport, Conn: Greenwood Press, pp. 205–8, ISBN 978-0-313-33758-1.
- ^ Dewick, P. M. (2009), Medicinal natural products: a biosynthetic approach, New York: Wiley, pp. 281–83, ISBN 978-0-470-74167-2.
- ^ US 2744122, Djerassi, Carl; Luis Miramontes & George Rosenkranz, "Δ4-19-nor-17α-ethinylandrosten-17β-ol-3-one and process", published 1956-05-10, assigned to Syntex.
- ^ Fieser, Louis F.; Fieser, Mary P. (1959), Steroids, New York: Van Nostrand Reinhold, ISBN 0-278-91709-7.
- ^ Gereffi, Gary (1983). The Pharmaceutical Industry and Dependency in the Third World (2017 reprint ed.). Princeton University Press: Princeton. p. 110. ISBN 9781400886227 11 January 2021閲覧。
。