ラザフォードの原子模型
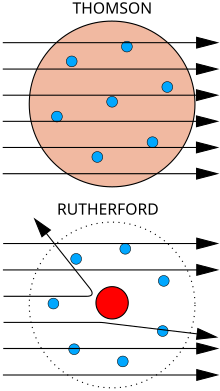
ラザフォードの原子模型(ラザフォードのげんしもけい)またはラザフォード・モデル(英語: Rutherford model)は、アーネスト・ラザフォードが提案した原子の内部構造に関する原子模型である。惑星モデルとも呼ばれる。ラザフォードは1909年に有名なガイガー=マースデンの実験を指揮し、その実験結果に基づき、1911年にこの原子模型を発表した。この模型では、原子の大きさに比べて非常に小さな中心核(すなわち原子核)に原子の質量の大部分と電荷が集中しているとしている[1]。
ラザフォードの原子模型は、当時考えられていた原子模型のうち、J・J・トムソンの「ブドウパンモデル」が正しくないことを示唆している。一方で、電子軌道のような原子構造については何も進展していなかった。この点についてラザフォードは単に、太陽の周りを回る惑星のように多数の小さな電子が中心核の周囲を回っているか、土星の環のように回っているという従来からあった原子模型について言及しているだけである。しかし、従来考えられていたよりも小さな中心核に質量のほとんどが集中しているとしたことで太陽系との類似点が大きくなり、土星の環よりも太陽と惑星の比喩が的確となった。
実験的基盤
[編集]1911年、ラザフォードは予想もしていなかった実験結果の解釈として、原子の内部構造に関する独自の模型を発表した。原子内では中心の電荷(原子核のことだが、ラザフォードは核 (nucleus) という用語は使っていない)の周りを雲のように電子が飛び回っているとした。この1911年の論文でラザフォードが確信していたのは、原子の小さな中心領域に正または負の電荷が集中しているという点だけだった。
「具体的には、高速なアルファ粒子が原子を通り抜けた経路から、原子には正の中心電荷 Ne があり、それとは逆に帯電した N 個の電子がその周囲にある」[2]
既知の速度のアルファ粒子が 100e の中心電荷にどれだけ近づけるかを純粋にエネルギーの観点で考え、ラザフォードは金の中心電荷の半径が 3.4×10−14 メートルよりも小さい(実際どれぐらい小さいかは不明)という計算結果を得た(現代の計算値はその5分の1)。金の原子自体の半径は 10-10 メートルであり、中心電荷がその3000分の1の大きさしかないという驚くべき結果だった。
ラザフォードの原子模型は原子の電荷と質量が中心に集中していることを明らかにしたが、原子の残りの部分がどうなっているのか、電子がどういう軌道を描いているかについては全く言及していない。彼は土星の輪のように電子が1つまたは複数の環状の軌道を描いているとする長岡半太郎の原子模型に言及した。同様の環状の軌道はJ・J・トムソンのいわゆるブドウパンモデルでも言及されている。
ラザフォードの論文では、原子の中心電荷が原子質量単位 u (ラザフォードのモデルでは現在の統一原子質量単位の約半分)で表した原子の質量に「比例」するのではないかと示唆している。金の原子量は197で(当時は正確には分かっていなかった)、ラザフォードはこれを196uとモデル化した。しかし、ラザフォードは中心電荷と原子番号を直接結び付けようとはしなかった。なぜなら金の原子番号は79だが、ラザフォードは金の原子核がヘリウム原子核49個ぶんの質量があると考え、従って質量は196u、電荷は96e だと考えていたからである。そのため実験においても金の中心電荷は約100eだとして計算を行っていた。したがって金の原子番号(当時は単に周期律表上の位置を示す値でしかなかった)とはかけ離れていたため、原子番号と中心電荷が対応しているとは考えもしなかった。
ラザフォードが論文を発表した1カ月後、Antonius van den Broek が原子番号と核の電荷が直接結びつくのではないかという提案をし、2年以内にヘンリー・モーズリーが実験によってそれを確認した。
重要な点
[編集]- 電子の雲はラザフォード散乱には影響しない。
- 原子の電荷の大部分、原子質量単位で表した質量の約半分までが原子の中心の非常に小さい部分に集中している。この電荷がアルファ粒子とベータ粒子の散乱の原因である。
- 金のような重い原子の質量の大部分が中心領域に集中しており、電子に比べると運動量が非常に大きいため、アルファ粒子によって逸らされたり動かされたりしない。
科学的影響
[編集]ラザフォードの発見後、原子は単一の粒子ではなくもっと小さな粒子が集まって構成されていることが徐々に判明していった。原子核は原子自体よりもずっと小さく、原子の体積の大部分は何もないことが判明していった。
その後、X線を使って原子内の電子数(原子番号と同じ)が数えられることがわかった。X線が原子を通過するとき、その一部が散乱し、残りはそのまま通過する。X線が散乱するのは電子とぶつかって散乱した部分であり、X線の減衰した量を計測することで原子内の電子数を正確に推測可能となった。
象徴性
[編集]
ラザフォードの原子模型は不正確ではあったが、一般大衆が原子を想像する際の原形となった。これは、より正確なボーアの原子模型にはなかったことである。そして、原子や原子力を表す象徴として使われ続けている。以下にその例を挙げる。
- アメリカ原子力委員会のロゴ
- 国際原子力機関 (IAEA) の旗
- アメリカのマイナーリーグのチームアルバカーキ・アイソトープスのロゴ
- Unicode の Miscellaneous Symbols の U+269B
脚注・出典
[編集]- ^ Akhlesh Lakhtakia (Ed.) (1996). Models and Modelers of Hydrogen. World Scientific. ISBN 981-02-2302-1.
- ^ E. Rutherford. The Scattering of α and β Particles by Matter and the Structure of the Atom. May 1911, Philos. Mag, 21:669-688, pdf downloaded 2008-10-09
