五フッ化リン
この項目「五フッ化リン」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en: Phosphorus pentafluoride, de: Phosphorpentafluorid) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2017年6月) |
| 五フッ化リン | |
|---|---|
|

|
Phosphorus pentafluoride | |
別称 フッ化リン(V) ペンタフルオロリン ペンタフルオロホスホラン | |
| 識別情報 | |
| CAS登録番号 | 7647-19-0 |
| PubChem | 24295 |
| ChemSpider | 22715 |
| EC番号 | 231-602-3 |
| 国連/北米番号 | 2198 |
| RTECS番号 | TH4070000 |
| |
| |
| 特性 | |
| 化学式 | F5P |
| モル質量 | 125.97 g mol−1 |
| 外観 | 無色気体 |
| 匂い | 不快臭 |
| 密度 | 5.69 kg/m3 (g/L) (0 °C, 1013 mbar)[1] |
| 融点 |
-93.8 °C, 179 K, -137 °F [1] |
| 沸点 |
-84.6 °C, 189 K, -120 °F [1] |
| 水への溶解度 | 加水分解 |
| 蒸気圧 | 28バール (2.8 MPa) (20 °C)[1] |
| 構造 | |
| 分子の形 | 三方両錐形 |
| 双極子モーメント | 0 D |
| 危険性 | |
| GHSピクトグラム |    [1] [1]
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H280 H314 H330 |
| EU分類 | |
| Rフレーズ | R26 R35 |
| Sフレーズ | S9 S26 S36/37/39 S45 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陰イオン | 五塩化リン 五臭化リン 五ヨウ化リン |
| その他の陽イオン | 五フッ化ヒ素 五フッ化アンチモン 五フッ化ビスマス |
| 関連物質 | 三塩化リン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
五フッ化リン(五弗化燐、ごふっかりん、英: Phosphorus pentafluoride)は、リンとフッ素からなる無機化合物である。分子式はPF5であり、ハロゲン化リンに分類される。標準状態では不燃性の無色気体で、強い毒性および刺激臭がある。湿った空気もしくは水と接触すると激しく反応してフッ化水素(HF)およびリン酸 (H3PO4)を生じる。
歴史
[編集]五フッ化リンは1876年にイギリス人化学者のトーマス・エドワード・ソープにより初めて単離・記載された[2]。
合成
[編集]五フッ化リンは五塩化リン(PCl5)の三フッ化ヒ素(AsF3)によるフッ素化により、三塩化ヒ素(AsCl3)と共に合成できる。
五フッ化リンは強く発煙する気体として得られ、三塩化ヒ素は残留する。
物性
[編集]物理的物性
[編集]
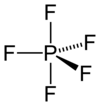
五フッ化リン分子は、中心リン原子と共有結合した、3つのフッ素の成す三角形(エクアトリアル位)を底面とし、同じくリン原子と結合した2つのフッ素を頂点(アキシアル位)とした三方両錐形分子構造を持つ。底面におけるF–P–F結合角は120° であり、2つのアキシアル位のフッ素原子は底面に対し垂直に結合する。リン原子とエクアトリアル位のフッ素原子との間の結合長はそれぞれ153 pmで、アキシアル位の原子との結合長は5 pm長く、158 pmである。
三方両錐形分子構造では二種類のフッ素原子が区別されるはずだが、フッ素19 NMR分光では、−100 °C まで温度を下げてもアキシアル位のフッ素とエクアトリアル位のフッ素とを区別することはできない。これは、フッ素原子の分子内における位置交換を起こすベリー擬回転に起因する。この位置交換はNMR測定による検出が不可なほど速く、応答が時間平均されてしまう結果として、みかけ上5つの等価なフッ素原子に対応するスペクトルが得られる。
PF5のF中心のみかけの等価性は Gutowsky により初めて言及された[3]。その説明はR・スティーブン・ベリーにより初めて与えられ、ベリー機構と名付けられた。NMRはミリ秒単位の時間スケールで動作するため、ベリー擬回転は、五フッ化リンに対する19F NMRスペクトルに影響を与える。固体の場合は、溶液中に比べて分子が静的であり、原子位置が変化できないために、電子線回折およびX線結晶構造解析で観測してもこの効果は見られない。
標準状態では五フッ化リンは無色気体で、空気の4-5倍重い。
融点 −93.8 °C よりも下では五フッ化リンは空間群 P63/mmc(194番)で格子定数 a = 556 pm, c = 618 pm (c/a = 1.11) の既約単位格子あたり2式量を含む六方晶系に結晶化する[4]。
化学的物性
[編集]五フッ化リンは加水分解に対する反応性が極めて高い。湿った空気中および水との接触により激しく自発反応してフッ化水素(HF)とリン酸(H3PO4)を生じる。
フッ化物イオン濃度の高い溶液中ではルイス酸として反応し、六フッ化リン(V)アニオン(PF6−)を生じる。このアニオンは六フッ化硫黄(SF6)およびヘキサフルオロケイ酸アニオン(SiF62−)と等電子的である。このイオンの共役酸であるヘキサフルオロリン酸(HPF6)はヘキサフルオロケイ酸(H2SiF6)と同様、直接脱水するのではなくHFが脱離してPF5に戻る。
水の存在下でのHF脱離により、ガラス表面は腐蝕する。
五フッ化リンの誘導体としては、エクアトリアル位のフッ素原子が水素原子に置き換わったフルオロホスフィン類、HPF4、H2PF3、H3PF2 が挙げられる。
脚注
[編集]- ^ a b c d e Record of Phosphorpentafluorid 労働安全衛生研究所(IFA)発行のGESTIS物質データベース.
- ^ Thorpe, T. E. (1876). “On Phosphorus Pentafluoride”. Proc. R. Soc. Lond. 1 25 (171-178): 122-123. doi:10.1098/rspl.1876.0026.
- ^ Gutowsky, H. S.; McCall, D. W.; Slichter, C. P. (1953). “Nuclear Magnetic Resonance Multiplets in Liquids”. J. Chem. Phys. 21 (2): 279. doi:10.1063/1.1698874.
- ^ Mootz, D.; Wiebcke, M. (1987). “Fluorides and fluoro acids. XIII. The crystal structure of phosphorus pentafluoride”. Z. Anorg. Allg. Chem. 545 (2): 39-42. doi:10.1002/zaac.19875450204.
参考文献
[編集]- Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- Thorpe, T. E. (1876). “Ueber Phosphorpentafluorid”. Liebigs Ann. 182 (1–2): 201–206. doi:10.1002/jlac.18761820118.


