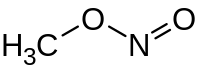
亜硝酸メチル
| 亜硝酸メチル | |
|---|---|
| |
| 識別情報 | |
| CAS登録番号 | 624-91-9 |
| PubChem | 12231 |
| ChemSpider | 11730 |
| |
| |
| 特性 | |
| 化学式 | CH3NO2 |
| モル質量 | 61.04 g mol−1 |
| 融点 |
-16 °C, 257 K, 3 °F |
| 沸点 |
-12 °C, 261 K, 10 °F |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
亜硝酸メチル(あしょうさんメチル 英: Methyl nitrite)は、化学式 CH3ONO の有機化合物である。亜硝酸アルキルとして最も単純なもので、常温で気体である。
構造
[編集]室温では、亜硝酸メチルはシス配座とトランス配座との混合物として存在する。シス体はトランス体に比べて 3.13 kJ⋅mol−1 安定で、回転障壁は 45.3 kJ⋅mol−1 である[1]。シス体とトランス体はマイクロ波スペクトルにより判別可能である(外部リンク参照)。
IRおよびマイクロ波スペクトルから決定された二つの亜硝酸メチルの気相構造を図に示す。
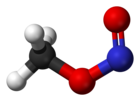 |
 |
合成
[編集]亜硝酸メチルは亜硝酸銀とヨードメタンを反応させて得ることができる。亜硝酸銀 (AgNO2) は、溶液中では銀イオン Ag+ と亜硝酸イオン NO2− に電離している。亜硝酸イオンの酸素原子の孤立電子対がメチル基 (—CH3) を攻撃し、ヨウ化物イオンが解離する[2]。亜硝酸銀とは異なり、ヨウ化銀は水にほとんど不溶であるため、析出する[3]。窒素は酸素よりも求核性が強いため、ほとんどの亜硝酸塩は SN2 的機構で反応し、主生成物はニトロメタンとなる。例えば、亜硝酸ナトリウムおよび亜硝酸カリウムがヨードメタンと反応するとほとんどはニトロメタンを生じ、亜硝酸メチルは副生成物となる。しかし、溶液中に銀イオンが存在することによりカルボカチオン中間体が安定化され、亜硝酸メチルの収率が向上する。どちらにせよ、いくらかのニトロメタンと亜硝酸メチルが両方生じる[2]。
環境負荷
[編集]この化合物は無鉛ガソリンの燃焼によって生じ、ヨーロッパにおいて昆虫、さらに結果としてイエスズメやその他のスズメ類の減少原因になっている可能性がある[4]。
関連項目
[編集]出典
[編集]- ^ B.J. Van der Veken; R. Maas; G.A. Guirgis; H.D. Stidham; T.G. Sheehan; J.R. Durig (1990). “Infrared spectrum, ab initio calculations, barriers to internal rotation and structural parameters for methyl nitrite”. Journal of Physical Chemistry 94 (10): 4029–39. doi:10.1021/j100373a028.
- ^ a b Donald L. Pavia; Gary M. Lampman; George S. Kriz (2004). Organic Chemistry. 2. Mason, Ohio: Thompson Custom Publishing. ISBN 0-03-014813-8. OCLC 236055357
- ^ Darrell D. Ebbing; Steven D. Gammon (2005). General Chemistry (8th ed.). Boston: Houghton Mifflin. ISBN 978-0-618-39941-3
- ^ Summers-Smith, J. Denis (September 2007). “Is unleaded petrol a factor in urban House Sparrow decline?”. British Birds 100: 558. ISSN 0007-0335.

