原子間力顕微鏡


原子間力顕微鏡(げんしかんりょくけんびきょう、英: atomic force microscope、 AFM)[1]は、走査型プローブ顕微鏡(SPM)の一種であり、試料の表面と探針の原子間にはたらく力を検出して画像を得る顕微鏡である。
原子間力はあらゆる物質の間に働くため容易に試料を観察することができる[要出典]ため、走査型トンネル顕微鏡 (STM) とは異なり、絶縁性試料の測定も可能である。また電子線を利用する走査型電子顕微鏡 (SEM) のように、導電性コーティングなどの前処理や装置内の真空を必要とする事もない。このため、大気中や液体中、または高温~低温など様々な環境で、生体試料などを自然に近い状態で測定できる。
他の走査型プローブ顕微鏡と同様に空間分解能は探針の先端半径(nm程度)に依存し、現在では、原子レベルの分解能が実現されている。
測定原理
[編集]
カンチレバー(片持ち梁)の先端に取り付けた鋭い探針を用いて、試料表面をなぞる、または試料表面と一定の間隔を保って試料表面を走査し、その時のカンチレバーの上下方向への変位を計測することにより、試料表面の凹凸形状の評価を行う。AFMには様々な測定方法があり、以下に代表的な例を挙げる。
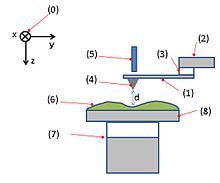
コンタクトモード(Contact Mode)
[編集]カンチレバー先端の平板部分に当てたレーザーの反射光を、4ないし2分割のフォトダイオードの中心で測定する。探針が試料表面に近づくと、探針と試料表面原子との原子間力によりカンチレバー(探針)が試料表面に引き寄せられ、変形して接触(コンタクト)する。この変形のために反射光の角度が変わり、フォトダイオードの上下の領域の光起電力に差が生じる。この起電力の差がなくなる(=探針の変位を一定にする)ようにカンチレバーもしくは試料を上下させながら、試料をなぞるようにスキャンする(零位法)。このときの制御信号が試料の表面状態(凹凸の様子)として観察される。
カンチレバーおよび試料の位置変更は、圧電アクチュエータの圧電効果による変形を利用して制御している(観察する領域のサイズは数nm~数十µm程度であり、このスケールで移動を精密に制御する必要があるため。)。測定が容易だが、接触時に働く強い力や摩擦のためにやわらかい試料を損傷する場合がある。
ノンコンタクトモード(Non-contact Mode)
[編集]圧電素子によってカンチレバーを上下に振動させながら試料表面のごく近傍(数ナノメートル程度)まで近づけ、両者の間に働く原子間相互作用による力を検出し、一定の力(=距離)を保ってスキャンする。探針と試料の間の距離に応じて振動の振幅、位相、周波数が変化するので、これらが一定になるようにカンチレバーもしくは試料を上下させながら測定を行なう。
探針を接触させずに測定を行なうため、試料を傷つける心配がない。また光てこ方式よりも単純なので真空での測定にも適しており、ヤング率の高い(=硬い)プローブを用いることで非常に高い空間分解能を実現できる。2000年にGiessiblらはこの方式を用い、初めてAFMによるサブ原子レベルでのSi(111)表面における(7×7)構造の観察に成功した。
タッピングモード(Tapping Mode)
[編集]インターミッテントコンタクトモード、あるいはDFM (dynamic force microscope) とも呼ばれる。Tapping Modeは米国Bruker社の登録商標である。
ノンコンタクトモード同様に振動させた探針が試料表面を跳ねるように上下に動き、表面状態を測定する。生体試料や、表面に物質が弱く吸着されている場合などの破壊されやすい試料に対しても使え、分解能も高く精密な測定が必要な際によく使われる手法である。液中でも使用できる。一般的に液中と空気中におけるタッピングモードでは使用されるプローブの材質が異なる。
フォースモード(Force Mode)
[編集]プローブを試料に接触させ、その際に生じるカンチレバーのしなりをモニターし、カンチレバーにかかる力を測定する。細胞膜タンパク質の検出や細胞の粘弾性力の測定などに用いられている[2]。また、生体分子などを引っ張ることにより発生する力の変化から分子内構造(ドメイン)などの解析や、試料にプローブ先端で穴をあけ(インデンテーション)、剛性などを検査することも可能である。このモードでは一般的に表面形状などの分布は測定されない。
歴史
[編集]走査型トンネル顕微鏡 (STM) を1981年に開発した功績でノーベル物理学賞(1986年)を受賞したIBMのチューリッヒ研究所のゲルト・ビーニッヒ (Gerd Binnig) は、トンネル効果が生じるような非常に近い距離では探針と試料の間に有意な力が働くことを発見した。この力を利用する事により、STM では不可能な絶縁体の測定を実現しようとビーニッヒは考え、同研究所で1985年に AFM を開発した。
最初の AFM は金ホイルを貼ったダイヤモンド製カンチレバーの背面にSTMの探針を設置し、そのトンネル電流によってカンチレバーの変位を測定する非常に高価で複雑なものであった。その後、カンチレバーとしてSiなどが用いられるようになり、光てこなどの方式で変位を検出できるようになり、AFM システムは安価になった。
また当初は原子間力を利用して表面像を取得するのみであったが、現在では磁性や導電性を有するカンチレバーを用いることによって、表面形状像と同時に、磁気像を観察できる磁気力顕微鏡 (MFM) や、電気力(電気勾配力)を観察できる電気力顕微鏡 (EFM) という装置もある。最近ではこの他にも、AFM と蛍光顕微鏡、共焦点レーザー顕微鏡(英: confocal laser scanning microscope)、全反射(英: total internal reflection: TIRF)蛍光顕微鏡、ラマン分光法などを組み合わせた様々なハイブリッド AFM が使用されている。
応用分野
[編集]2013年5月30日、カリフォルニア大学バークレー校のチームが、最先端の原子間力顕微鏡を用いて、化学反応前後の分子構造を直接撮影することに成功したとする論文が、学術誌サイエンス(オンライン)に掲載された[3][4]。
課題
[編集]AFM を含むプローブ顕微鏡における問題は、解像度および出力される構造データがプローブのサイズと形状に左右されることであり、測定者はこの事実とそのメカニズムを理解しておかなければならない。この問題は、対象となる試料がプローブの先端径に近いような生体分子や、微粒子などを測定する場合に顕著となる。このような場合、測定データは実際の試料より大きく出力される。この問題を軽減するため、これまでカーボンナノチューブなどをプローブ先端に取り付けるなどの改良が行なわれた。
このほか AFM 測定で解決されなければならない課題は、測定(観察)時間の短縮である。光学顕微鏡や電子顕微鏡では観察できない液体中に浸した生物試料をナノメータオーダで高分解能観察できる装置として期待があるが、この用途の AFM では、従来の AFM では数分から数十分/画面かかった生体試料の観察を 0.1 秒/画面で実現したという研究報告がある。分子生物研究分野では蛍光染色せずに画像化できる点が早い測定速度や高解像力とならんで評価されている。一方、大気中、真空中の測定では早い装置で 10 秒/画面程度まで測定時間が短縮されたが、更なる改良が望まれている。なお、測定時間を律速する主な要因は試料ステージの移動速度であり、正確な移動量の確保と高速化は背反している。
AFM では、表面の形状は観察できるものの、その原子・分子の種類を区別することができないため、全く無関係な不純物を観察してしまうことがある。近年では、元素に特有の力学的な特徴を利用することで、AFM だけから原子の種類を同定し、分布状態を可視化する手法も検討されている[5]。
参考文献
[編集]- ^ G. Binnig, C. F. Quate, & Ch. Gerber, "Atomic Force Microscope", Phys. Rev. Lett. 56, 930–933 (1986)doi:10.1103/PhysRevLett.56.930
- ^ Musashi T., Yusuke M., J. Ishii, Chiaki O., and Akihiko K., "The mapping of yeast's G-protein coupled receptor with an atomic force microscope", Nanoscale. 2015, 7, 4956-1963. (doi: 10.1039/C4NR05940A)
- ^ Robert Sanders (2013-05-30). Scientists capture first images of molecules before and after reaction. UC Barkeley News Center.
- ^ Dimas G. de Oteyza, Patrick Gorman, Yen-Chia Chen, Sebastian Wickenburg, Alexander Riss, Duncan J. Mowbray, Grisha Etkin, Zahra Pedramrazi, Hsin-Zon Tsai, Angel Rubio, Michael F. Crommie, Felix R. Fischer (May 30 2013). “Direct Imaging of Covalent Bond Structure in Single-Molecule Chemical Reactions”. Science. doi:10.1126/science.1238187.
- ^ Yoshiaki Sugimoto, Pablo Pou, Masayuki Abe, Pavel Jelinek, Rubén Pérez, Seizo Morita & Óscar Custance, "Chemical identification of individual surface atoms by atomic force microscopy", Nature 446, 64-67 (2007) doi:10.1038/nature05530
