中和抗体
 標準的な抗体の図示。 | |
| 特徴 | |
|---|---|
| Protein Type | 免疫グロブリン |
| Function | 抗原の中和 |
| Production | B細胞[1][2] |
中和抗体(ちゅうわこうたい、英: neutralizing antibody, NAb)は、病原体や感染性粒子が細胞に対して及ぼす生物学的な影響を中和して、細胞を防御する抗体である。中和によって病原体や感染性粒子は感染性や病原性を失う[3]。中和抗体は、ウイルス、細胞内細菌、微生物毒素に対する適応免疫系の体液性応答の一部である。中和抗体は、感染性粒子の表面構造(抗原)に特異的に結合することで、宿主細胞が感染して破壊する可能性のある相互作用を防ぐ。中和抗体による免疫は、感染が起こる前に免疫系が感染粒子を排除するため、殺菌免疫(英: sterilizing immunity)としても知られている[4]。
機構
[編集]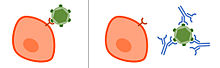
ウイルス粒子や細胞内細菌は、細胞内に侵入するために、それ自身の表面にある分子を利用して標的細胞の細胞表面受容体と相互作用し、細胞内に侵入して複製サイクルを開始する[5]。中和抗体は、病原体と結合して感染性を阻害し、細胞内への侵入に必要な分子を遮断できる。これは、病原体や毒素が宿主細胞の受容体に付着することに対して、抗体が静的に干渉することに起因する。ウイルス感染の場合、中和抗体(NAb)は、エンベロープ型ウイルスの糖タンパク質または非エンベロープ型ウイルスのカプシドタンパク質に結合することができる。さらに、中和抗体は、粒子が細胞内への侵入を成功させるためにしばしば必要とされる構造変化を防ぐように作用することができる。たとえば、中和抗体は、宿主細胞への侵入に必要な膜融合を媒介するウイルスタンパク質の構造変化を防ぐことができる。場合によっては、抗体が解離した後でもウイルスは感染できないことがある。病原体-抗体複合体は、最終的にはマクロファージに取り込まれ、分解される[6]。
中和抗体は、細菌毒素の毒性作用を中和する上でも重要である。中和抗体の例としてはジフテリア抗毒素があり、これはジフテリア毒素の生物学的効果を中和することができる[7]。抗体が結合しても細菌の複製を妨げないため、中和抗体は細胞外細菌に対しては有効ではない。ここで、免疫系は、オプソニン化や補体活性化など、抗体の他の機能を利用して細菌を殺す[8]。
中和抗体と結合抗体の違い
[編集]病原性粒子に結合するすべての抗体が中和抗体であるわけではない。非中和性抗体(すなわち結合抗体)は、病原体に特異的に結合するが、病原体の感染性を妨げることはない。これは、適切な領域に結合しないことが原因となる可能性がある。非中和抗体は、粒子にフラグを立て、それが標的化されたことを免疫細胞に対して知らせるため重要な役割を果たす。その後、粒子は処理されて、その結果、動員された免疫細胞によって破壊される[9]。一方、中和抗体は、免疫細胞を必要とせずに抗原の生物学的効果を中和することができる。場合によっては、ウイルス粒子に結合している非中和抗体または不十分な量の中和抗体が、宿主細胞への取り込みを容易にするために、いくつかのウイルス種によって利用されることがある。この機構は、抗体依存性感染増強として知られている[10]。これはデングウイルスやジカウイルスで観察されている[11]。
産生
[編集]抗体はB細胞によって産生および分泌される。B細胞が骨髄で産生されると、抗体をコードする遺伝子がランダムな遺伝的組み換え(V(D)J遺伝子再構成)を受け、その結果、すべての成熟B細胞が抗原結合領域のアミノ酸配列が異なる抗体を産生する。したがって、すべてのB細胞は、異なる抗原に特異的に結合する抗体を産生する[12]。抗体レパートリーに強い多様性があることで、免疫系はさまざまな形態や大きさの病原体を認識することができる。感染時には、病原性抗原に高い親和性で結合する抗体のみが産生される。これは、単一のB細胞クローンのクローン選択によって実現される。B細胞は、自然免疫応答の一部として感染細胞から放出されるインターフェロンを感知して感染部位に動員される。B細胞は、細胞膜に固定された抗体にすぎないB細胞受容体を細胞表面に呈示する。B細胞受容体が高親和性の同種抗原と結合すると、細胞内シグナル伝達カスケードが誘発される。抗原への結合に加えて、病原体に対する免疫系の細胞応答の一部として、B細胞はヘルパーT細胞によって産生されるサイトカインにより刺激されることも必要である。B細胞が完全に活性化されると、B細胞は急速に増殖して形質細胞に分化する。その後、形質細胞は抗原特異的抗体を大量に分泌する[13]。ワクチン接種や自然感染によって抗原に最初に遭遇した後、免疫学的記憶により、ウイルスへの次の曝露の後に中和抗体をより迅速に産生することが可能になる。
ウイルスの中和抗体回避
[編集]ウイルスはさまざまな機構を使って中和抗体を回避する[14]。ウイルスのゲノムは高率で変異する。ウイルスが中和抗体を回避することを可能にする変異が選択され、それにより優勢になる。逆に、抗体は免疫応答の過程で親和性成熟によって同時に進化し、それによってウイルス粒子の認識を向上させる。ウイルス機能において中心的な役割を果たすウイルスタンパク質の保存された部分は、時間の経過とともに進化する可能性が低く、したがって抗体結合に対してより脆弱である。しかし、ウイルスはこれらの領域に抗体が立体的にアクセスするための特定の機構を進化させており、結合を困難にしている。表面構造タンパク質の密度が低いウイルスは、抗体が結合しにくい。一部のウイルス糖タンパク質は、N-およびO-結合型グリカンによって高度にグリコシル化され、いわゆるグリカンシールドが形成される。これにより、抗体結合親和性を低下させ、中和抗体の回避が促進される可能性がある。ヒトエイズの原因であるHIV-1は、この両方の機構を利用している[15][16]。
中和抗体の医学的使用
[編集]中和抗体は受動免疫に用いられ、健康な免疫系を持っていなくても患者へ使用することができる。20世紀初頭は、感染した患者に抗血清を注射していた。抗血清は、感染病原体に対するポリクローナル抗体を含む、以前に感染して回復した患者の血清である。これにより、抗体がウイルス感染症や毒素に対する効果的な治療法として利用できることを示している[17]。血漿中の抗体は精製も標準化もされておらず、血漿はドナーによって拒絶される可能性があるため、抗血清は非常に粗雑な治療法である[18]。また、回復した患者からの提供に依存しているため、簡単にスケールアップすることはできない。しかし、血清療法は比較的迅速に入手できるため、今日でも発生時の最初の防衛線として使用されている[19][20]。血清療法は、2009年の豚インフルエンザ世界的流行[21]や、西アフリカエボラ出血熱流行[22]の時に、患者の死亡率を減少させることが示された。また、COVID-19の見込みのある治療法として試験が行われている[23][24]。健康な人から得られた抗体の混合物を使用する免疫グロブリン療法は、感染症と戦うために免疫不全または免疫抑制された患者に投与される。
より特異的で堅牢な治療には、精製されたポリクローナル抗体またはモノクローナル抗体(mAb)を使用できる。ポリクローナル抗体は、同じ病原体を標的とするが、異なるエピトープに結合する抗体の集まりである。ポリクローナル抗体は、抗原に曝露されたヒトのドナーまたは動物から得られる。動物ドナーに注入された抗原は、なるべく中和抗体を産生するように設計される[25]。ポリクローナル抗体は、サイトメガロウイルス(CMV)、B型肝炎ウイルス(HBV)、狂犬病ウイルス、麻疹ウイルス、呼吸器合胞体ウイルス(RSV)の治療薬として使用されてきた[18]。ジフテリア抗毒素には、ジフテリア毒素に対するポリクローナル抗体が含まれている[26]。複数のエピトープを結合した抗体で治療することで、ウイルスが変異してエピトープのいずれかが構造が変化させた場合でも治療効果を発揮する。しかし、ポリクローナル抗体を用いた治療は、生産の都合上、バッチごとのばらつきと抗体価が低いという問題がある。一方、モノクローナル抗体は、すべて同じエピトープに高い特異性で結合する。これらの抗体は、mAbの大量生産を可能にするハイブリドーマ技術で生産することができる[17]。感染症に対するmAbは、ウイルスがmAbの標的となるエピトープを変異させるか、複数の株が流通している場合には機能を停止する。モノクローナル抗体を使用する薬剤の例としては、エボラに対するZMapp[27]、RSVに対するパリビズマブなどがある[28]。他の感染症に対する多くのmAbが臨床試験中である。
中和抗体は、ワクチン接種による能動免疫においても役割を果たしている。自然免疫応答における中和抗体の結合部位と構造を理解することで、結合抗体ではなく中和抗体を産生するよう免疫系を刺激するように、ワクチンを合理的に設計することができる[29][30]。ワクチン接種によって弱体化したウイルスを導入すると、B細胞による中和抗体の産生が可能になる。2回目の暴露後は、ウイルスに特異的な抗体を産生するメモリーB細胞が存在することで、中和抗体反応はより迅速になる。効果的なワクチンは、ウイルスの変異体の大部分を中和することができる抗体の産生を誘導するが、抗体回避をもたらすウイルスの突然変異には、それに応じてワクチンを更新する必要性がある[31]。一部のウイルスは他のウイルスよりも早く進化するため、それに応じてワクチンを更新する必要がある。よく知られている例として、インフルエンザウイルスのワクチンがある。これは、ウイルスの最近の循環株を考慮して毎年更新しなければならない[14]。
中和抗体は、多発性硬化症の治療にも役立つことがある[2]。このタイプの抗体は、レトロウイルス感染症と戦う能力があるが、場合によっては、多発性硬化症を治療するために体内に投与された医薬品を攻撃する。組換えタンパク質製剤、特に動物由来の医薬品は、一般的に中和抗体によって標的となる。例として、レビフ(Rebif)、ベタセロン(Betaseron)、アボネックス(Avonex)などが挙げられる。
中和抗体の検出および定量化のための方法
[編集]中和アッセイ(試験)は、プラーク減少(対照ウェル内のウイルスプラーク数と接種培養物の数を比較する)、マイクロ中和(少量の血清で満たされたマイクロタイタープレートで行う)、および比色アッセイ(ウイルスの代謝阻害を示すバイオマーカーに依存する) [32]などの技術の使用を含めて、さまざまな方法で実施および測定することができる。
広域中和抗体
[編集]免疫系が産生する中和抗体の多くは、B細胞による親和性成熟のために、単一のウイルス株に対して非常に特異的である[13]。HIVのような遺伝的変動性の高い病原体の中には、古い株に対する高い特異性を持つ中和抗体が新しいウイルス株に結合できなくなるように、表面構造を常に変化させているものがある。このような免疫回避戦略は、免疫系が病原体に対する免疫学的記憶を発達させることを妨げる[33]。一方、広域中和抗体(bNAb)は、ウイルス種の複数の株に結合して中和する特別な能力を持っている[34]。
bNAbは当初、HIV患者で発見された[35]。しかし、bNAbは非常に稀な存在である。in situ(生物個体内)スクリーニング研究では、HIVに対してbNAbを発症する患者は全患者のわずか1%であることが示された[36]。bNAbは、ウイルス表面タンパク質(ウイルス複製に機能的に不可欠であるために変異できない)の保存領域に結合することで、広範囲のウイルス株を中和することができる。HIVに対するbNAbのほとんどの結合部位は、HIVの露出した表面抗原であるエンベロープ(Env)タンパク質(gp120およびgp41サブユニットからなる三量体)上にある。これらの部位には、CD4結合部位またはgp41-gp120界面が含まれる[37]。ロスアラモス国立研究所のHIVデータベースは、HIVシーケンス、bNAbなどに関する豊富な情報を持つ包括的なリソースである[38]。
さらに、bNAbは、インフルエンザ[39]、C型肝炎[40]、デング熱[41]、ウエストナイルウイルス[42]などの他のウイルスにも発見されている。
研究
[編集]HIV-1に対するbNAbを同定して試験するための予備研究が行われている[43]。bNAbは、bNAbの産生を刺激しウイルスに対する免疫力を高めるための合理的設計によるワクチン研究で使用される。動物モデルやヒトでbNAb産生を誘発する抗原は知られていない[34]。
脚注
[編集]- ^ Mike Recher; Karl S Lang; Lukas Hunziker; Stefan Freigang; Bruno Eschli; Nicola L Harris; Alexander Navarini; Beatrice M Senn et al. (8 August 2004). “Deliberate removal of T cell help improves virus-neutralizing antibody production”. Nature Immunology 5 (9): 934–942. doi:10.1038/ni1102. PMID 15300247.
- ^ a b Stachowiak (15 August 2008). “Neutralizing Antibodies and Disease-Modifying Therapies for Multiple Sclerosis”. About.com. 13 June 2009閲覧。
- ^ “Neutralising antibody”. Biology-Online (2008年). 2009年7月4日閲覧。
- ^ Dutta, A; Huang, CT; Lin, CY; Chen, TC; Lin, YC; Chang, CS; He, YC (6 September 2016). “Sterilizing immunity to influenza virus infection requires local antigen-specific T cell response in the lungs.”. Scientific Reports 6: 32973. Bibcode: 2016NatSR...632973D. doi:10.1038/srep32973. PMC 5011745. PMID 27596047.
- ^ Principles of Virology, Volume 1: Molecular Biology (4th ed.). ASM Press. (2015). p. 31. ISBN 978-1555819330
- ^ Principles of Virology, Volume 2: Pathogenesis and Control (4th ed.). ASM Press. (2015). p. 125. ISBN 978-1-555-81951-4
- ^ Treffers, Henry P. (2014). “Neutralizing antibody”. AccessScience (McGraw-Hill). doi:10.1036/1097-8542.450600.
- ^ Janeway's immunobiology (8th ed.). Garland Science. (2012). p. 388. ISBN 978-0-8153-4243-4
- ^ Schmaljohn, AL (July 2013). “Protective antiviral antibodies that lack neutralizing activity: precedents and evolution of concepts.”. Current HIV Research 11 (5): 345–53. doi:10.2174/1570162x113116660057. PMID 24191933.
- ^ Tirado, SM; Yoon, KJ (2003). “Antibody-dependent enhancement of virus infection and disease.”. Viral Immunology 16 (1): 69–86. doi:10.1089/088282403763635465. PMID 12725690.
- ^ Dejnirattisai, Wanwisa; Supasa, Piyada; Wongwiwat, Wiyada; Rouvinski, Alexander; Barba-Spaeth, Giovanna; Duangchinda, Thaneeya; Sakuntabhai, Anavaj; Cao-Lormeau, Van-Mai et al. (23 June 2016). “Dengue virus sero-cross-reactivity drives antibody-dependent enhancement of infection with zika virus”. Nature Immunology 17 (9): 1102–1108. doi:10.1038/ni.3515. PMC 4994874. PMID 27339099.
- ^ Jung, David; Alt, Frederick W (January 2004). “Unraveling V(D)J Recombination”. Cell 116 (2): 299–311. doi:10.1016/S0092-8674(04)00039-X. PMID 14744439.
- ^ a b Janeway's immunobiology (8th ed.). Garland Science. (2012). pp. 389–404. ISBN 978-0-8153-4243-4
- ^ a b VanBlargan, Laura A.; Goo, Leslie; Pierson, Theodore C. (2016). “Deconstructing the Antiviral Neutralizing-Antibody Response: Implications for Vaccine Development and Immunity” (英語). Microbiology and Molecular Biology Reviews 80 (4): 989–1010. doi:10.1128/MMBR.00024-15. ISSN 1092-2172. PMC 5116878. PMID 27784796.
- ^ Crispin, Max; Ward, Andrew B.; Wilson, Ian A. (2018-05-20). “Structure and Immune Recognition of the HIV Glycan Shield” (英語). Annual Review of Biophysics 47 (1): 499–523. doi:10.1146/annurev-biophys-060414-034156. ISSN 1936-122X. PMC 6163090. PMID 29595997.
- ^ Guha, Debjani; Ayyavoo, Velpandi (2013). “Innate Immune Evasion Strategies by Human Immunodeficiency Virus Type 1” (英語). ISRN AIDS 2013: 954806. doi:10.1155/2013/954806. ISSN 2090-939X. PMC 3767209. PMID 24052891.
- ^ a b Salazar, Georgina; Zhang, Ningyan; Fu, Tong-Ming; An, Zhiqiang (10 July 2017). “Antibody therapies for the prevention and treatment of viral infections”. NPJ Vaccines 2 (1): 19. doi:10.1038/s41541-017-0019-3. PMC 5627241. PMID 29263875.
- ^ a b Casadevall, A; Dadachova, E; Pirofski, LA (September 2004). “Passive antibody therapy for infectious diseases.”. Nature Reviews. Microbiology 2 (9): 695–703. doi:10.1038/nrmicro974. PMID 15372080.
- ^ Kreil, Thomas R. (March 2015). “Treatment of Ebola Virus Infection with Antibodies from Reconvalescent Donors”. Emerging Infectious Diseases 21 (3): 521–523. doi:10.3201/eid2103.141838. PMID 25695274.
- ^ Schmidt, Rebecca; Beltzig, Lea C.; Sawatsky, Bevan; Dolnik, Olga; Dietzel, Erik; Krähling, Verena; Volz, Asisa; Sutter, Gerd et al. (5 October 2018). “Generation of therapeutic antisera for emerging viral infections”. NPJ Vaccines 3 (1). doi:10.1038/s41541-018-0082-4. PMID 30323953.
- ^ Hung, I. F.; To, K. K.; Lee, C.-K.; Lee, K.-L.; Chan, K.; Yan, W.-W.; Liu, R.; Watt, C.-L. et al. (19 January 2011). “Convalescent Plasma Treatment Reduced Mortality in Patients With Severe Pandemic Influenza A (H1N1) 2009 Virus Infection”. Clinical Infectious Diseases 52 (4): 447–456. doi:10.1093/cid/ciq106. PMID 21248066.
- ^ World Health Organization. “WHO | Use of convalescent whole blood or plasma collected from patients recovered from Ebola virus disease”. WHO. 5 April 2020閲覧。
- ^ Shen, Chenguang; Wang, Zhaoqin; Zhao, Fang; Yang, Yang; Li, Jinxiu; Yuan, Jing; Wang, Fuxiang; Li, Delin et al. (27 March 2020). “Treatment of 5 Critically Ill Patients With COVID-19 With Convalescent Plasma”. JAMA 323 (16): 1582. doi:10.1001/jama.2020.4783. PMC 7101507. PMID 32219428.
- ^ Casadevall, Arturo; Pirofski, Liise-anne (13 March 2020). “The convalescent sera option for containing COVID-19”. Journal of Clinical Investigation 130 (4): 1545–1548. doi:10.1172/JCI138003. PMID 32167489.
- ^ Bregenholt, S; Jensen, A; Lantto, J; Hyldig, S; Haurum, JS (2006). “Recombinant human polyclonal antibodies: A new class of therapeutic antibodies against viral infections.”. Current Pharmaceutical Design 12 (16): 2007–15. doi:10.2174/138161206777442173. PMID 16787244.
- ^ “Our Formulary”. Infectious Diseases Laboratories. Centers for Disease Control and Prevention. 16 December 2016時点のオリジナルよりアーカイブ。9 December 2016閲覧。
- ^ “A Randomized, Controlled Trial of ZMapp for Ebola Virus Infection”. New England Journal of Medicine 375 (15): 1448–1456. (13 October 2016). doi:10.1056/NEJMoa1604330. PMC 5086427. PMID 27732819.
- ^ “Label - Palivizumab (Synagis), Medimmune, Incorporated”. 2020年2月4日閲覧。
- ^ VanBlargan, Laura A.; Goo, Leslie; Pierson, Theodore C. (26 October 2016). “Deconstructing the Antiviral Neutralizing-Antibody Response: Implications for Vaccine Development and Immunity”. Microbiology and Molecular Biology Reviews 80 (4): 989–1010. doi:10.1128/MMBR.00024-15. PMID 27784796.
- ^ Kwong, P. D.; Mascola, J. R.; Nabel, G. J. (1 September 2011). “Rational Design of Vaccines to Elicit Broadly Neutralizing Antibodies to HIV-1”. Cold Spring Harbor Perspectives in Medicine 1 (1): a007278. doi:10.1101/cshperspect.a007278. PMID 22229123.
- ^ Burton, Dennis R. (2002). “Antibodies, viruses and vaccines” (英語). Nature Reviews Immunology 2 (9): 706–713. doi:10.1038/nri891. ISSN 1474-1733. PMID 12209139.
- ^ Kaslow, R. A., ed (2014). Viral Infections of Humans: Epidemiology and Control (5th ed.). Springer. p. 56. ISBN 9781489974488 4 April 2020閲覧。
- ^ Santoro, MM; Perno, CF (2013). “HIV-1 Genetic Variability and Clinical Implications.”. ISRN Microbiology 2013: 481314. doi:10.1155/2013/481314. PMC 3703378. PMID 23844315.
- ^ a b Kumar, R; Qureshi, H; Deshpande, S; Bhattacharya, J (August 2018). “Broadly neutralizing antibodies in HIV-1 treatment and prevention.”. Therapeutic Advances in Vaccines and Immunotherapy 6 (4): 61–68. doi:10.1177/2515135518800689. PMC 6187420. PMID 30345419.
- ^ Cohen, J. (2013). “Bound for Glory”. Science 341 (6151): 1168–1171. Bibcode: 2013Sci...341.1168C. doi:10.1126/science.341.6151.1168. PMID 24030996.
- ^ Simek, MD; Rida, W; Priddy, FH; Pung, P; Carrow, E; Laufer, DS; Lehrman, JK; Boaz, M et al. (July 2009). “Human immunodeficiency virus type 1 elite neutralizers: individuals with broad and potent neutralizing activity identified by using a high-throughput neutralization assay together with an analytical selection algorithm.”. Journal of Virology 83 (14): 7337–48. doi:10.1128/JVI.00110-09. PMC 2704778. PMID 19439467.
- ^ Haynes, Barton F.; Burton, Dennis R.; Mascola, John R. (30 October 2019). “Multiple roles for HIV broadly neutralizing antibodies”. Science Translational Medicine 11 (516): eaaz2686. doi:10.1126/scitranslmed.aaz2686. PMC 7171597. PMID 31666399.
- ^ “HIV Databases”. Los Alamos National Laboratory. 2021年1月12日閲覧。
- ^ Corti, D; Cameroni, E; Guarino, B; Kallewaard, NL; Zhu, Q; Lanzavecchia, A (June 2017). “Tackling influenza with broadly neutralizing antibodies.”. Current Opinion in Virology 24: 60–69. doi:10.1016/j.coviro.2017.03.002. PMC 7102826. PMID 28527859.
- ^ Colbert, MD; Flyak, AI; Ogega, CO; Kinchen, VJ; Massaccesi, G; Hernandez, M; Davidson, E; Doranz, BJ et al. (15 July 2019). “Broadly Neutralizing Antibodies Targeting New Sites of Vulnerability in Hepatitis C Virus E1E2.”. Journal of Virology 93 (14). doi:10.1128/JVI.02070-18. PMC 6600205. PMID 31068427.
- ^ Durham, ND; Agrawal, A; Waltari, E; Croote, D; Zanini, F; Fouch, M; Davidson, E; Smith, O et al. (10 December 2019). “Broadly neutralizing human antibodies against dengue virus identified by single B cell transcriptomics.”. eLife 8. doi:10.7554/eLife.52384. PMC 6927745. PMID 31820734.
- ^ Goo, L; Debbink, K; Kose, N; Sapparapu, G; Doyle, MP; Wessel, AW; Richner, JM; Burgomaster, KE et al. (January 2019). “A protective human monoclonal antibody targeting the West Nile virus E protein preferentially recognizes mature virions.”. Nature Microbiology 4 (1): 71–77. doi:10.1038/s41564-018-0283-7. PMC 6435290. PMID 30455471.
- ^ Bhiman, Jinal N.; Lynch, Rebecca M. (2017-03-27). “Broadly neutralizing antibodies as treatment: effects on virus and immune system”. Current HIV/AIDS Reports 14 (2): 54–62. doi:10.1007/s11904-017-0352-1. ISSN 1548-3568. PMC 5401706. PMID 28349376.
