「赤血球」の版間の差分
m [r2.5.2] ロボットによる 変更: la:Erythrocytus |
参照を少しカイゼンしました |
||
| (100人を超える利用者による、間の316版が非表示) | |||
| 1行目: | 1行目: | ||
[[File:Reactive lymph.JPG|thumb|280px|血液の光学顕微鏡写真、多数あり丸く赤く写っているのが赤血球。中央に1つある細胞は白血球、赤血球の間にところどころ見える小さく青みがかかった小粒のものが血小板である]] |
|||
[[画像:Red White Blood cells.jpg|thumb|200px|左から赤血球、[[血小板]]、[[白血球]]]] |
|||
[[ファイル:Red White Blood cells.jpg|thumb|200px|各血球、左から赤血球、[[血小板]]、[[白血球]](白血球の中で種類としては小型[[リンパ球]])色は実際の色ではなく画像処理によるもの]] |
|||
'''赤血球'''(せっけっきゅう、''red blood cell''、''erythrocyte'')は、[[動物]]の[[血液]]に含まれる[[細胞]]成分の一種。 |
|||
'''赤血球'''(せっけっきゅう、{{Lang-en-short|Red blood cell}}・{{Lang|en|Erythrocyte}})は、[[血球|血液細胞]]の1種であり、[[酸素]]を運ぶ役割を持つ。本項目では特に断りのない限り、[[ヒト]]の赤血球について解説する。{{For2|ヒト以外の赤血球|#ヒト以外の赤血球}} |
|||
[[骨髄]]中に存在する[[造血幹細胞]]由来の細胞である。細胞内に[[ヘモグロビン]]を有することで[[酸素]]と結合し、血流に乗って酸素を体中の組織に運搬する。なお、[[二酸化炭素]]も運搬できるが、酸素と違いほとんどの二酸化炭素は[[血漿]]に溶けて運搬される。 |
|||
[[ファイル:Illu_blood_cell_lineage.jpg|thumb|480px|'''[[造血幹細胞]]とその細胞系譜'''、[[:en:Hemocytoblast]]=[[造血幹細胞]]、[[:en:Proerythroblast]]=[[前赤芽球]]、[[:en:Polychromatophilic erythrocyte]]=[[赤芽球]]、[[:en:Erythrocyte]]=[[赤血球]]、[[:en:Myeloblast]]=[[芽球]]、[[:en:Progranulocyte]]=[[前骨髄球]]、[[:en:Basophil granulocyte]]=[[好塩基球]]、[[:en:Eosinophil granulocyte]]=[[好酸球]]、[[:en:Neutrophil granulocyte]]=[[好中球]]、[[:en:Granulocyte]]=[[顆粒球]]、[[:en:Lymphoblast]]=[[リンパ芽球]]、[[:en:Lymphocyte]]=[[リンパ球]]、[[:en:Monoblast]]=[[単芽球]]、[[:en:Monocyte]]=[[単球]]、[[:en:Agranulocyte]]=[[無顆粒白血球]]、[[:en:Leukocyte]]=[[白血球]]、[[:en:Megakaryoblast]]=[[巨核芽球]]、[[:en:Megakaryocyte]]=[[巨核球]]、[[:en:Platelet]]=[[血小板]]]] |
|||
== 概要 == |
== 概要 == |
||
赤血球は[[血球|血液細胞]]の一つで色は赤く<ref group="注">[[血液]]の55%程度を占める[[血漿]]はやや黄色を帯びてはいるがほとんど透明であり、血液の色は主に45%程度を占める赤血球の色である。</ref>[[循環器|血液循環]]によって体中を回り、[[肺]]から得た[[酸素]]を取り込み、体の隅々の[[細胞]]に運び供給する役割を担い、また同様に[[二酸化炭素]]の排出も行う。赤血球の内部には[[鉄]]を含む赤いタンパク質[[ヘモグロビン]]が充満しており、赤血球はヘモグロビンに酸素を取り込む<ref name="朝倉1559">杉本『内科学』p.1559</ref>。大きさは直径が7-8[[マイクロメートル|µm]]、厚さが2µm強ほどの両面中央が凹んだ円盤状であり<ref name="小川血液学p23">小川『血液学』p.23</ref>、数は血液1[[マイクロ|µ]]Lあたり成人[[男性]]で420-554万個、成人[[女性]]で384-488万個程度<ref group="注">基準値の設定は研究機関・検査施設ごとに違う</ref>{{sfn|小川 ほか『内科学書』|p=35}}で血液の体積のおよそ4-5割程度が[[ヘマトクリット値|赤血球の体積]]である<ref name="朝倉1558">杉本『内科学』p.1558</ref>。標準的な体格の成人であれば全身におよそ3.5-5リットルの血液があるため、体内の赤血球の総数はおよそ20兆個であり、これは全身の[[細胞]]数約60兆個<ref>エヌ・ティー・エス『幹細胞の分化誘導と応用』p.3</ref>の{{分数|1|3}}である。体内の細胞にくまなく酸素を供給するために膨大な数の赤血球が存在する。[[骨髄]]では毎日2000億個弱程度の赤血球が作られている<ref name="朝倉1559" />が、その寿命は約120日<ref name="朝倉1560">杉本『内科学』p.1560</ref>で、120日の間におよそ20-30万回に渡って体を循環して<ref group="注">ヒトでは安静時に心臓は4-8L/分の血液を拍出し-出典、寺野『シンプル内科学』p.110-人の体内の血液はおよそ3.5-5Lなので血液は平均しておよそ1分弱で体内を巡ることになる。1日で2000回前後、120日では20-30万回程度になる。</ref>酸素を供給し、古くなると[[脾臓]]や[[肝臓]]などの[[マクロファージ]]に捕捉され分解される{{sfn|小川 ほか『内科学書』|p=6}}{{sfn|三輪史朗 監修ほか|1998|p=7}}。赤血球は体の隅々の細胞にまで酸素を供給するため、柔らかく非常に変形能力に富み、自分の直径の半分以下の直径の狭い[[毛細血管]]にも入り込み通過することができる{{sfn|小川 ほか『内科学書』|p=10}}{{sfn|野村 ほか『赤血球』|p=30}}。 |
|||
赤血球は[[骨髄]]で[[赤芽球]]から作られ、[[血管]]に入り活動を始める。役目を終えたあとは |
|||
[[肝臓]]・[[脾臓]]で壊される。 |
|||
赤血球は成熟する最終段階で[[細胞核]]や[[ミトコンドリア]]・[[リボゾーム]]などの[[細胞小器官|細胞内器官]]を遺棄する。酸素の運搬には不要な細胞核や酸素を消費するミトコンドリアを捨て去り、乾燥重量の約9割が[[ヘモグロビン]]である{{sfn|三輪史朗 監修ほか|1998|p=7}}赤血球はいわばヘモグロビンを閉じ込めた柔軟な袋であり、ヘモグロビンによる酸素運搬に特化した細胞といえる。ミトコンドリアを持たないため、細胞の活動に必要なエネルギーは嫌気性[[解糖系]]と呼ばれる[[酵素]]によって糖([[グルコース]])を分解して得る{{sfn|『三輪血液病学』|p=214-215}}。 |
|||
赤血球を低張液にさらすと赤血球は浸透圧崩壊を起こし、赤血球内容物(ヘモグロビン等)が水溶液中に漏出する。この現象を溶血という。その後、浸透圧を回復し赤血球膜を再封すると赤血球ゴーストができる。 |
|||
== 構造と機能 == |
|||
細胞内のヘモグロビンが酸素と結合し、各細胞へ酸素を運搬する。ただし酸素より[[一酸化炭素]]と強く結合する為、体外から一酸化炭素を取り込んだ時、[[一酸化炭素中毒]]を生み出す原因となる。 |
|||
赤血球の役割は[[酸素]]と[[二酸化炭素]]の運搬であり、その構造は表面の赤血球膜と内部の細胞質に分けられるが、赤血球細胞膜を通して酸素と二酸化炭素が交換され、細胞質のヘモグロビンと酵素の働きで酸素と二酸化炭素は輸送される。 |
|||
通常の細胞が持つ核などの細胞内器官を捨て去っているため、細胞質は水とヘモグロビンで容積のほとんどを占め、それ以外は解糖系や[[ペントースリン酸経路]]に関わる酵素、[[炭酸脱水酵素]]、グルコース、炭酸、Na{{sup|+}}, Ca{{sup|2+}}, K{{sup|+}}, Cl{{sup|-}} などのイオンなどわずかであり{{sfn|『血液のレオロジーと血流』|p=24}}{{sfn|『三輪血液病学』|p=116,214-218}}、正常な赤血球の細胞質には顕微鏡観察で目に付く構造はない{{sfn|『三輪血液病学』|p=120-124}}。 |
|||
大量出血などで赤血球が失われると、[[脳]]へ酸素が上手く運搬されない為、[[脳死]]などを引き起こす。 |
|||
そうしたことから、出血時に対する[[代替赤血球]]の研究開発が[[日本]]でも進められている。 |
|||
形状は両面中央が凹んだ円盤状であるが、それは同じ体積の球に比べ表面積が30-40%大きく、その大きな表面積のため酸素・二酸化炭素の交換が球状の場合よりも有利であると考えられている。また赤血球は毛細血管では折り曲げられたり変形したりして通過するが、球に比べて両面が凹んだ円盤状だと体積に比べ表面の赤血球細胞膜に余裕があるため、変形のひずみの力に対して細胞膜にかかる力が小さくなると考えられている{{sfn|『血液のレオロジーと血流』|p=24}}{{sfn|『三輪血液病学』|p=49-50,214}}。 |
|||
細胞核を持つ赤血球は持たない動物より比較的大きい、など生物によってその大きさは異なる。例えばラットでは直径5.9μm、ヒトでは約8μmである。イヌはヒトの約80%、ネコは約50%の大きさで、共にヒトより多くの数をもつ。最大の赤血球を有する動物はゾウであると考えられており、その大きさは9μmである。一般に赤血球の大きい動物ほど赤血球数が少なくなる傾向がある。 |
|||
成熟した赤血球は、通常の細胞が持つ核やミトコンドリア、リボゾーム、[[ゴルジ体]]、[[小胞体]]などを捨て去り、酸素の輸送に特化した細胞であるので、細胞の運動能やタンパク質・脂質の合成能を持たず、通常の細胞のようには多くのエネルギーを必要としない(そのために酸素を消費してエネルギーの産出を担うミトコンドリアを捨て去ることができる)。しかし、赤血球でも [[アデノシン三リン酸|ATP]] を用いての陽イオンの輸送や細胞膜やヘモグロビンなどの各タンパク質の維持のために(通常の細胞よりは少ないものの)エネルギーを必要とする。エネルギーはグルコースを分解することで得られるが、グルコースの90%は嫌気性解糖系と呼ばれる多数の酵素による ATP合成経路である[[解糖系#エムデン-マイヤーホフ経路|エムデン-マイヤーホフ経路]]によって消費され ATP を産出する。この ATP は Na{{sup|+}} や K{{sup|+}} などの陽イオンの輸送や膜タンパクのリン酸化、解糖系自身の維持などに使われる。残りのグルコース10%は [[ニコチンアミドアデニンジヌクレオチドリン酸|NADPH]] を産出するために[[ペントースリン酸経路]]を経由することで消費される。NADPH はヘモグロビンなどの各タンパク質が酸化されることを防ぎ、保護する{{sfn|『三輪血液病学』|p=214-216}}{{sfn|野村 ほか『赤血球』|p=47-61}}。 |
|||
== 脊椎動物の赤血球 == |
|||
赤血球は主に[[ヘモグロビン]]を含んでいる。ヘモグロビンはヘムを持つ金属タンパク質である。[[肺]]や[[鰓]]の中では、ヘム中の[[鉄]]原子が[[酸素]]と結合し、身体の他の部分では酸素を放出する。酸素は赤血球の細胞膜を容易に透過できる。呼吸の結果出る二酸化炭素は、一部は赤血球によって回収されるが、その殆どは重炭酸として、血漿中に溶けて回収される。 |
|||
=== ヘモグロビンと酸素・二酸化炭素輸送 === |
|||
脊椎動物の進化において、酸素が血漿ではなく、細胞によって運ばれるようになったことは非常に重要である。このお陰で、血液の粘性は下がり、より高濃度の酸素を運ぶことができるようになり、血液から組織への酸素の拡散の効率が上がる。 |
|||
{{main|ヘモグロビン}} |
|||
[[画像:hemoglobin.jpg|thumb|250px|'''ヘモグロビンの立体構造図'''(リボンモデル)一つのヘモグロビン分子はヘム分子とグロビン分子がそれぞれ4つで構成され、赤または黄色に着色されているのがグロビン、緑色に着色されている小さい分子がヘムである。それぞれのヘムの中心に鉄原子が一つありそれが酸素と結合する。]] |
|||
[[File:ボーア効果(byぱた).png|thumb|350px|ボーアの原論文を元にした説明。酸素に富み、二酸化炭素の少ない肺(酸素分圧 100mmHg、二酸化炭素分圧 5mmHg 程度)ではヘモグロビンの酸素飽和度はほぼ100%になる。赤血球はそのまま酸素の少ない組織(たとえば酸素分圧30mmHg、図の赤線)に行くが、もしも二酸化炭素がない環境だと持っている酸素のうち18%程度しか放出できないが、組織内に40mmHgの二酸化炭素があると約50%、80mmHgの二酸化炭素があると約70%もの酸素を放出することができる。]] |
|||
ヘモグロビンは赤血球細胞質の主要な構成物質であり、肺から全身へ酸素を運搬する役割を担っているタンパク質である。ヘモグロビンは[[ポルフィリン]]核に鉄を持つ4つの[[ヘム]]と4つの[[グロビン]]からなり{{sfn|小川 ほか『内科学書』|p=5}}、ヘムは中心に1つの鉄原子を持ち、酸素1分子を結合することができるので、ヘモグロビン1分子で4個の酸素分子と結合することができる{{sfn|野村 ほか『赤血球』|p=22}}{{sfn|『三輪血液病学』|p=179}}。標準的な体格の成人が持つ赤血球に含まれる[[ヘモグロビン]]の総量は約750g であり<ref name="朝倉1559" />、1gのヘモグロビンは[[酸素]] 1.39mL と結合することができる{{sfn|小川 ほか『内科学書』|p=12}}ので、総量としておよそ 1L の酸素と結合することができる。 |
|||
赤血球の幼若な<ref group="注">[[造血幹細胞]]を源とし、完成形を赤血球とすると、造血幹細胞から赤血球への[[分化]]・成熟の途中段階である。</ref>段階である[[赤芽球]]には豊富な[[ミトコンドリア]]や[[ポリリボソーム]]が存在し、それらによって赤芽球は盛んにヘモグロビンの合成を行い、細胞が成熟するにつれて細胞質はヘモグロビンで充填されていくが、赤血球成熟の最終段階でミトコンドリアやポリリボソームが抜け落ち、成熟し完成した赤血球ではもはやヘモグロビンの合成は行われない{{sfn|『三輪血液病学』|p=117-118}}。 |
|||
赤芽球のミトコンドリアではヘムの骨格を成すポルフィリン環が作られ、ポルフィリン環に鉄原子が組み込まれてヘムが作られる。一方、mRNA に複数のリボソームが連結したポリリボソームはアミノ酸を組み立ててたんぱく質であるグロビンを作る{{sfn|『三輪血液病学』|p=116-118}}。 |
|||
ミトコンドリアが作ったヘムとポリリボソームが作ったグロビンが細胞質内で出会い、ヘモグロビンになる{{sfn|『三輪血液病学』|p=116-118}}。 |
|||
=== 寿命 === |
|||
ヒトについては長命説が優勢で120日間とされている。ラットでは約60日である。哺乳類において最長の寿命を持つものはラクダの赤血球であり約225日である。また酸素不足となると寿命は大幅に減少する。 |
|||
成熟した赤血球は骨髄から血管内に移動し、血液循環によって肺から組織・組織から肺を巡る。組織内では細胞の活動により[[二酸化炭素]]が発生し血漿や組織液に溶け込んでいるが、細胞膜を通して二酸化炭素は赤血球内に取り込まれる。赤血球内で二酸化炭素 (CO{{sub|2}}) と水 (H{{sub|2}}O) は炭酸脱水酵素によって[[炭酸水素塩|重炭酸イオン {{chem|(HCO|3|-|)}}]] と水素イオン (H{{sup|+}}) になり、水素イオンが増加することにより酸性が強くなった赤血球内では、酸素とヘモグロビンが結びついたオキシヘモグロビンから酸素分子が遊離し、細胞膜を通って体細胞に酸素が供給される([[ボーア効果]])。酸素を放出したヘモグロビンは水素イオンと結びついて赤血球内が極端に酸性に傾くのを防ぐ{{sfn|三輪史朗 監修ほか|1998|p=99-100}}{{sfn|『三輪血液病学』|p=179,234}}。 |
|||
鳥類以下の赤血球は細胞核を持っており、そうした赤血球の寿命は哺乳類のそれにくらべて長い。 |
|||
血液中の二酸化炭素のほとんどは赤血球内に取り込まれ、二酸化炭素の約70%は赤血球内の炭酸脱水酵素によって重炭酸イオンに変換され、重炭酸イオンの多くはバンド3 (band 3) と呼ばれる赤血球膜を縦貫する膜輸送たんぱく質によって塩素イオンと交換に赤血球外に出され血漿に溶け込んで肺に循環する。二酸化炭素の15-20%は酸素を放出したヘモグロビンに結びつきカルバミノヘモグロビンとして赤血球により肺に運ばれ、約10%はそのまま血漿に溶け込んで肺に循環する{{sfn|『血液のレオロジーと血流』|p=3}}。 |
|||
=== 哺乳類の赤血球 === |
|||
[[画像:Redbloodcells.jpg|thumb|200|脱核した赤血球は真ん中がくぼんだ円盤形をしている。]] |
|||
成熟途中で細胞核が失われ(脱核という)、さらにミトコンドリア等の細胞器官を失っている。そのため、エネルギーは全て解糖系でまかなっている。ただし、[[髄外造血]]が行われると、核を持つ未熟な赤血球([[有核赤血球]],NRBC)が出現する。 |
|||
人の場合だと肺では酸素分圧はほぼ 100mmHg であり二酸化炭素はほとんどないので赤血球の酸素飽和度はほぼ100%になる。酸素を含んだ赤血球は組織に循環するが、組織内の酸素分圧は組織によって違い、一般的な組織内では 40mmHg、活動中の筋肉内では 20mmHg 程度になる<ref group="注">短距離走などの激しい運動をしている筋肉では組織内の酸素分圧は一気に 5mmHg 程度に下がる。この酸素分圧レベルになると筋肉組織内のミオグロビンが蓄えていた酸素を放出して一時的に賄うがミオグロビンは酸素に対する親和性がヘモグロビンより高いので通常の組織内の酸素分圧レベル 20mmHg 以上では酸素を供給することはできない。</ref>。酸素分圧の差でも赤血球は酸素を放出するが二酸化炭素が存在せず酸素分圧の差のみであると、赤血球は持っている酸素の内 10-30% 程度しか赤血球外へ放出できない。しかし組織内に二酸化炭素が発生していると二酸化炭素が炭酸に変換されることで pH が低下し、pH の低下によっておきるボーア効果で赤血球は大半の酸素を放出することができるようになる<ref name="ハーパー生化学p49">Robert K『ハーパー生化学』p.49</ref>(右上図も参照のこと)。 |
|||
形は真ん中のわずかにくぼんだ円盤状の形状(例外として[[ラクダ科]]では楕円形)である。円盤状の形状をとることにより、球形の形状に比べ表面積を拡大している。色は赤。赤色は呼吸色素[[ヘモグロビン]]に由来する。 |
|||
酸素に富み二酸化炭素の少ない肺では、赤血球は逆の行程で[[炭酸水素塩|重炭酸イオン]]を二酸化炭素に戻して吐き出し、酸素を取り込む{{sfn|三輪史朗 監修ほか|1998|p=99-100}}。つまり、二酸化炭素の少ない肺では赤血球内の二酸化炭素が出て行くが、赤血球内の二酸化炭素濃度が下がると炭酸脱水酵素は組織内のときとは逆に水素イオンと重炭酸イオン {{chem|(HCO|3|-|)}} から二酸化炭素 (CO{{sub|2}}) と水を生成して、赤血球内の細胞質の pH は上昇する。また赤血球内の重炭酸イオンが減少したことで赤血球外の重炭酸イオンが塩素イオンと交換で取り込まれ、二酸化炭素に変換されて再び放出される。pH が上昇した赤血球内では酸素を取り込みやすくなり、もともと酸素に富んだ肺組織内であるのでヘモグロビンはいっぱいに酸素を取り込む。酸素飽和度が上がった赤血球は、再び末端の組織細胞に酸素を運搬する{{sfn|八幡『細胞膜のしくみ』|p=88-89}}。 |
|||
=== ヒトの赤血球 === |
|||
[[1658年]]、[[オランダ]]の昆虫学者[[ヤン・スワンメルダム]]の[[顕微鏡]]観察により発見され、[[1673年]]、[[アントニ・ファン・レーウェンフック|レーウェンフック]]によっても観察された。 |
|||
過剰な酸素は細胞を傷つけるが、赤血球に酸素を取り込み末端組織内で酸素を吐き出す過程では二酸化炭素の存在によって酸素が供給されるので、二酸化炭素の濃度が濃い(一般に活動の盛んな細胞ほど二酸化炭素の排出が多い)ほど赤血球が供給する酸素の量が増えてくるので酸素を必要とする細胞に必要とする適量の酸素を供給することができる。この点が液体に酸素を溶かし込んで供給するシステムとの大きな違いである{{sfn|三輪史朗 監修ほか|1998|p=99-100}}。 |
|||
[[ヒト]]の場合、正常数は、男性で約500万個/mm³、女性で約450万個/mm³。<!--人の血液が5[L]=5×10^6[mm^3]と考えると、赤血球は2.5×10^13個となる。人体の60兆の細胞中、赤血球が25兆を占めているのは、一見ありえないほど高い比率だが、事実である。-->[[寿命]]は約120日。大きさは[[1_E-6_m|7-8μm]]である。血液を1000[[重力加速度|G]], 10分ほど[[遠心分離|遠心]]すると上層に血漿、中層にBuffycoat、下層に赤血球の層が沈殿するが、その比率は大凡55:1:44である。 |
|||
==== ヘモグロビンの酸素親和性の調節 ==== |
|||
赤血球は、多くの[[血液型]]をもつ。中でも[[ABO式血液型]]([[1900年]][[オーストリア]]・[[ウィーン大学]][[カール・ラントシュタイナー]]により発見)は、赤血球の表面に発現している[[抗原]]によって定まる、最も主要な分類の一つである。 |
|||
ヘモグロビンの酸素親和性の調節では前述のように血液循環で肺と組織を巡る間で H{{sup|+}} の作用(pH の変化)によるボーア効果によって酸素の親和性が変化し赤血球は二酸化炭素の少ない肺では酸素を取り込みやすく、二酸化炭素が発生している組織内では酸素を放出しやすくなる。だが、ヘモグロビンの酸素親和性の調節には pH の変化だけでなく 2,3-BPG(2,3-ビスホスホグリセリン酸あるいは 2,3-DPG 2,3-ジホスホグリセリン酸とも表記する)も関わる。 |
|||
精製したヘモグロビンは赤血球中のヘモグロビンよりも酸素親和性が高い。赤血球には 2,3-BPG が含まれるが 2,3-BPG はヘモグロビンの酸素親和性を弱める。人が空気の薄い高山に行くと酸素不足状態に陥るが、1日ほどで相当に適応することができる。高地に行き低酸素状態になると数時間ほどで血液中の 2,3-BPG濃度が上昇し酸素親和性が低下する。酸素親和性の低下は肺でよりも組織内での効果が大きく、そのため組織内での酸素放出量を増やすことができる。人では高地適応の例だけではなく、貧血や心不全・呼吸不全などによる低酸素血症でも、2,3-BPG濃度を上昇させて血液の低酸素状態に対してある程度の対応を行うことができる{{sfn|『三輪血液病学』|p=179}}。 |
|||
== 哺乳類以外の脊椎動物の赤血球 == |
|||
[[哺乳類]]以外の脊椎動物では赤血球に[[細胞核]]を持っている。例外は[[アメリカサンショウウオ科]] ([[:en:Plethodontidae|Plethodontidae]]) の[[:en:Batrachoseps|Batrachoseps]]。これは、[[1823年]]に[[フランツ・バウエル]]が[[ジョン・ハンター (外科医)|ジョン・ハンター]]の標本を研究し[[魚類]]の赤血球中核があることをスケッチし、核 (nucleus) と命名した。 |
|||
胎児の赤血球に含まれるヘモグロビンFは成人のヘモグロビン(ヘモグロビンA)よりも 2,3-BPG に対する結合が弱く、そのため酸素親和性が高い。これは胎盤内で母親側から酸素を受け取らなければならないために、胎児のヘモグロビンは母親のヘモグロビンよりも高い酸素親和性が必要なためである{{sfn|『三輪血液病学』|p=179}}。 |
|||
== 赤血球の関与する病気 == |
|||
{{Medical}} |
|||
[[Image:Sicklecells.jpg|frame|right|[[鎌状赤血球症]]の赤血球 ]] |
|||
*[[貧血]]性疾患 |
|||
**[[再生不良性貧血]] |
|||
**[[鉄芽球性貧血]] |
|||
**[[鉄欠乏性貧血]] |
|||
**[[溶血性貧血]] |
|||
***[[自己免疫性溶血性貧血]] |
|||
***[[遺伝性球状赤血球症]] |
|||
***[[サラセミア]] |
|||
***[[発作性夜間血色素尿症]] |
|||
**[[巨赤芽球性貧血]] |
|||
***[[悪性貧血]] |
|||
***[[ビタミンB12欠乏性貧血]] |
|||
**[[鎌状赤血球症]] |
|||
*[[真性多血症]] |
|||
*[[マラリア]]はマラリア[[原虫]]が赤血球に寄生する病気である。 |
|||
== |
=== 赤血球細胞膜 === |
||
[[File:リン脂質の基本構造(ぱた).png|thumb|300px|'''リン脂質分子の代表的な構造''' リン脂質のうち細胞膜で多数をしめるグリセロリン脂質の基本構造。(R) の部分は分子によって違い、(R) の部分にコリンが付くとホスファチジルコリンになる。]] |
|||
[[Image:Osmotic pressure on blood cells diagram.svg|thumb|250px|赤血球に影響する[[浸透圧]] ]] |
|||
[[File:リン脂質二重層膜の基本構造(byパタ).png|thumb|300px|※色は実際の色ではない。]] |
|||
*[[白血球]] |
|||
[[File:Cell membrane detailed diagram en.svg|thumb|300px|一般的な細胞膜の構造。細胞膜はリン脂質分子(赤い丸に黄色い2本足)が自発的に無数に並んで形成されるリン脂質二重層に各種タンパク質などが絡んで形成される(図の着色は実際の色とは無関係である)。]] |
|||
*[[血小板]] |
|||
[[File:RBC membrane major proteins.png|thumb|300px|赤血球の細胞膜。一般の細胞に比べて膜骨格が顕著である。脂質二重層にからんで緑色が赤血球膜骨格、赤や青が縦貫タンパク質やそれに連結するタンパク質である(図の着色は実際の色とは無関係である)。]] |
|||
*[[血漿]] |
|||
赤血球は自分の直径の半分以下の径の微小な毛細血管にも入り込まなければならないので非常に柔軟な変形能力を持ち、また120日間の寿命の間、絶えず循環し繰り返しの変形に耐える安定性が求められる<ref name="朝倉1558" />。その赤血球を構成している赤血球細胞膜は、主にリン脂質が隙間なく並んだ層が二重の層を形成している膜脂質二重層と、鎖状のタンパク質が網状に連結され細胞膜を裏打ちして支持している膜骨格、脂質二重層と膜骨格の連結し保持する膜縦貫タンパク質やアンカータンパク、細胞膜を貫通し物質の細胞内外の交換の役割を果たすポンプ・キャリア・チャネルと呼ばれる膜縦貫タンパク質や情報のやり取りのためのレセプター、表面を産毛のように覆い細胞間の情報伝達や、他の細胞との接着・分離にも関係する[[糖鎖]]などからなっている{{sfn|三輪史朗 監修ほか|1998|p=81-98}}。 |
|||
*[[貧血]] |
|||
*[[血液学]] |
|||
*[[解糖系]] |
|||
*[[網赤血球]] |
|||
*[[球状赤血球]] |
|||
*[[ハウエルジョリー小体]]、[[ハインツ小体]] |
|||
*[[多染性赤血球]] |
|||
==== 膜脂質二重層 ==== |
|||
親水性のリン酸部分の頭部に疎水性である脂肪酸が2本の尾部が付いたのがリン脂質分子である。赤血球の内外は主に水で満たされているのでリン脂質分子は頭部を外側に、水に反発する尾部を内側に厚さが 3.5-5.6[[ナノメートル|nm]]<ref name="分子細胞生物学p381">H. Lodish『分子細胞生物学』p.381</ref><ref group="注">リン脂質二重層の厚さに関しては文献によって異なり、{{harv|『三輪血液病学』|p=129}}では 7.5[[ナノメートル|nm]]、H. Lodish, 他 著『分子細胞生物学』p381では 3.5-5.6nm、日本検査血液学会編『スタンダード検査血液学』では 8nm、浅島『図解分子細胞生物学』では 3-5nm など様々である。これは膜に存在するタンパク質の厚さも影響していると思われる。タンパク質を考慮しない脂質二重層のみの厚さは3-6nmの範囲と思われる。ここでは『分子細胞生物学』の数字を挙げた。</ref>程度の厚さの二重層を自発的に作って並ぶ(右の各図で丸い頭に2本足で描かれているのがリン脂質分子で、それが無数に並んでいるのが二重層である)。二重層の両外側は親水性なので膜全体は赤血球内外の環境になじみ、内側には疎水性の脂肪酸が充満しているので細胞の内外をしっかり遮断することができる、単位時間、単位面積あたりに透過する水分子の数は少ない。このリン脂質二重層は電気的に中性で極めて小さな分子、例えば酸素分子や二酸化炭素分子は通すが、極性を持つ水分子は通りにくく、大きな分子やイオンは通ることができない<ref name="赤血球膜研究史p260">八幡『赤血球膜研究史』p.260</ref><ref name="クーパー細胞生物学p49-51">Geoffrey『クーパー細胞生物学』p.49-51</ref>。 |
|||
リン脂質分子同士の結合は緩いので、各リン脂質分子はリン脂質二重層の中を横方向に自由に移動することができ、細胞の変形や細胞分裂などでも2重層構造が破けることはない、さらに血漿中のリン脂質分子が脂質二重層に入り込んだり、逆に血漿中に抜け出ることも可能である。また脂質2重層を貫通している膜縦貫タンパクやレセプターなども膜脂質二重層上を移動することができる(膜骨格にアンカーされているものは膜骨格の自由度の範囲内で動ける)、実際、マウスとヒトの細胞を融合させる実験では細胞膜上の分子は移動しマウス由来の分子とヒト由来の分子が混ざり合うことが確認されている<ref name="クーパー細胞生物学p49-51" /><ref name="図解分子細胞生物学p7-8">浅島『図解分子細胞生物学』p.7-8</ref>。 |
|||
このリン脂質分子はリン酸の先に付いた分子によりホスファチジルコリン (PC)、スフィンゴミエリン (SM)、ホスファチジルエタノールアミン (PE)、ホスファチジルセリン (PS) などがあり、赤血球の膜脂質二重層では PC が21%、PS と PE が併せて29%、SM が21%、コレステロールが26%、他が数%で構成される<ref name="分子細胞生物学p380">H. Lodish『分子細胞生物学』p.380</ref>。 |
|||
並んだリン脂質分子の間にコレステロールが入り込むと分子が動ける自由度は低下し、膜は硬くなり柔軟性が弱くなる。膜脂質二重層の多くの部分ではコレステロールは多くはないのでリン脂質分子は比較的自由に動けるが、次に解説する膜脂質ラフト部分ではリン脂質の間に入り込んだコレステロールが非常に多くなる<ref name="図解分子細胞生物学p9">浅島『図解分子細胞生物学』p.9</ref>{{sfn|八幡『細胞膜のしくみ』|p=44-47}}。 |
|||
これらの PC や PS, PE, SM などは二重層の外側(血漿側)と内側(細胞質側)で分布にムラがあり、外側には PC, SM と糖脂質が多く、内側には PE, PS が多く非対称分布を成している。リン脂質分子の膜の表裏間の移動(フリップフロップ)は3種類の酵素が関わっており、flippase は PE、PS を膜の外側(血漿側)から内側(細胞質側)に移動させ、floppase はすべての脂質分子を内側から外側に移動させ、scramblase はすべての分子を両方向に混同する。これらの酵素の働きによって膜内外のリン脂質の非対称分布がなされていると考えられている<ref name="図解分子細胞生物学p7-8" />{{sfn|八幡『細胞膜のしくみ』|p=36-39}}。非対称分布の一つの理由として、主なリン脂質の中で PS は陰性荷電を持ち、細胞質内のタンパク質が持つ陽性荷電と相互作用しやすいことが細胞膜の機能に好都合であるからだと考えられている<ref name="赤血球膜研究史p258">八幡『赤血球膜研究史』p.258</ref>。 |
|||
===== 膜脂質ラフト (Lipid Raft) ===== |
|||
[[File:Lipid raft organisation scheme.svg|thumb|300px|脂質ラフト、画の下側が細胞外、上側が細胞質側になる。1.は通常の脂質二重層、2.脂質ラフト、3.4.膜縦貫タンパク質、5.糖鎖、6.膜外タンパク、7.コレステロール、8.糖脂質]] |
|||
リン脂質二重層膜上には他の部分より少し厚さが厚く少し硬い脂質二重層上を移動することができる領域があり、海に浮かぶ筏に例えられ脂質ラフト (Lipid Raft) と呼ばれている。ラフト部分ではリン脂質は主にスフィンゴミエリン (SM) で構成され、SM分子の間にコレステロール分子が非常に多く入り込んで分子間の結合を強化している。スフィンゴミエリンの脂肪酸部分は PC や PS, PE より長いのでラフトは若干厚さを増し、コレステロールが分子間結合を強化するので硬くなる。ラフトでは SM とコレステロールの他に、膜縦貫タンパクやレセプター、糖脂質なども多く存在している。多くの積荷を積んだ筏のようなイメージでラフトと通称されているが、通常の脂質二重層もラフトも、どちらもリン脂質を主要構成分子にしている点は海上に浮かぶ筏とは違う。ラフトの直径は数十[[ナノメートル|nm]] 程度で赤血球膜状には多数あり、タンパク質や糖鎖など多種の分子を多く載せているラフトは赤血球の機能に大きく関わっている部分だと考えられている<ref name="図解分子細胞生物学p9-10">浅島『図解分子細胞生物学』p.9-10</ref>{{sfn|八幡『細胞膜のしくみ』|p=48-50}}。 |
|||
==== 膜骨格 ==== |
|||
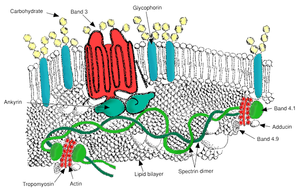
[[File:赤血球膜骨格-パタゴニア.jpg|thumb|300px|膜骨格の概略。スペクトリンはアクチンやバンド4.1タンパクによって網状に連結される。スペクトリンに結合したアンカータンパク・アンキリンは膜縦貫タンパク・バンド3と結び付き、スペクトリン-アクチン-バンド4.1連結部は膜縦貫タンパクグリコフォリンに連結する]] |
|||
α鎖[[スペクトリン]] (Spectrin) と β鎖スペクトリンが連結した一本の線状のタンパク質が並んで2本絡まった長さ 200[[ナノメートル|nm]] のひも状のタンパク質(α鎖2本β鎖2本の4量体スペクトリン)が、4.1タンパク (Band4.1) やアクチン (Actin) など<ref group="注">スペクトリンの結合・連結には4.1タンパク (Band4.1) やアクチン (Actin) が関わり、結合部には他に4.2タンパク・4.9タンパク・アデューシンなどのタンパク質が見られるが、4.2タンパク・4.9タンパク・アデューシンの役割は不明である-出典、日本生化学会『新生化学実験講座6』(上)p405-408</ref>のタンパク質によって連結され網状になり脂質二重層に接するように存在するのが膜骨格である{{sfn|三輪史朗 監修ほか|1998|p=81-98}}。スペクトリンは収縮性に富み、伸びきると4量体で 200nm の長さが普段はスプリングのように40nm程度に収縮し、その収縮したスペクトリンが網状に連結された膜骨格は[[アンキリン]] (Ankyrin) や4.1タンパクによって膜縦貫タンパク質・バンド3タンパク (Band3) やグリコフォリン (Glycophorin) に結合され脂質二重層にぶら下がるように接している{{sfn|八幡『細胞膜のしくみ』|p=58}}。 |
|||
この膜骨格は赤血球が狭い毛細血管に入り込むときに変形するとスプリングが伸びたような状態で赤血球の変形に対応し毛細血管をくぐり抜けた後には収縮して赤血球の形を保つ{{sfn|八幡『細胞膜のしくみ』|p=58}}。この脂質二重層の細胞膜を膜骨格が裏打ち補強している構造が赤血球膜の柔軟性と安定性をもたらしている{{sfn|三輪史朗 監修ほか|1998|p=81-98}}。 |
|||
==== 表面タンパク ==== |
|||
赤血球の役割は酸素や二酸化炭素の輸送であり、そのために赤血球膜では[[酸素|酸素 (O{{sub|2}})]] と[[二酸化炭素|二酸化炭素 (CO{{sub|2}})]]、[[炭酸水素塩|重炭酸イオン {{chem|(HCO|3|-|)}}]] の交換が重要であり、また細胞の維持に必要な[[グルコース]]や各イオンなどの交換も重要である。 |
|||
赤血球膜縦貫タンパク質であるバンド3は一つの赤血球に120万個あり赤血球膜縦貫タンパク質では最も多いが、赤血球膜に適度な間隔をおいて存在し、脂質二重層と膜骨格のアンカーの役とともに重炭酸イオンと塩素イオンの交換や一部の有機物の輸送を行っている。グルコースやナトリウムイオン、カリウムイオン、カルシウムイオンなどはその他の赤血球膜縦貫タンパク質によって輸送され、酸素分子や二酸化炭素分子などの電気的に中性で小さな分子は脂質二重層を直接通過する{{sfn|三輪史朗 監修ほか|1998|p=81-98}}{{sfn|『三輪血液病学』|p=235}}{{sfn|野村 ほか『赤血球』|p=45-46}}{{sfn|八幡『細胞膜のしくみ』|p=86-91}}。 |
|||
{|class="wikitable" |
|||
|+主要な赤血球膜上の物質輸送機関{{sfn|野村 ほか『赤血球』|p=45-46}}<ref name="分子細胞生物学p403-404">H. Lodish『分子細胞生物学』p.403-404</ref> |
|||
!物質輸送機関!!被輸送体!!輸送方法 |
|||
|- |
|||
|脂質二重層<br><br> |
|||
|酸素 O{{sub|2}}、二酸化炭素 CO{{sub|2}} |
|||
|[[受動輸送]](単純拡散) |
|||
|- |
|||
|Na{{sup|+}}, K{{sup|+}} ATPaseタンパク質 |
|||
(adenosine triphosphatase) |
|||
|Na{{sup|+}} と K{{sup|+}} |
|||
|Na{{sup|+}} と K{{sup|+}} の交換を行う[[能動輸送]](対向輸送) |
|||
|- |
|||
|Ca{{sup|2+}} ATPaseタンパク質 |
|||
(adenosine triphosphatase) |
|||
|Ca{{sup|2+}} |
|||
|Ca{{sup|2+}} の能動輸送(単輸送) |
|||
|- |
|||
|バンド3タンパク質 |
|||
(anion exchange protein) |
|||
|{{chem|HCO|3|-|}}, {{chem|Cl|-}}, ピルビン酸など |
|||
|[[受動輸送]](陰イオン交換体) |
|||
|- |
|||
|バンド4.5タンパク質 |
|||
(glucose transporter) |
|||
|グルコース |
|||
|受動輸送(促進拡散) |
|||
|- |
|||
|[[アクアポリン]] |
|||
(aquaporin) |
|||
|H{{sub|2}}O(水) |
|||
|選択通過[[膜輸送体|チャネル]](選択透過孔) |
|||
|} |
|||
上記以外にも多くの[[膜輸送体|トランスポーター]]や[[レセプター]]が赤血球膜にはあることが報告されている{{sfn|『三輪血液病学』|p=111-112}}。 |
|||
また、これらの赤血球膜縦貫タンパク質は血液型抗原にも関係している。一例では AB型はバンド3 とバンド4.5タンパクの赤血球膜外構造である糖鎖構造が抗原になっている{{sfn|野村 ほか『赤血球』|p=46-47}}。 |
|||
また、物質輸送には関わらないが、赤血球膜上には膜貫通タンパク質である[[グリコホリン]]が100万個{{sfn|『三輪血液病学』|p=130}}ほど存在する。赤血球膜上ではバンド3についで多いタンパク質であるが、グリコホリンの細胞質側は膜骨格に連結されアンカーの役を果たし、赤血球外面に出た部分には大量の糖鎖を有している<ref name="スタンダード検査血液学p22">日本検査血液学会『スタンダード検査血液学』初版 p.22</ref>。糖鎖の先端には[[シアル酸]]があり、シアル酸は COOH基を持つために陰性荷電しているので同じく陰性荷電している赤血球同士や血管内皮細胞との接着を防いだり、同じく陰性荷電している細菌の侵入を防ぐ働きを持っている。 |
|||
※バンド4.1 や 4.5 などは名称は似ているが、[[電気泳動]]分析のバンド番号であり、分子量による命名であって、それぞれは異なるタンパク質である。 |
|||
== 生成と破壊 == |
|||
=== 生成 === |
|||
[[File:Polycythemia vera, blood smear.jpg|thumb|350px|血液疾患のために血液中に現れた[[赤芽球]]。右上に2つある有核細胞のうち丸い核のものが好塩基性赤芽球、左下にある2つの有核細胞の大きいほうが多染性赤芽球、小さいほうが正染性赤芽球。一番右上と右下のいびつな核の細胞は白血球である。]] |
|||
[[ファイル:Bloodcelldifferentiationchart(Japanese).jpg|thumb|350px|'''[[造血幹細胞]]とその細胞系統'''<br>通常骨髄で観察される幼弱な赤芽球系の細胞は、染色性が塩基好性の細胞質を持つため、灰青色を呈する。これらは成熟するにしたがって、徐々にヘモグロビンの赤色が明らかになっていき、最終的に核が脱落した赤血球となって末梢血に送り出される。]] |
|||
[[造血幹細胞]]から分化し始めた幼若な血液細胞は盛んに分裂して数を増やしながら少しずつ分化を進めていく。最終的に赤血球に分化・成熟する場合は造血幹細胞、骨髄系幹細胞(骨髄系前駆細胞)、赤芽球・巨核球系前駆細胞、前期赤芽球系前駆細胞 (BFU-E)、後期赤芽球系前駆細胞 (CFU-E)、[[前赤芽球]]、[[好塩基性赤芽球]]、[[多染性赤芽球]]、[[正染性赤芽球]]、([[網赤血球]])、赤血球と成熟していく{{sfn|『三輪血液病学』|p=120-124,242-244}}。 |
|||
骨髄系幹細胞(骨髄系前駆細胞)、赤芽球・巨核球系前駆細胞、前期赤芽球系前駆細胞 (BFU-E)、後期赤芽球系前駆細胞 (CFU-E) などの前駆細胞の段階では、細胞は非常に活発に細胞分裂して数を増やすが、顕微鏡による形態観察では赤血球系との判別は困難である{{sfn|『三輪血液病学』|p=242-244}}。 |
|||
前赤芽球の段階から形態的にも赤血球への分化の方向がはっきりしてくる。赤血球系と判別できるようになった前赤芽球から多染性赤芽球までの細胞も前駆細胞ほど盛んではないが細胞分裂能を持ち、1つの前赤芽球は多染性赤芽球の段階までに3-4回細胞分裂を起して8-16個の細胞に増える{{sfn|野村 ほか『赤血球』|p=28}}。 |
|||
前赤芽球は直径が 20-25µm で前の段階の前駆細胞より大きくなり、赤血球への分化・成熟の段階で一番大きい細胞であり、顕微鏡観察で赤血球への分化の方向が明らかな最初の段階の細胞であり、核構造は繊細で、細胞質は塩基性<ref group="注">血液細胞はヘモグロビン以外の物質は無色半透明であり、そのままでは顕微鏡を用いても細胞の様子を見ることはできない。そのために細胞に染色をして特徴を見やすくする。染色の方法は目的によって様々であるが、一般的なライトギムザあるいはメイギムザ染色は二重染色であり、塩基性色素が DNA や RNA, 細胞質のアズール顆粒などを青色に染め、エオジン色素がヘモグロビンや好酸性顆粒を赤橙色に染めるが、若い赤芽球では細胞質が塩基性色素で特に青色が強く染まり、ヘモグロビンが作られ始めた多染性赤芽球では細胞質の青が弱くなってヘモグロビンを染める赤が加わって「多染」となり、さらにヘモグロビンが増えた正染性赤芽球では赤が強くなり細胞質の青色は分からなくなる。</ref>が強く、リボゾームが多い{{sfn|『三輪血液病学』|p=242-244}}。 |
|||
好塩基性赤芽球では大きさは前赤芽球より小さくなり(この後の段階でさらに小さくなり続ける)16-18µm ほどであり、前赤芽球ほどではないが細胞質は塩基性であり、核構造はやや粗くなる{{sfn|『三輪血液病学』|p=242-244}}。 |
|||
多染性赤芽球ではヘモグロビンの合成が開始され{{sfn|『三輪血液病学』|p=121}}、ヘモグロビン量が増えるにつれ細胞質の塩基性は弱くなり、細胞はさらに小さくなり、[[核濃縮|核構造は凝縮]]しさらに粗くなる。この段階でも弱いながらも細胞分裂能を残している{{sfn|『三輪血液病学』|p=242-24}}。 |
|||
正染性赤芽球では細胞分裂能は失われ細胞核は凝縮し細胞質は赤血球に近くなる。直径は 10-15µm でやがて細胞核が脱落して赤血球に成熟する{{sfn|『三輪血液病学』|p=242-244}}。 |
|||
これらの幼若な段階の細胞、造血幹細胞、前駆細胞、[[赤芽球]]は骨髄にのみ存在する。骨髄にはバリアがあり、幼若な血液細胞は骨髄から出ることができず、[[脱核 (微生物学)|脱核]]して赤血球になって初めて血液中に出ることができるため、通常は[[末梢血]]では有核の赤芽球は観察されない。 |
|||
正染性赤芽球から核が脱したばかりの若い赤血球では、まだ[[リボゾーム]]が残っており、ニューメチレンブルーによる超生体染色を行うとタンパク質と RNA の複合体であるリボソームがその他の細胞内小器官を巻き込みながら網状に凝集し、凝集したリボソームの RNA が青く染まり、顕微鏡観察では網状に見えるので[[網赤血球]]と呼ぶ。網赤血球の段階でも 10%-30% ほどのヘモグロビンが合成される。網赤血球は骨髄内に2日ほど留まり、その後血液中に移動して1-2日ほどでリボソームやミトコンドリアが抜け落ちて成熟し完成した赤血球になる{{sfn|『三輪血液病学』|p=120-124}}。通常、網赤血球は赤血球の 0.5-1.5% 程度であるが、造血が盛んになると若い出来立ての赤血球である網赤血球の割合が増え、骨髄での造血機能が衰えると網赤血球の割合が減る。 |
|||
赤血球は[[骨髄]]で[[造血幹細胞]]から作られるが、その分化・成熟には骨髄において[[マクロファージ]]が大きく関わっている。骨髄において、赤血球の幼若な段階である[[赤芽球]]はマクロファージを中心にその回りを取り囲むように数個から数十個が集団で寄り集まっている。中心に存在するマクロファージは赤芽球に接し、[[ヘモグロビン]]の合成に不可欠な鉄や細胞の生育に必要な物質を供給し、成熟をコントロールし、また脱核させた核の処理や、不要になった赤血球細胞の除去にも関与している{{sfn|『三輪血液病学』|p=120-124}}<ref name="三輪『血液細胞アトラス』第5版、p.77">三輪『血液細胞アトラス』p.77</ref>。この、骨髄内においてマクロファージを中心に赤芽球が集まり、赤血球の形成に関わっている細胞集団を[[赤芽球島]]もしくは赤芽球小島という{{sfn|『三輪血液病学』|p=120-124}}。 |
|||
==== 胎児における造血 ==== |
|||
以上で説明しているのは出生後のヒトの造血であるが、[[胎児]]の造血は出生後とは様相が違う。まずは[[胎生]]15-18日頃に卵黄嚢において一次造血が始まり{{ill2|胚型赤血球|en|Embryonic hemoglobin}}が産出される。胚型赤血球は胎生4週以降血液循環を行って酸素を運搬する。一次造血で産出される胚型赤血球は胎生5-6週頃から始まる二次造血による{{ill2|胎児型赤血球|en|Fetal hemoglobin}}(胎児ヘモグロビン、ヘモグロビンF、HbF)および出生後の成熟赤血球({{ill2|ヘモグロビンA|en|Hemoglobin A}}、{{ill2|ヘモグロビンA2|en|Hemoglobin A2}})とは大きく異なる。胎生初期に卵黄嚢で作られる胚型赤血球は胎児型赤血球および成体型赤血球と比べて4-5倍の大きさがあり、成熟しても脱核はせず有核である。形態的には[[赤芽球]]に似るが、胚型赤血球のヘモグロビンは胎児型ヘモグロビンとも出生後の赤血球のヘモグロビンとも違うものである<ref group="注">成人のヘモグロビン (HbA) は2本のポリペプチドα鎖グロビンと2本のポリペプチドβ鎖グロビンからなる四量体 (α{{sub|2}}β{{sub|2}}) であるが、人のグロビンには α鎖と β鎖の他に、γ鎖、δ鎖、ε鎖、ζ鎖がある。α鎖とζ鎖の遺伝子は16番染色体上に並び、ζ鎖は胚期初期にのみ発現する。胎生期の大部分と出生後は α鎖のみが発現する。11番染色体上ではグロビン遺伝子は ε鎖、γ鎖、δ鎖およびβ鎖の順に並びスイッチングが起きて発現するグロビンが変化する。胚性ヘモグロビンは α{{sub|2}}ε{{sub|2}}, ε{{sub|4}}, ζ{{sub|2}}ε{{sub|2}}, ζ{{sub|2}}γ{{sub|2}} などであるが、グロビン遺伝子のスイッチングで ε鎖、ζ鎖はまもなく作られなくなり、次に作られる胎児型ヘモグロビンHbF は α{{sub|2}}γ{{sub|2}} であるが、出生に近づくとγ鎖も次第に減っていき、出生後にはヘモグロビンの大半を占める α{{sub|2}}β{{sub|2}} の HbA と少数の α{{sub|2}}δ{{sub|2}} からなる HbA2 に置き換わっていく。-出典 {{harv|三輪史朗 監修ほか|1998|p=114-118}}および{{harv|野村 ほか『赤血球』|p=22-24}}</ref>。この胚型赤血球は胎生10週頃には消滅する。ヒトでは胎生5-6週目辺りから肝臓での造血が始まる。この肝臓で始まる造血で生み出される赤血球は成人の赤血球と同じ造血幹細胞から産出され、同じ大きさ・構造であり、赤血球の細胞核は脱核する。この胎児型赤血球はヘモグロビンこそ主として胎児型ヘモグロビンで成体型とは違うものの出生後の造血に直接繋がるものであってこれを二次造血という。肝臓での造血は3-6ヶ月頃は造血の中心であり、胎生6-7ヶ月で肝臓での造血はピークに達する。また脾臓での造血も加わる。これらの肝臓・脾臓での造血はピークを迎えた後に減少し出生時には終了する。骨髄での造血は胎生4ヶ月頃から始まり徐々にその役割を増していく。6-7ヶ月以降は骨髄が造血の中心となり出生時には唯一の造血器官となる{{sfn|『三輪血液病学』|p=2-4,23-25,31}}。胎児の赤血球では妊娠のごく初期には胚型ヘモグロビンを含むが、まもなく胎児の赤血球は胎児型ヘモグロビン (HbF) を含むようになる。妊娠期間の大部分では胎児の赤血球のヘモグロビンは胎児型ヘモグロビン (HbF) が大半を占め、成体型ヘモグロビン (HbA) はわずかであるが、出生が近づいていくにつれ成体型ヘモグロビン (HbA) は急激に割合を増していく<ref name="西田朗">西田 朗「赤ちゃんは胎外の高酸素環境にどのように適応しているの?」『周産期医学』Vol.31 No.7、周産期医学編集委員会 編、東京医学社、2001年、pp872-874</ref><ref name="荻田幸雄">荻田幸雄、「[http://mol.medicalonline.jp/archive/search?jo=ae4sanke&ye=1976&vo=43&issue=4 HbF(ヘモグロビンF)]」『産科と婦人科』Vol.43 No.4 p.413-415、診断と治療社、1976年 (有償閲覧)</ref>。妊娠中期にはヘモグロビンのほとんどを占めていた HbF は、出生時にはヘモグロビンの60-80%になり{{sfn|三輪史朗 監修ほか|1998|p=119}}、あるいは別の資料では妊娠末期の臍帯血のヘモグロビンでは平均で83%が HbF であるとされるが<ref name="荻田幸雄"/>、出生後には急激に HbA に置き換わっていき、生後6ヶ月では HbF は3%程度まで減り、成人のヘモグロビンでは HbA が97%、HbA2 が2%、HbF は1%以下の割合になる{{sfn|三輪史朗 監修ほか|1998|p=119}}。HbF は HbA より高い酸素親和性を持ち、胎内での低い酸素濃度下での酸素運搬に適している(HbA は酸素濃度の高い環境(肺呼吸)での酸素運搬に適している)<ref name="小林・今井">小林道頼、今井清博「ヘモグロビンの酸素平衡特性に秘められた意義-成人と胎児を比べて」『日本生理学雑誌』Vol.59 No.10、日本生理学会、1997年、pp.439-444</ref>。 |
|||
==== エリスロポエチン ==== |
|||
{{main|エリスロポエチン}} |
|||
[[骨髄]]では1日あたり2000億個弱の赤血球を生み出すが、骨髄にはこれの3-5倍の赤血球産出能力があり、[[貧血]]などで低酸素状態になると赤血球の産出は盛んになる<ref name="朝倉1559" />。[[造血幹細胞]]から赤血球などの血液細胞の分化・増殖には40種類以上の因子が関わるが、とくに赤血球の増殖には[[エリスロポエチン]] (EPO) が大きく関わる{{sfn|小川 ほか『内科学書』|p=8}}。エリスロポエチンは分子量約34kDa の糖蛋白質であり主に[[腎臓]](一部は[[肝臓]])で産出される{{sfn|三輪史朗 監修ほか|1998|p=24}}{{sfn|『三輪血液病学』|p=244-245}}。貧血や慢性の肺疾患、空気の薄い高地での生活などで慢性の低酸素状態になると腎臓ではエリスロポエチンを盛んに産出するようになる。赤血球の造成の途中の段階である CFU-E(後期赤血球系前駆細胞)は非常にエリスロポエチンの感受性が高くエリスロポエチンを受け取ると細胞分裂能を高め、赤血球の数的増加に結びつく。やがて赤血球の数量が増え、[[貧血]]などの低酸素状態が改善されると腎臓ではエリスロポエチンの産出が減少し、したがって骨髄での赤血球産出も落ち着くようになる{{sfn|『三輪血液病学』|p=244-245}}。しかし慢性腎不全などで腎臓の機能が低下している患者では EPO の産出が減り、貧血になっても赤血球の産出が亢進されず貧血が改善されない{{sfn|『三輪血液病学』|p=971}}。 |
|||
=== 破壊 === |
|||
赤血球は血液中で約120日働くと老化し、老化した赤血球は脾臓でマクロファージに捕捉・貪食され分解される。分解された赤血球の構成材のアミノ酸の多くや鉄は回収され再利用されるが、ヘムの分解代謝物である[[ビリルビン]]は胆汁もしくは尿として排出される。 |
|||
赤血球が老化すると嫌気性解糖系のエネルギー産出が衰え、そのために細胞膜上の Na{{sup|+}}, K{{sup|+}} ATPaseタンパク質や Ca{{sup|2+}} ATPaseタンパク質が働かなくなりイオンバランスが崩れるため細胞質は水分が減少し赤血球の変形能も衰えてくる。すると老化赤血球は脾臓や肝臓・骨髄の血管内に張り巡らされている網内系と呼ばれる血管内腔を覆う細網細胞と付随する細網線維による網目構造状の組織につかまるが、そこには老化赤血球を捕捉・貪食するマクロファージが待ち構えている{{Cite journal|和書 |title=細胞の脂質過酸化と老化 |author=別府正敏 |author2=菊川清見 |year=1995 |journal=油化学 |volume=44 |issue=10 |pages=738-750 |doi=10.5650/jos1956.44.738 |url=https://doi.org/10.5650/jos1956.44.738 |ref={{harvid|別府|菊川|1995}}}}{{sfn|八幡『細胞膜のしくみ』|p=158-162}}。 |
|||
赤血球の細胞膜に存在する膜縦貫タンパク質であるバンド3 は若い赤血球では間隔を空けて存在し、バンド3 から赤血球表面に露出している糖鎖には、それに対応する自然抗体(抗バンド3IgG抗体)が存在するが、この自然抗体はバンド3 の糖鎖が十分な間隔を置いている場合(単独の糖鎖)には親和性が低く結合することができない。しかし、赤血球が老化してくるとヘモグロビンの酸化物(この酸化物は、ヘムに酸素を取り入れたオキシヘモグロビンではない)が増え、ヘモグロビン酸化物はバンド3 [[細胞質|の細胞質側に結合する]]。さらにバンド3に結合したヘモグロビンの酸化物はお互いに架橋し、バンド3 を凝集させる。バンド3 が凝集すると細胞表面の糖鎖も凝集し、凝集した糖鎖は抗バンド3IgG抗体との親和性が高いので抗体が結合することができるようになる。脾臓には抗バンド3IgG抗体に対するレセプターを持つマクロファージが存在し、凝集糖鎖に抗バンド3IgG抗体が結合した老化赤血球はマクロファージに容易に認識・捕捉されるようになる。このような過程で老化した赤血球は取り除かれると考えられている{{sfn|別府|菊川|1995}}{{sfn|三輪史朗 監修ほか|1998|p=74-79}}。 |
|||
また、若い赤血球では脂質2重層を構成するリン脂質である[[ホスファチジルセリン]] (PS) は2重層では赤血球膜内面・細胞質側に多く存在するが、赤血球が老化し嫌気性解糖系のエネルギー産出が衰えてくるとホスファチジルセリンを膜内面側に移動させていた酵素flippase の働きも衰えホスファチジルセリンは膜表面に多く現れる。この赤血球膜外面側表面に多く現れたホスファチジルセリンもマクロファージによる貪食の標的になると考えられている{{sfn|別府|菊川|1995}}<ref name="図解分子細胞生物学p7-8" />{{sfn|八幡『細胞膜のしくみ』|p=36-39}}{{sfn|『三輪血液病学』|p=248}}。 |
|||
== 赤血球と臨床 == |
|||
=== 赤血球に関する基準値 === |
|||
赤血球に関する一般的な項目の基準値<ref group="注">研究機関・検査施設ごとに多少の基準値設定の差はある。</ref><ref name="小川血液学p23"/>を挙げる。 |
|||
* 赤血球数 男性420-554万個/[[マイクロ|µ]]L 女性384-488万個/[[マイクロ|µ]]L |
|||
* ヘモグロビン濃度 (Hb) 男性13.8-16.6g/[[デシ|d]]L 女性11.3-15.5g/[[デシ|d]]L(基準下限値を下回ると貧血とされる) |
|||
* [[ヘマトクリット]](Ht:赤血球容積率)男性40.2-49.4% 女性34.4-45.6%(血液の濃さであり、貧血で数字は小さくなる) |
|||
* [[平均赤血球容積|MCV]](赤血球1個の容積)76-96[[フェムト|f]]L(赤血球の大きさであり、ヘマトクリット÷赤血球数で求められる。鉄欠乏性貧血では小さくなる) |
|||
* [[平均赤血球血色素量|MCH]] ([[:en:mean corpuscular volume|en]])(赤血球1個あたりのヘモグロビン量)27-35[[ピコ|p]]g(ヘモグロビン濃度÷赤血球数で求められる) |
|||
* [[MCHC]] ([[:en:Mean corpuscular hemoglobin concentration|en]])(赤血球容積に対するヘモグロビン量)29.7-34.7g/[[デシ|d]]L(ヘモグロビン濃度÷ヘマトクリットで求められる)<ref name="朝倉1558" /> |
|||
* [[比重]] 1.090-1.120 (血漿の比重は1.024-1.030なので、試験管の中で長時間放置、あるいは遠心分離を行うと下に沈殿する)<ref name="スタンダード検査血液学p5">日本検査血液学会『スタンダード検査血液学』初版p.5</ref> |
|||
* [[ヘモグロビンA1c]](グリコヘモグロビン)4.3%-5.8%(ヘモグロビンに[[グルコース]]([[血糖値|血糖]])が結び付いたものであり糖尿病で高値になる)<ref group="注">赤血球の30日から120日の寿命の間中に赤血球内のヘモグロビンはグルコース(血糖)と結びついていくが、その反応は緩徐的(ゆっくり)で非酵素反応のため、一時的なグルコース濃度の変化やグルコース以外の要素の影響を受けにくく、Hb 中の HbA1c の割合は過去1 - 3か月のグルコース濃度(血糖値)の平均に相関することが分かっている。血中にはグルコースは必ずあるため健康人でもヘモグロビンの4.3%-5.8%は HbA1c であるが、血中の血糖値が長期間の平均で高いほど HbA1c も高値になり、糖尿病では6.5%以上の高値になる{{harv|日本薬学会.HbA1c}}</ref> |
|||
=== 血液型 === |
|||
{{main|血液型}} |
|||
'''赤血球'''の表面には250種以上の表面[[抗原]]があるが、A/B型抗原はその代表的な抗原である。赤血球の表面にA抗原があるとA型、B抗原があるとB型、AとB、両方の抗原があるとAB型、両抗原がないとO型とする{{sfn|小川 ほか『内科学書』|p=49}}。逆に血漿中には各抗原に反応する抗体があり、通常A型の血漿中には抗B抗体があり、B型の血漿中には抗A抗体があり、AB型の血漿中には抗A抗体も抗B抗体のどちらもなし、O型の血漿には抗A抗体と抗B抗体両方が存在する{{sfn|小川 ほか『内科学書』|p=49}}(血漿中の抗体を調べることで血液型を判定することを裏試験ともいう{{sfn|小川 ほか『内科学書』|p=49}})。 |
|||
表面抗原に、それぞれ対応する抗体が反応すると赤血球は凝集してしまう。 |
|||
=== 重要な栄養素 === |
|||
他の細胞と同様に、赤血球は、[[水]]や[[タンパク質]]あるいは[[脂質]]といった物質から構成されている。一方で一部の微量な栄養素が、赤血球を生成する上で重要な役目を担っているとされる。特に体内で合成することのできない[[鉄]]、[[ビタミンB12]]、および[[葉酸]]は臨床上重要な栄養素とされる。 |
|||
成人の体内には 3-4g の鉄があるがその2/3はヘモグロビンの構成材として赤血球中にあり、古くなった赤血球は[[脾臓]]や肝臓で壊されるが、その際に鉄は回収され、失われるのは1日あたり数mg に過ぎない<ref name="朝倉1563">杉本『内科学』p.1563</ref>。しかし、出血などで鉄を多く失うとヘモグロビンの合成に必要な鉄分が不足し、一般的には鉄欠乏性貧血の典型として赤血球は小型であったり低色素型になる<ref>塩崎宏子,泉二登志子、「[https://doi.org/10.2169/naika.99.1213 鉄欠乏性貧血の検査と診断]」 日本内科学会雑誌 2010年 99巻 6号 p.1213-1219, {{doi|10.2169/naika.99.1213}}</ref>。 |
|||
ビタミンB12 はコバルトを含むビタミンの総称で、ある種のバクテリアしか生産することはできないが、食物連鎖によって動物は十分な量の B12 を体内に持っており、ヒトも肉類、魚類、乳製品などの動物性食品を食することで B12 を取り入れるので普通の状態では体内に数年分の量の B12 を貯えている。B12 は食物ではタンパク質と結び付いているが、胃酸によってタンパク質から遊離し、胃壁から分泌される内因子 (IF) と B12 とが膵液の作用によって結び付くことで B12 は回腸から吸収されるようになる。したがって胃の切除者、萎縮性胃炎での内因子分泌障害(悪性貧血)などで内因子が不足したり、あるいは腸の吸収障害、あるいは極端な菜食主義者などでは数年ののちに B12 は不足する。B12 が不足すると細胞の DNA の合成が障害されて、赤血球系造血では巨赤芽球(その名の通り巨大な赤芽球)が産生され、それは正常な赤血球に分化できないため無効造血となり[[巨赤芽球性貧血]]に陥る{{sfn|『三輪血液病学』|p=184-186,974-977}}。 |
|||
葉酸はレバー、緑黄色野菜、果物などに含まれている水溶性ビタミンであるが、B12 と共に働いて赤血球の成熟に関わる。通常では葉酸は食物から酵素の働きで空腸から吸収され、体内に数か月分の量が貯えられているが、何らかの理由で不足すると B12 の不足と同様に赤血球は DNA の合成が阻害され、正常な成熟ができずに巨赤芽球性貧血になる{{sfn|『三輪血液病学』|p=189-194}}。 |
|||
=== 赤血球の変形 === |
|||
==== 浸透圧による変形 ==== |
|||
[[File:赤血球浸透圧.png|thumb|320px|血漿の浸透圧による変化]] |
|||
赤血球は外部からの力が掛からずとも、様々な要因で変形することがある。赤血球膜には水分を効率的に輸送する輸送タンパク質アクアポリンがあり、[[浸透圧]]の低い、例えば真水に赤血球を入れると赤血球は水を吸収して膨らみ、赤血球膜が膨張の圧力に耐えられなくなると終いには破裂する(溶血)。逆に濃い塩水中などでは赤血球は水分を失う。人の[[生理食塩水]](等張液)は0.9%だが、正常な赤血球は食塩水では濃度0.5%が溶血するかしないかのギリギリの濃度である。0.48-0.5%で溶血し始め、0.4-0.42%で50%が溶血し、0.33-0.35%ですべて溶血する<ref group="注">数値は文献によって微妙に違い岡田泰伸監訳『ギャノング生理学23版』p.613では0.5%がギリギリの濃度で0.35%ですべて溶血するとし、杉晴夫編著『人体機能生理学』p.305では0.48%で溶血し始め、0.33%で完全に溶血するとしている</ref><ref name="ギャノング生理学23版613">岡田『ギャノング生理学23版』p.613</ref><ref name="杉晴夫305">杉『人体機能生理学』p.305</ref>。遺伝性球状赤血球症などのように赤血球膜に異常があり脆弱であると、膨張に耐える力が弱いためにより容易に溶血する<ref name="ギャノング生理学23版613"/>。 |
|||
==== 疾患による変形 ==== |
|||
ウニ状赤血球または金平糖の様な形状の有棘赤血球は[[解糖系酵素異常症]]や[[尿毒症]]、[[血清βリポ蛋白欠乏血症]]、肝機能障害、便秘や下痢など腸の異常時などに現れ<ref>橋詰 明英, 鈴木 隆一, 横内 久猛 ほか、「[https://doi.org/10.11239/jsmbe1963.28.25 赤血球自動識別アルゴリズムとその評価]」 医用電子と生体工学 1990年 28巻 1号 p.25-32, {{doi|10.11239/jsmbe1963.28.25}}</ref>、涙滴状の赤血球は[[骨髄線維症]]や癌の骨転移で現れる<ref>小松則夫、「[https://doi.org/10.2169/naika.96.1382 真性赤血球増加症]」 日本内科学会雑誌 2007年 96巻 7号 p.1382-1389, {{doi|10.2169/naika.96.1382}}</ref>。各種の溶血性疾患などでは粉々にされ破片となった破砕赤血球が見られ<ref>田中龍二,藤村欣吾,岡田浩佑 ほか、「[https://doi.org/10.11406/rinketsu.20.187 赤血球ピルビン酸キナーゼ欠乏および骨髄細胞染色体異常を伴った急性骨髄性白血病の1例]」 臨床血液 1979年 20巻 2号 p.187-195, {{doi|10.11406/rinketsu.20.187}}</ref>、ある種の遺伝性の貧血病では[[鎌状赤血球症|鎌状赤血球]]が見られる<ref>菊池佑二、「[https://doi.org/10.11262/jpnbr1987.6.1_2 赤血球変形能の測定と環境因子による変化]」 日本バイオレオロジー学会誌 1992年 6巻 1号 p.2-16, {{doi|10.11262/jpnbr1987.6.1_2}}</ref>。赤血球が破裂したり、膜異常などで赤血球が壊れることを溶血と言い、大量に溶血すると貧血を招くばかりでなく、赤血球の内部に高濃度に存在していた[[カリウム]]が放出され一時的に[[高カリウム血症]]になる。元々高カリウム血症の者が大量の溶血を起こすと高カリウム状態が高度になり[[徐脈]]や[[不整脈]]など心臓の異常が出現し最悪死に到る<ref group="注">ただし、実際には正常な血液が採血後に採血管の中で溶血し高カリウム血症状態になることが多く、それを偽性高カリウム血症と言い、この場合は体を流れている血液が高カリウム血症であるわけでないので心配要らないことが多い。急激な上昇や腎疾患でない限り過剰なカリウムは迅速に排出されるが、しかし、原因がはっきりするまでは高カリウム血症は要注意である。また輸血用の血液製剤に含まれる赤血球はある程度は必然的に壊れ、輸血用赤血球製剤は高カリウム状態である。輸血量が多いと一時的に高カリウム血症となるため、急激な輸血は注意が必要である。</ref><ref>[http://merckmanual.jp/mmhe2j/sec12/ch155/ch155i.html メルクマニュアル・カリウム] 2011.05.08閲覧</ref>。さらにヘモグロビンが分解される過程で生じる[[ビリルビン]]によって[[高ビリルビン血症]]となり[[黄疸]]を生じ、特に出生時低体重児では生命の危険を伴うことがある<ref>[https://www.msdmanuals.com/ja-jp/home/23-%E5%B0%8F%E5%85%90%E3%81%AE%E5%81%A5%E5%BA%B7%E4%B8%8A%E3%81%AE%E5%95%8F%E9%A1%8C/%E6%96%B0%E7%94%9F%E5%85%90%E3%81%AB%E3%81%8A%E3%81%91%E3%82%8B%E6%B6%88%E5%8C%96%E7%AE%A1%E3%81%8A%E3%82%88%E3%81%B3%E8%82%9D%E8%87%93%E3%81%AE%E7%95%B0%E5%B8%B8/%E6%96%B0%E7%94%9F%E5%85%90%E9%BB%84%E7%96%B8?ruleredirectid=464redirectid=160 メルクマニュアル・高ビリルビン血症] 2011.05.08閲覧</ref>。 |
|||
{| |
|||
|style="vertical-align: top;"| |
|||
|style="vertical-align: top;"| |
|||
|style="vertical-align: top;"|[[File:Teardrop Cells smear 2009-09-22.JPG|thumb|none|200px|涙滴赤血球]] |
|||
|style="vertical-align: top;"|[[File:Sicklecells.jpg|thumb|none|150px|鎌状赤血球]] |
|||
|} |
|||
=== 赤血球に影響が現れる主な疾患 === |
|||
赤血球に影響が現れる疾患は無数にあるが、その中で成書において赤血球系の疾患として取り上げられた主なものを記す{{sfn|『三輪血液病学』|p=4-5}}。 |
|||
* [[汎血球減少|汎血球減少性疾患]] |
|||
: [[再生不良性貧血]]、[[骨髄異形成症候群]]、[[急性白血病]]など |
|||
* 主に赤血球数もしくはヘモグロビン量が減少する疾患 |
|||
: [[赤芽球癆]]、[[腎性貧血]]、[[巨赤芽球性貧血]]、[[鉄欠乏性貧血]]、[[無トランスフェリン血症]]、[[鉄芽球性貧血]]、[[自己免疫性溶血性貧血]]<ref>近江俊徳, 梶井英治, 小山田隆 ほか、「[https://doi.org/10.3925/jjtc1958.38.601 温式自己免疫性溶血性貧血患者における赤血球結合IgG量の測定とその意義]」 日本輸血学会雑誌 1992年 38巻 5号 p.601-606, {{doi|10.3925/jjtc1958.38.601}}</ref>、[[鎌状赤血球症]]<ref group="注">鎌状赤血球症は遺伝疾患であり、その遺伝子を持つものは本来は生存競争に不利であるが、鎌状赤血球症の赤血球は[[マラリア]]に抵抗性がある。そのため、マラリアの流行地では鎌状赤血球症の遺伝子を持つものが淘汰されずに現代に残っていると考えられている。</ref>、[[サラセミア]]、[[発作性夜間ヘモグロビン尿症]]、[[脾機能亢進症]]など |
|||
* 赤血球数が増加する病気([[多血症]]<ref group="注">多血症も大きく分けると3パターンある。 |
|||
# 赤血球の絶対量は増加していないのだが、血漿が減少するために血液単位量あたりの赤血球量が相対的に増える、脱水やストレス多血症などの相対的多血症 |
|||
# 喫煙者でタバコの煙にふくまれる一酸化炭素がヘモグロビンに強力に結びついてヘモグロビンの機能が低下し酸欠状態になる常習的喫煙者や肺機能障害、酸素の薄い高地での生活、これらは慢性的な酸欠をもたらし、酸欠に反応して腎臓でのエリスロポエチンの産出が増加することで多血症が起きる。あるいはエリスロポエチン産出細胞が腫瘍性の増加をすることで起きる多血症もある。これらの多血症はエリスロポエチン量の増加に赤芽球が反応した多血症である。 |
|||
# 真性多血症などの造血細胞の腫瘍性疾患で赤血球が増えることもある。腫瘍性の増加では腎臓はエリスロポエチンの産出を抑え赤血球数のコントロールを試みるが、腫瘍性の造血細胞はもはやエリスロポエチン量によるコントロールを受け付けず、血中のエリスロポエチン量が低値にもかかわらず赤血球は増加を続ける。</ref>) |
|||
: [[真性多血症]]など |
|||
* 色素代謝異常 |
|||
: [[ポルフィリン症]]、[[メトヘモグロビン血症]]など |
|||
== 赤血球とレオロジー == |
|||
{{See also|レオロジー|ヘモレオロジー|血液サラサラ}} |
|||
[[血液]]の粘稠性(ねばりけ)は、血液中の細胞成分によって規定される。中でも細胞成分の大部分を占める'''赤血球'''は、血液の物性を決定する因子として重要である。一般に[[流体]]の物性を定量化する学問領域を[[レオロジー]]と呼び、血流に関するものは特に'''ヘモレオロジー'''と称される。この節ではヘモレオロジーのうち、赤血球に関する議論を概説する。 |
|||
赤血球は生体では血管という管の中を[[血漿]]という流体に乗って流れ、その形状と柔軟性で肺や組織内の毛細血管を通過し循環しているが、血漿の[[浸透圧]]の低下や赤血球細胞膜の変質、薬剤の影響、各種疾患などで、赤血球形状がコンペイトウ形や球状に変形すると赤血球の変形能が低下して毛細血管を通過しにくくなり、あるいは赤血球が流れにくくなるため血液粘度が上昇し血圧が上昇したり血栓を起こしやすくなったりする{{sfn|『三輪血液病学』|p=49-50}}{{sfn|『血液のレオロジーと血流』|p=18-34}}{{sfn|『三輪血液病学』|p=133-134}}。また逆に浸透圧の上昇や薬剤の影響、各種疾患などで形状が扁平や奇形形状などの形態変化を起こしても赤血球の変形能は低下する{{sfn|『三輪血液病学』|p=49-50}}{{sfn|『血液のレオロジーと血流』|p=18-34}}。 |
|||
[[File:Gray453-ab.png|thumb|210px|左が正常の赤血球 (a)、右は赤血球の連銭形成 (b)。文字通り、コインを積み重ねたように集合している。]] |
|||
また、赤血球表面は[[シアル酸]]で覆われ陰性荷電しているため、赤血球同士は陰性荷電同士が反発し合うので赤血球同士が接着することは通常はない{{sfn|『三輪血液病学』|p=51-53}}。しかし、血管内の低ずり応力領域内では高分子化合物の影響により血液粘度が上昇し、赤血球がコインを積み重ねたような状態(連銭形成、rouleau formation)になることがある{{sfn|『三輪血液病学』|p=51-53}}{{sfn|『血液のレオロジーと血流』|p=6-9,37}}。 |
|||
[[ずり応力]]とは流体力学・ストークスの関係式で説明される力で、円筒管内を流れる流体の速度は管壁近傍では遅く、円筒管中央では早く、またその流速度の変化率は管壁に近いほど大きい。このとき生じる速度差によって生じる力がずり応力である{{sfn|『血液のレオロジーと血流』|p=6-9}}。したがって、流れの遅い血管、あるいは血管の中央付近では赤血球に掛かるずり応力は小さくなり、血管壁付近や血流の早い血管内ではずり応力が大きくなる。ずり応力が小さいと赤血球は集合しやすく、しかし、一旦集合した赤血球もずり応力が大きくなると分離する{{sfn|『三輪血液病学』|p=51-53}}{{sfn|『血液のレオロジーと血流』|p=37}}。 |
|||
{{Squote|'''ストークスの関係式'''<br>いま、半径 ''r''、長さ ''l'' の円筒管内に圧力差 ''ΔP'' で流体を流す。''ΔP'' / ''l'' は圧力勾配になる。流れの方向に円筒管に働く外力(管の両端に働く力の差)は、''πr''{{sup|2}}''ΔP'' である。この流れとは逆方向に、円筒管内の流体の側面に対して接線応力が働いている。この力は、単位面積当りの接線応力(ずり応力 ''τ'')と側面の全面積 (2''πrl'') の積 2''πrlτ'' である。両者の力は釣り合っているので ''πr''{{sup|2}}''ΔP'' = 2''πrlτ'' となる。したがって、ずり応力 ''τ'' は ''τ'' = ''ΔP'' / 2''l'' × ''r'' と表現される。-引用{{harv|『血液のレオロジーと血流』|p=8-9}}}} |
|||
上記で説明されたようにずり応力 ''τ'' は血流が遅いほど、あるいは血管の中心に近いほど小さい。 |
|||
ずり応力が小さくなると赤血球が集合し連銭形成する機序は正確には分かっていないが、血漿中の[[トリグリセリド]](中性脂肪)、[[フィブリノーゲン]]、[[免疫グロブリン]](特に [[IgM]])、その他高分子タンパク質が多いと赤血球は集合しやすい。中でも多発性骨髄腫・原発性マクログロブリン血症などで作られる病的な高分子タンパク質は特に赤血球を集合させることが知られている。また、赤血球の変形能が低下していても集合しやすい{{sfn|『三輪血液病学』|p=51-53}}。血漿中の高分子が多く赤血球の集合の程度が大きいと、血液の粘度が増し血液の流れが滞ってずり応力が小さくなることもあり、するとさらに赤血球が集合してますます血液粘度が上昇するという悪循環に陥ることがある{{sfn|『三輪血液病学』|p=51-53}}{{sfn|『血液のレオロジーと血流』|p=37}}。 |
|||
血液の粘稠性はその人の健康の指標となるとされ、一般に粘稠性が低く流動性が高いほうが好ましいとされる。このことは2000年頃からマスコミでたびたび取り上げられ、いわゆる[[血液サラサラ]]としてブームにもなった。一方でこの分野は研究途上の段階にあり、上述のような異常タンパク質の徴候を除けば、血液サラサラに関する臨床的な意義は明らかになっておらず、日本ヘモレオロジー学会においても共通の見解は未だ得られていない。近年ではこのブームを利用した悪質な業者によって高額な商品を売りつけられるといった事例がいくつか報告されており、[[国民生活センター]]は注意を呼びかけている。 |
|||
== ヒト以外の赤血球 == |
|||
[[File:Humanbood600x.jpg|thumb|210px|ヒトの赤血球、哺乳類の中ではヒトは大き目の赤血球を持つ]] |
|||
[[File:320fishblood600x2.jpg|thumb|210px|サカナの赤血球、上の画像と同じ拡大率である。サカナの赤血球は楕円で有核である。]] |
|||
[[File:320frogblood600x2.jpg|thumb|210px|カエル(両生類)の赤血球、上2枚と同じ拡大率の画像である。カエルの赤血球も楕円で有核であり、非常に大きい。同じ両生類には [[アンフューマ科|Amphiuma means]] の 70 × 45µm のようにカエルよりさらに大きく、人の数百倍大きい赤血球を持つものがいる<ref name="越田p58-59">越田『光学顕微鏡でみる比較動物学』p.58-59</ref>]] |
|||
[[File:Newbloodm.jpg|thumb|様々な脊椎動物の赤血球細胞の比較]] |
|||
=== 脊椎動物 === |
|||
わずかな例外([[ノトテニア亜目]]コオリウオ科)を除き、[[脊椎動物]]は赤血球を持っている{{sfn|『三輪血液病学』|p=2031-2036}}。 |
|||
[[哺乳類]]の成熟した赤血球は[[ヒト]]の赤血球に似ていて無核<ref group="注">例外としてコアラでは赤血球の4から40%程度が核を持つ-Nemi『最新・獣医血液学』p.71。</ref>であり、色は赤く[[ヘモグロビン]]に富み、丸い円盤状である([[ラクダ科]]のみ楕円の円盤であるが、ラクダ科の赤血球もヒトと同様に無核である<ref group="注">1928年までは英米でもラクダ科の赤血球は有核であるとの誤解はあったが、1928年以降にはその誤解は解消している。しかし日本ではその後も何故かラクダ科の動物の赤血球には核があるとの俗説が信じられて書籍にも載り続けている。それらの俗説は実際にラクダの赤血球を観察したものではなく伝聞で書かれているものである。実際にはラクダ科の動物の赤血球も無核である。-山崎英雄「ラクダの赤血球は有核か?」『生物の科学 遺伝』40巻8号、裳華房、1986年、p.78-79を参照、および出典-越田『比較動物学』p.56。ラクダ科の動物の赤血球には核があるとの誤説は広辞苑第5版などにあるが、広辞苑第6版以降は訂正されている。-中山裕之『獣医学を学ぶ君たちへ』東京大学出版会、2019年、p.32</ref>)。ヒトの赤血球と他の哺乳類の赤血球は構造<ref group="注">ただし、哺乳類の赤血球の構造は血液学的にはどれも似ているが、生化学的には、細胞膜のリン脂質の組成は種によって異なり、マウスではホスファチジルコリン (PC) はヒトより多くスフィンゴミエリン (SM) は少ない。逆にウシでは PC はなく SM はヒトより多い。脂質組成の差は膜の透過性に影響する。{{harv|水上『赤血球の生化学』|p=96}}</ref>やヘモグロビン濃度はほぼ同じで基本的には大きさと寿命が違うのみである<ref name="最新獣医血液学p71">Nemi『最新・獣医血液学』p.71</ref>。[[ハツカネズミ属|マウス]]の赤血球はヒトの赤血球の半分程度の大きさであるが、代わりに血液 1µL あたりの赤血球数はおよそ2倍である。哺乳類のなかではヒトの赤血球は比較的大きく、ほとんどの哺乳類では赤血球はヒトのものより小さめであるが、赤血球が小さいものほど代わりに赤血球の数は多く[[ヘマトクリット|赤血球容積率]]はどの哺乳類でも35-50%前後とあまり変わらない{{sfn|『実験動物の血液学』|p=195-197}}{{sfn|『血液のレオロジーと血流』|p=32}}。ゾウの赤血球(直径 9-10µm<ref name="最新獣医血液学p71"/>)はヒトの赤血球 (7-8µm) より大きいが、ヒトより体の大きい[[ウシ]]や[[ウマ]]の赤血球はマウスの赤血球と大きさはあまり変わらなく数は多く、ヤギの赤血球ではヒトの赤血球の1/5程度の体積しかないなど動物種によって様々である{{sfn|『実験動物の血液学』|p=195-197}}{{sfn|『血液のレオロジーと血流』}}。哺乳類の赤血球の寿命はマウスの20-30日からネコの68日、ヤギの125日、ウマの140-150日と広範であるが、どちらかというと体の大きい者の赤血球は寿命が長い傾向がある<ref name="最新獣医血液学p153">Nemi『最新・獣医血液学』p.153</ref>。 |
|||
[[哺乳類]]以外の脊椎動物([[鳥類]]、[[爬虫類]]、[[魚類]]、[[両生類]])の赤血球は楕円で有核であるが、その細胞質はやはりヘモグロビンで充満し色は赤い<ref name="鳥類とエキゾチックアニマルの血液学、細胞診p58-100">Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.58-100</ref>。 |
|||
[[鳥類]]の赤血球はヒトの赤血球よりやや大きく<ref group="注">鳥類の赤血球の大きさは 10.7µm × 6.1µm から 15.8µm × 10.2µm 程度であり、ヒトの赤血球の直径 7-8µm より若干大きめである。-Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.8- ただし、シジュウカラの仲間[[カロライナチカディ]]のように1µm程度の極小さい赤血球を持つ例外もいる-越田『光学顕微鏡でみる比較動物学』p.58-59</ref>、細胞も核も楕円であるがその形状は滑らかであり、数はやや少ないが大きな差はない。鳥類の赤血球のヘモグロビン濃度は濃く、また[[ヘマトクリット|赤血球容積率]]も35-55%と鳥類の赤血球は形と核の有無以外は哺乳類と大差はない<ref name="鳥類とエキゾチックアニマルの血液学、細胞診p8">Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.8</ref>。ただし、鳥類のヘモグロビンは哺乳類のものとグロビンの構造が異なり、酸素解離曲線が哺乳類より右方変異しており筋肉などの組織内で酸素を遊離しやすくなっている。鳥類の赤血球の寿命は短く1か月前後である<ref name="鳥類とエキゾチックアニマルの血液学、細胞診p8"/>。鳥類の赤血球造血もエリスロポエチンに反応し<ref name="鳥類とエキゾチックアニマルの血液学、細胞診p8"/>、その成熟過程は核が脱核しないこと以外はヒトの赤血球の成熟過程に似ている<ref name="越田p58-59">越田『光学顕微鏡でみる比較動物学』p.58-59</ref>。 |
|||
[[魚類]]の赤血球もヒトのものより数は少なくやや大きい。両生類の赤血球はとても大きく数は少ない。爬虫類は両生類と鳥類の間にある{{sfn|『実験動物の血液学』|p=195-197,13-19}}<ref name="鳥類とエキゾチックアニマルの血液学、細胞診">Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.58-100</ref>爬虫類、両生類、魚類の赤血球も細胞質にはヘモグロビンがあり赤いが、哺乳類や鳥類に比べて両生類と魚類の赤血球細胞質のヘモグロビン濃度は薄く [[MCHC]] はコイで 20.5g/dL、カエルで 26-28g/dL 程度であり{{sfn|『三輪血液病学』|p=2031-2036}}、また爬虫類や両生類、魚類の赤血球細胞核はいびつなことが多い<ref name="越田p58-59"/>。 |
|||
造血の場は哺乳類と鳥類では主に骨髄、魚類では主に腎臓、両生類では脾臓である。爬虫類は種によってさまざまである{{sfn|『三輪血液病学』|p=2031-2036}}{{sfn|『実験動物の血液学』|p=13-19}}。 |
|||
=== 無脊椎動物 === |
|||
[[無脊椎動物]]ではある程度の体の大きさを持っているものは白血球に相当する細胞を持っているが、赤血球を持っているものは極めて少なく例外的な存在とも言える<ref group="注">極めて古い1954年の資料ではあるが、百万とも、あるいはそれ以上とも言われる無脊椎動物全種の中で赤血球を持っている種の数を100種程度としている。-出典 岡田『生物学実験法講座 第8巻 A』p.31-33</ref>。その赤血球を持つ例外的な無脊椎動物はアカガイやシャミセンガイ、ホウキムシ、ホシムシなどすべて海棲であり、特に種類が多い昆虫類を含め陸上の無脊椎動物には赤血球を持つものはいない<ref name="越田p58-59"/><ref name="生物学実験法講座">岡田『生物学実験法講座 第8巻 A』p.31-33</ref>。その無脊椎動物の赤血球は脊椎動物の赤血球とはずいぶん異なる面が多く、その一つの特徴は核の他に何らかの顆粒が細胞質にあることであり、またそれ以外にも種によっては以下のような特徴がある<ref name="生物学実験法講座"/>。 |
|||
* [[シロナマコ]]の赤血球は数本の突起があり、核以外にも目立って大きい数個の顆粒がある。 |
|||
* [[ユムシ]]や[[アカガイ]]の赤血球では顆粒の数は数十個に及ぶ。 |
|||
* [[タマキガイ]]の赤血球には複数の核がある。 |
|||
* [[星口動物]](ホシムシ)の赤血球には数個の六面体の結晶が存在する。 |
|||
ホシムシ類の赤血球には[[ヘムエリスリン]]、それ以外にはヘモグロビン<ref group="注">[[アカガイ]]などは[[エリスロクルオリン]]を持つが、参考にした岡田『生物学実験法講座 第8巻 A』p31-33は古い資料でありエリスロクルオリンはヘモグロビンの近縁として同一視していると思われる。</ref>が存在する<ref name="生物学実験法講座" />。 |
|||
これらのわずかな例外を除くほとんどの無脊椎動物は赤血球を持たない。無脊椎動物の多数を占める赤血球を持たない者の血液では[[ヘモグロビン]]、[[エリスロクルオリン]]、[[ヘムエリスリン]]や[[ヘモシアニン]]などの[[血色素]]が直接血漿に溶け込んで循環し酸素供給している。血が赤くない[[軟体類]]や[[節足動物]]などの動物の多くではヘモグロビンではなく[[銅]]を用いた[[ヘモシアニン]]で酸素を運ぶため血液は青みがかかっている{{sfn|『三輪血液病学』|p=2031-2036}}<ref name="鳥類とエキゾチックアニマルの血液学、細胞診" />{{sfn|『実験動物の血液学』|p=5-7}}。 |
|||
このように様々な動物が赤血球を持ち無脊椎動物の中にも赤血球を持つものがおよそ100種類程度いるが、無脊椎動物の赤血球は種によって様々であり、いずれの赤血球も脊椎動物の赤血球とは異なる点が多い。無脊椎動物の赤血球は同時に白血球としての機能を持つものが多く、その細胞質でも血色素は顆粒内にある。赤血球を持つ無脊椎動物は様々な[[門 (分類学)|門]]に点々と分かれて存在し、例えば同じ二枚貝の仲間でも赤貝は赤血球を持ち他の二枚貝の多くは赤血球を持っていないなどであり<ref name="素顔の赤血球p.122-124">森岡清和 著『素顔の赤血球』p.122-124</ref>、さらに無脊椎動物の中で進化の上では脊椎動物に近い[[ホヤ]]類には赤血球を持つものはおらず<ref name="動物の血液細胞p.129">和合『動物の血液細胞と生体防御』p.129</ref>、またホヤ類に次いで脊椎動物に近い[[棘皮動物]]にも赤血球を持つものはほとんどいない<ref name="素顔の赤血球p.122-124"/>。これに比べて脊椎動物の赤血球には白血球の機能はなく細胞質には均質にヘモグロビンが満ちている{{sfn|『実験動物の血液学』|p=5-7}}。これらのことなどから脊椎動物の赤血球と無脊椎動物の赤血球には進化の上での繋がりのある可能性は低いと考えられている<ref name="素顔の赤血球p.122-124"/>。 |
|||
無脊椎動物の血色素は様々であるが、脊椎動物の血色素は皆ヘモグロビンであり、脊椎動物で最も原始的な[[無顎類]]の造血は発生学的には[[卵黄嚢]]に近い腸管粘膜下で行われ、どの脊椎動物でも受精卵から発生したばかりでは卵黄嚢で造血が行われその後に造血の場を変えていくので、脊椎動物の赤血球は脊椎動物の登場と共に現れ進化してより洗練されて行ったのだという可能性がある。最も進化した哺乳類において、赤血球も酸素運搬には不要な核を捨てて酸素輸送に特化するなどさらに進化をした可能性があり<ref name="素顔の赤血球p.122-124"/>、酸素運搬の観点からは哺乳類の赤血球が最も進化し、比較的下等なものほど酸素運搬には非効率的なものが多いので進化が遅れていると思われるが、それ以上の赤血球の進化については確実なことは分かっていない。 |
|||
== 赤血球の発見と研究史 == |
|||
[[ファイル:Leeuwenhoek Microscope.png|thumb|200px|初期のレーウェンフックの顕微鏡(複製) 金属板にはめ込まれた小さなガラス球がレンズである。試料はねじの先の針の先端に取り付け、ネジで位置を微調節した。レーウェンフックは生涯に500もの顕微鏡を作ったが、最高倍率は270倍にもなっていた。]] |
|||
赤血球の発見は[[顕微鏡]]の発明によってもたらされた。古代から凸レンズを使えば物を拡大して見られることは知られていたが、1590年代に[[サハリアス・ヤンセン|ヤンセン父子]]によって二枚のレンズを使った現代の顕微鏡の祖となる最初の複式顕微鏡が発明された<ref group="注">この発明の記録には異論もある。-田中『顕微鏡の歴史』p.19-26</ref>。しかし、この17世紀中の複式顕微鏡は収差が大きく性能が低く、17世紀中はレンズが一枚の単式顕微鏡が性能を上げ大きな成果を上げていた<ref name="顕微鏡の歴史p.19-26">田中『顕微鏡の歴史』p.19-26</ref>。 |
|||
1658年、オランダの[[ヤン・スワンメルダム|スワンメルダム]]はその単式顕微鏡でカエルの赤血球を初めて観察し、さらに1660年に[[マルチェロ・マルピーギ|マルピーギ]]が毛細血管の血球の循環を観察した<ref name="顕微鏡の歴史p.19-26"/>。これらの観察はラフなものであったが<ref group="注">スワンメルダムらの報告は「赤い小球体」を見たことを報告したのみであり、赤血球の真の発見者はレーヴェンフックであると考える研究者もいる。-マックスウェル・M.ウイントローブ著『顕微鏡の歴史』西村書店、1981年 p.7-9</ref>、1674年[[アントニ・ファン・レーウェンフック|レーヴェンフック]]は単レンズの単式顕微鏡としては最高度の性能の顕微鏡<ref group="注">後年の検証では分解能が3.5µm、あるいは検証者によっては 1µm に達していたと言われる-田中『顕微鏡の歴史』p.31-34</ref>を自作し、ヒトの赤血球を観察して大きさが 8.5µm の円盤状であると報告している<ref group="注">レーヴェンフックはスワンメルダムらの観察を知らなかったため、独力での発見である。ただし、レーヴェンフック自身は赤血球は本来は球状であると信じていたため、円盤状になっているのは観察時に何らかの要因で変形したのだと思っていた。</ref><ref name="顕微鏡の歴史p.19-26">田中『顕微鏡の歴史』p.19-26</ref>。またレーヴェンフックは、哺乳類の赤血球は円盤状であるが哺乳類以外の動物の赤血球は卵型であることも発見している<ref name="世界の顕微鏡の歴史p160">小林『世界の顕微鏡の歴史』p.160</ref>。 |
|||
その後、1747年に[[ヴィンチェンツォ・メンギニ|メンギニ]]が赤血球は鉄を含むことを磁石を用いて発見し、1774年[[ジョゼフ・プリーストリー|プリーストリー]]は赤血球が酸素に反応することを観察し、1780年ラヴォアジエとラプラスは赤血球が酸素を運搬することを明らかにしている{{sfn|水上『赤血球の生化学』|p=2}}。 |
|||
1825年ライヘルトによって結晶化に成功したヘモグロビンは、1865年 [[フェリクス・ホッペ=ザイラー|ホッペ=ザイラー]]によって研究されている{{sfn|水上『赤血球の生化学』|p=2}}。ABO型の血液型は1900年に [[カール・ラントシュタイナー|ラントシュタイナー]]によって発見されたが、当初ラントシュタイナーは A, B, C の3型に分類し1901年の発表論文では A, B, O の3分類、1902年に共同研究者らと現在の A, B, O, AB型に分類し直している{{sfn|水上『赤血球の生化学』|p=104}}<ref>[https://sites.google.com/site/abobloodgroupjpn/jp03-randoshutainaniyoru-aboketsueki-gata-no-hakken ABO血液型の分子遺伝学] 2011.05.07閲覧</ref>。1904年デンマークの [[クリスティアン・ボーア|ボーア]]は赤血球の酸素の結合と遊離と二酸化炭素の関係を調べて酸素解離曲線を示し、二酸化炭素の存在によって赤血球のヘモグロビンと酸素の結合し易さが変化することを発見した([[ボーア効果]]){{sfn|水上『赤血球の生化学』|p=26-28}}。 |
|||
1933年ロートンらが赤血球内に炭酸脱水酵素を発見し{{sfn|水上『赤血球の生化学』|p=28-29}}、1948年 [[フレデリック・サンガー|サンガー]]と[[ロドニー・ロバート・ポーター|ポーター]]はヘモグロビンの構造研究の開始し、1961年[[マックス・ペルーツ|ペルーツ]]はヘモグロビンの立体構造を解析した{{sfn|水上『赤血球の生化学』|p=21}}。 |
|||
1967年[[アルフレッド・チャヌタン|チャヌタン]]は赤血球に含まれる DPG([[2,3-ビスホスホグリセリン酸]])の量の変化によっても酸素解離曲線が移動することを発見した{{sfn|水上『赤血球の生化学』|p=34}}。 |
|||
赤血球を真水に入れると溶血し細胞膜が得られるので、細胞膜の存在自体は早くから知られていたが、当初は赤血球細胞膜については何も理解されていなかった。1935年[[ヒュー・ダブソン|ダブソン]]らは細胞膜のリン脂質二重層構造を提唱し、1966年[[シーモア・ジョナサン・シンガー|シンガー]]と[[ガース・ニコルソン|ニコルソン]]によって現在の知られている膜構造の[[流動モザイクモデル]]の基本モデルが提案されるようになった。さらに1970年代以降電子顕微鏡の発達で赤血球膜の微細構造は次々に明らかになっている<ref name="赤血球膜研究史p13-14">八幡『赤血球膜研究史』p.13-14</ref>。 |
|||
== 人工赤血球 == |
|||
[[File:二重層・リポソーム・ミセル.png|thumb|210px|リン脂質分子は自発的に集合し、二重層、あるいは[[リポソーム]]、[[ミセル]]を形成する。図はそれぞれを切断した図である。人工赤血球ではリポソームの内部にヘモグロビンを封入する。]] |
|||
大怪我などで大量に出血すると人は生命の危険があり、緊急に[[輸血]]を行わないとならないが、血液はいつどこでも十分な量を確保できるとは限らない。そのため、救急用に人工赤血球の開発の必要は昔から指摘されていた。古くは欧米にて[[ヘモグロビン]]を加工したものを血液に流せないか研究が進められていたが、剥き出しのヘモグロビンの毒性<ref group="注">血管は少量の一酸化窒素 (NO) の存在によって弛緩し拡張するが修飾Hb(ヘモグロビンそのものあるいは重合化など加工されたヘモグロビン、ここで言う剥き出しのヘモグロビン)は一酸化窒素 (NO) との高い親和度を持ち血管内皮から一酸化窒素 (NO) を奪い去ってしまうため、血管収縮による血圧の異常亢進や心筋梗塞があり、死亡率が明らかに高くなることが分かっている。-石塚「人工酸素運搬体の開発の現状」。余談になるが、体内で一酸化窒素 (NO) に変換される硝酸薬ニトログリセリンが狭心症の特効薬になるのは一酸化窒素 (NO) の血管拡張作用のためである。-出典、高久『新臨床内科学』p.243</ref>を除去することは困難であり、1製品が南アフリカで承認されたものの安全性と有用性に疑問が持たれ主要国では実用化の目途は立っていない。そのため、現在ではヘモグロビンを内包した小胞体の開発が行われている<ref name="石塚・人工">石塚「人工酸素運搬体の開発の現状」</ref><ref name="ICU">武田『人工赤血球のICU使用を目的とした最適化およびME技術の改良』p.1-2</ref><ref name="酒井">酒井「ヘモグロビン小胞体の開発の歴史と現状」</ref>。 |
|||
リン脂質分子は自発的に[[赤血球#赤血球細胞膜|二重層]]、あるいはリポソーム、ミセルの形状に並ぶので、リポソームの内側にヘモグロビンを封入すれば酸素運搬能力を持たせることができ、またヘモグロビンの毒性も閉じ込めることができる<ref name="ICU" /><ref name="酒井" />。 |
|||
2010年現在では赤血球の数十分の一の大きさ(直径数百ナノメートル程度)のリポソーム内に(輸血に使用されなかった廃棄血液から抽出した)ヘモグロビンを封入したヘモグロビン小胞体が動物実験で短期的には効果を認められるところまで開発が進んでいる<ref name="ICU" /><ref name="堀之内">堀之内「Hb小胞体の動物投与の成績」</ref>。 |
|||
{{Clear}} |
|||
== 脚注 == |
|||
{{脚注ヘルプ}} |
|||
=== 注釈 === |
|||
{{Notelist2|2}} |
|||
=== 出典 === |
|||
{{Reflist|20em}} |
|||
== 参考文献 == |
|||
; 書籍 |
|||
:* 浅島誠、駒崎伸二 共著『図解分子細胞生物学』裳華房、2010年、ISBN 978-4-7853-5841-9 |
|||
:* {{Cite book|和書 |author=浅野茂隆 |author2=池田康夫 |author3=内山卓 |title=三輪血液病学 |series= 第3版 |publisher=文光堂 東京 |year=2006 |isbn=978-4830614194 |ref={{harvid|『三輪血液病学』}}}} |
|||
:* エヌ・ティー・エス編『幹細胞の分化誘導と応用』エヌ・ティー・エス、2009年、ISBN 978-4-86043-160-0 |
|||
:* 岡田泰伸 監訳『ギャノング生理学』原書23版、丸善、2011年、ISBN 978-4-621-08319-2 |
|||
:* 岡田弥一郎 編『生物学実験法講座』 第8巻 A-体液生理実験法、中山書店、1954年 |
|||
:* {{Cite book|和書 |author=小川聡 |author2=伊藤裕 |author3=塩沢昌英 |title=内科学書 |series=Vol.6 |publisher=中山書店 |year=2009 |edition=改訂第7版 |isbn=9784521731735 |id={{国立国会図書館書誌ID|000010602718}} |ref={{harvid|小川 ほか『内科学書』}}}} |
|||
:* 小川哲平、大島年照、浅野茂隆 編著『血液学』、中外医学社、1991年、ISBN 978-4-498-02544-8 |
|||
:* 越田豊、常木和日子 共著『光学顕微鏡でみる比較動物学』培風館、1994年、ISBN 4-563-07730-5 |
|||
:* 小林義雄 著『世界の顕微鏡の歴史』1980年 |
|||
:* {{Cite book|和書 |author=菅原基晃 |author2=前田信治 |title=血液のレオロジーと血流 |publisher=コロナ社 |year=2003 |series=ME教科書シリーズ ; B-7 |id={{国立国会図書館書誌ID|000004072400}} |isbn=9784339071474 |ref={{harvid|『血液のレオロジーと血流』}}}} |
|||
:* 杉晴夫 編著『人体機能生理学』改訂第5版、南江堂、2009年、ISBN 978-4-524-25364-7 |
|||
:* 杉本恒明、矢崎義雄 総編集『内科学』第9版、朝倉書店、2007年、ISBN 978-4-254-32230-9 |
|||
:* {{Cite book|和書 |author=関正利 |title=実験動物の血液学 |publisher=ソフトサイエンス社 |year=1981 |id={{NDLJP|12652658}} |doi=10.11501/12652658 |ref={{harvid|『実験動物の血液学』}}}} |
|||
:* 高久史麿 ほか監修『新臨床内科学』第9版、医学書院、2009年、ISBN 978-4-260-00305-6 |
|||
:* 田中新一 著『顕微鏡の歴史』九州文庫出版社、1979年 |
|||
:* 武田純三 ほか著『人工赤血球のICU使用を目的とした最適化およびME技術の改良 : 平成21年度総括・分担研究報告書 : 厚生労働科学研究費補助金政策創薬総合研究事業』 |
|||
:* 寺野彰 総編集『シンプル内科学』南江堂、2008年、ISBN 978-4-524-22344-2 |
|||
:* 中山裕之『獣医学を学ぶ君たちへ』東京大学出版会、2019年、ISBN 978-4-130-72066-3 |
|||
:* 日本検査血液学会 編『スタンダード検査血液学』初版、医歯薬出版、2003年、ISBN 4-263-22271-7 |
|||
:* 日本生化学会 編『新生化学実験講座 6(上)』生体膜と膜輸送、東京化学同人、1992年、ISBN 4-8079-1071-X |
|||
:* {{Cite book|和書 |author=野村武夫 |author2=古澤新平 |author3=長尾大 |title=赤血球 |publisher=中外医学社 |year=1994 |series=図解血球-生理・病態・臨床 |isbn=4498025547 |url=https://ndlsearch.ndl.go.jp/books/R100000002-I000002356679 |ref={{harvid|野村 ほか『赤血球』}}}} |
|||
:* {{Cite book|和書 |author=水上茂樹 |title=赤血球の生化学 |publisher=東京大学出版会 |year=1993 |edition=第2版 |series=UP biology |id={{国立国会図書館書誌ID|000002283819}} |isbn=4130632094 |ref={{harvid|水上『赤血球の生化学』}}}} |
|||
:* {{Cite book|和書 |author=藤井寿一 |author2=高桑雄一 |author3=三輪史朗 |author4=中畑龍俊 |year=1998 |title=赤血球 |publisher=医学書院 |isbn=4260109464 |id={{国立国会図書館書誌ID|000002732136}} |ref={{SnfRef|三輪史朗 監修ほか|1998}}}} |
|||
:* 三輪史朗、渡辺陽之輔共著『血液細胞アトラス』第5版、文光堂、2004年、ISBN 978-4-8306-1417-0 |
|||
:* 森岡清和 著『素顔の赤血球』金原出版、1994年、ISBN 4-307-50513-1 |
|||
:* 八幡義人 著『赤血球膜研究史』医薬ジャーナル社、2007年、ISBN 978-4-7532-2238-4 |
|||
:* {{Cite book|和書 |author=八幡義人 |title=細胞膜のしくみ : 構造と機能 |publisher=裳華房 |year=2008 |series=ポピュラーサイエンス |isbn=9784785387846 |url=https://ndlsearch.ndl.go.jp/books/R100000136-I1130282268962773376 |ref={{harvid|八幡『細胞膜のしくみ』}}}} |
|||
:* 和合治久 編著『動物の血液細胞と生体防御』菜根出版、1997年、ISBN 4-7820-0133-9 |
|||
:* Geoffrey M.Cooper, Robert E.Hausman 著『クーパー細胞生物学』須藤和夫,他,訳、東京化学同人、2008年、ISBN 978-4-8079-0686-4 |
|||
:* H. Lodish, ほか著『分子細胞生物学』石浦章一他 訳、東京化学同人、2010年、ISBN 978-4-8079-0732-8 |
|||
:* Nemi C.Jain 著『最新・獣医血液学』作野幸孝 訳、LLLセミナー、1996年 |
|||
:* Robert K.Murray, Daryl K.Granner, Victor W.Rodwell著『ハーパー・生化学』上代淑人監訳、丸善、2007年、ISBN 978-4-621-07801-3 |
|||
:* Terry W.Campbell, Christine K.Ellis 著 『鳥類とエキゾチックアニマルの血液学、細胞診』斑目広郎訳、文永堂出版、2010年、ISBN 978-4-8300-3228-8 |
|||
* {{cite web|和書|url=https://www.pharm.or.jp/words/word00213.html |title=HbA1c |publisher=日本薬学会 |accessdate=2024-12-24 |ref={{SfnRef|日本薬学会.HbA1c}}}} |
|||
== 外部リンク == |
|||
* {{Kotobank}} |
|||
* 『[[科学映像館]]』より |
|||
** [https://www.kagakueizo.org/create/yoneproduction/178/ 『赤血球の誕生-エリスロポエチンと造血の場-』(1989年)] - [[キリンビール]]と[[三共 (製薬会社)|三共]](現・[[第一三共]])の企画の下で[[小林米作|ヨネ・プロダクション]]が制作。 |
|||
** [https://www.kagakueizo.org/create/yoneproduction/184/ 『肝臓 生体防御の謎を追って』(1993年)] - 体に侵入してきた異物は、補体や赤血球で捕らえられて[[肝臓]]に流れ込む。ここで、異物を捕らえた赤血球は肝臓の類洞を通過して肝静脈に入る時にはすっかり浄化されているといわれるが、これらは肝臓に備わった防御機能によるという。[[第一製薬]](現・第一三共)と[[東レ]]の企画の下でヨネ・プロダクションが制作。 |
|||
{{Myeloid blood cells and plasma}} |
|||
{{Featured article}} |
|||
{{Normdaten}} |
|||
{{DEFAULTSORT:せつけつきゆう}} |
{{DEFAULTSORT:せつけつきゆう}} |
||
[[Category: |
[[Category:ヒト細胞]] |
||
[[Category: |
[[Category:血液細胞]] |
||
[[Category:呼吸]] |
|||
[[Category:血液学]] |
|||
[[Category:血液]] |
[[Category:血液]] |
||
[[Category:鉄代謝]] |
|||
[[Category:脊椎動物]] |
|||
[[af:Rooibloedsel]] |
|||
[[ar:خلية الدم الحمراء]] |
|||
[[az:Eritrositlər]] |
|||
[[bg:Еритроцит]] |
|||
[[bn:লোহিত রক্তকণিকা]] |
|||
[[bs:Crvene krvne ćelije]] |
|||
[[ca:Glòbul vermell]] |
|||
[[ckb:خڕۆکەی سوور]] |
|||
[[cs:Červená krvinka]] |
|||
[[cy:Cell goch y gwaed]] |
|||
[[de:Erythrozyt]] |
|||
[[dv:ލޭގެ ރަތް ސެލް]] |
|||
[[en:Red blood cell]] |
|||
[[eo:Eritrocito]] |
|||
[[es:Eritrocito]] |
|||
[[et:Erütrotsüüt]] |
|||
[[eu:Globulu gorri]] |
|||
[[fa:گویچه سرخ]] |
|||
[[fi:Punasolu]] |
|||
[[fr:Érythrocyte]] |
|||
[[he:תא דם אדום]] |
|||
[[hi:लाल रक्त कोशिका]] |
|||
[[hr:Eritrociti]] |
|||
[[ht:Globil wouj]] |
|||
[[hu:Vörösvérsejt]] |
|||
[[ia:Erythrocyto]] |
|||
[[id:Sel darah merah]] |
|||
[[io:Eritrocito]] |
|||
[[is:Rauð blóðkorn]] |
|||
[[it:Globulo rosso]] |
|||
[[ka:ერითროციტები]] |
|||
[[kn:ಕೆಂಪು ರಕ್ತ ಕಣ]] |
|||
[[ko:적혈구]] |
|||
[[la:Erythrocytus]] |
|||
[[lt:Raudonasis kraujo kūnelis]] |
|||
[[lv:Eritrocīts]] |
|||
[[mk:Еритроцит]] |
|||
[[ml:അരുണരക്താണു]] |
|||
[[mn:Цусны улаан эс]] |
|||
[[ms:Sel darah merah]] |
|||
[[nds:Root Bloodkörper]] |
|||
[[nl:Rode bloedcel]] |
|||
[[nn:Raud blodlekam]] |
|||
[[no:Rød blodcelle]] |
|||
[[oc:Eritrocit]] |
|||
[[pam:Erythrocyte]] |
|||
[[pl:Erytrocyt]] |
|||
[[pt:Hemácia]] |
|||
[[qu:Puka yawar kawsaykuq]] |
|||
[[ro:Eritrocit]] |
|||
[[ru:Эритроциты]] |
|||
[[sh:Eritrociti]] |
|||
[[simple:Red blood cell]] |
|||
[[sk:Červená krvinka]] |
|||
[[sl:Eritrocit]] |
|||
[[sq:Eritrociti]] |
|||
[[sr:Црвена крвна зрнца]] |
|||
[[su:Sél getih beureum]] |
|||
[[sv:Röd blodkropp]] |
|||
[[ta:இரத்தச் சிவப்பணு]] |
|||
[[te:ఎర్ర రక్త కణం]] |
|||
[[th:เม็ดเลือดแดง]] |
|||
[[tr:Alyuvar]] |
|||
[[ug:قىزىل قان دانىچىلىرى]] |
|||
[[uk:Еритроцити]] |
|||
[[ur:سرخ خونی خلیہ]] |
|||
[[vi:Hồng cầu]] |
|||
[[zh:红血球]] |
|||
[[zh-min-nan:Âng-hoeh-kiû]] |
|||
2024年12月24日 (火) 04:33時点における最新版


赤血球(せっけっきゅう、英: Red blood cell・Erythrocyte)は、血液細胞の1種であり、酸素を運ぶ役割を持つ。本項目では特に断りのない限り、ヒトの赤血球について解説する。
概要
[編集]赤血球は血液細胞の一つで色は赤く[注 1]血液循環によって体中を回り、肺から得た酸素を取り込み、体の隅々の細胞に運び供給する役割を担い、また同様に二酸化炭素の排出も行う。赤血球の内部には鉄を含む赤いタンパク質ヘモグロビンが充満しており、赤血球はヘモグロビンに酸素を取り込む[1]。大きさは直径が7-8µm、厚さが2µm強ほどの両面中央が凹んだ円盤状であり[2]、数は血液1µLあたり成人男性で420-554万個、成人女性で384-488万個程度[注 2][3]で血液の体積のおよそ4-5割程度が赤血球の体積である[4]。標準的な体格の成人であれば全身におよそ3.5-5リットルの血液があるため、体内の赤血球の総数はおよそ20兆個であり、これは全身の細胞数約60兆個[5]の1⁄3である。体内の細胞にくまなく酸素を供給するために膨大な数の赤血球が存在する。骨髄では毎日2000億個弱程度の赤血球が作られている[1]が、その寿命は約120日[6]で、120日の間におよそ20-30万回に渡って体を循環して[注 3]酸素を供給し、古くなると脾臓や肝臓などのマクロファージに捕捉され分解される[7][8]。赤血球は体の隅々の細胞にまで酸素を供給するため、柔らかく非常に変形能力に富み、自分の直径の半分以下の直径の狭い毛細血管にも入り込み通過することができる[9][10]。
赤血球は成熟する最終段階で細胞核やミトコンドリア・リボゾームなどの細胞内器官を遺棄する。酸素の運搬には不要な細胞核や酸素を消費するミトコンドリアを捨て去り、乾燥重量の約9割がヘモグロビンである[8]赤血球はいわばヘモグロビンを閉じ込めた柔軟な袋であり、ヘモグロビンによる酸素運搬に特化した細胞といえる。ミトコンドリアを持たないため、細胞の活動に必要なエネルギーは嫌気性解糖系と呼ばれる酵素によって糖(グルコース)を分解して得る[11]。
構造と機能
[編集]赤血球の役割は酸素と二酸化炭素の運搬であり、その構造は表面の赤血球膜と内部の細胞質に分けられるが、赤血球細胞膜を通して酸素と二酸化炭素が交換され、細胞質のヘモグロビンと酵素の働きで酸素と二酸化炭素は輸送される。
通常の細胞が持つ核などの細胞内器官を捨て去っているため、細胞質は水とヘモグロビンで容積のほとんどを占め、それ以外は解糖系やペントースリン酸経路に関わる酵素、炭酸脱水酵素、グルコース、炭酸、Na+, Ca2+, K+, Cl- などのイオンなどわずかであり[12][13]、正常な赤血球の細胞質には顕微鏡観察で目に付く構造はない[14]。
形状は両面中央が凹んだ円盤状であるが、それは同じ体積の球に比べ表面積が30-40%大きく、その大きな表面積のため酸素・二酸化炭素の交換が球状の場合よりも有利であると考えられている。また赤血球は毛細血管では折り曲げられたり変形したりして通過するが、球に比べて両面が凹んだ円盤状だと体積に比べ表面の赤血球細胞膜に余裕があるため、変形のひずみの力に対して細胞膜にかかる力が小さくなると考えられている[12][15]。
成熟した赤血球は、通常の細胞が持つ核やミトコンドリア、リボゾーム、ゴルジ体、小胞体などを捨て去り、酸素の輸送に特化した細胞であるので、細胞の運動能やタンパク質・脂質の合成能を持たず、通常の細胞のようには多くのエネルギーを必要としない(そのために酸素を消費してエネルギーの産出を担うミトコンドリアを捨て去ることができる)。しかし、赤血球でも ATP を用いての陽イオンの輸送や細胞膜やヘモグロビンなどの各タンパク質の維持のために(通常の細胞よりは少ないものの)エネルギーを必要とする。エネルギーはグルコースを分解することで得られるが、グルコースの90%は嫌気性解糖系と呼ばれる多数の酵素による ATP合成経路であるエムデン-マイヤーホフ経路によって消費され ATP を産出する。この ATP は Na+ や K+ などの陽イオンの輸送や膜タンパクのリン酸化、解糖系自身の維持などに使われる。残りのグルコース10%は NADPH を産出するためにペントースリン酸経路を経由することで消費される。NADPH はヘモグロビンなどの各タンパク質が酸化されることを防ぎ、保護する[16][17]。
ヘモグロビンと酸素・二酸化炭素輸送
[編集]

ヘモグロビンは赤血球細胞質の主要な構成物質であり、肺から全身へ酸素を運搬する役割を担っているタンパク質である。ヘモグロビンはポルフィリン核に鉄を持つ4つのヘムと4つのグロビンからなり[18]、ヘムは中心に1つの鉄原子を持ち、酸素1分子を結合することができるので、ヘモグロビン1分子で4個の酸素分子と結合することができる[19][20]。標準的な体格の成人が持つ赤血球に含まれるヘモグロビンの総量は約750g であり[1]、1gのヘモグロビンは酸素 1.39mL と結合することができる[21]ので、総量としておよそ 1L の酸素と結合することができる。
赤血球の幼若な[注 4]段階である赤芽球には豊富なミトコンドリアやポリリボソームが存在し、それらによって赤芽球は盛んにヘモグロビンの合成を行い、細胞が成熟するにつれて細胞質はヘモグロビンで充填されていくが、赤血球成熟の最終段階でミトコンドリアやポリリボソームが抜け落ち、成熟し完成した赤血球ではもはやヘモグロビンの合成は行われない[22]。
赤芽球のミトコンドリアではヘムの骨格を成すポルフィリン環が作られ、ポルフィリン環に鉄原子が組み込まれてヘムが作られる。一方、mRNA に複数のリボソームが連結したポリリボソームはアミノ酸を組み立ててたんぱく質であるグロビンを作る[23]。
ミトコンドリアが作ったヘムとポリリボソームが作ったグロビンが細胞質内で出会い、ヘモグロビンになる[23]。
成熟した赤血球は骨髄から血管内に移動し、血液循環によって肺から組織・組織から肺を巡る。組織内では細胞の活動により二酸化炭素が発生し血漿や組織液に溶け込んでいるが、細胞膜を通して二酸化炭素は赤血球内に取り込まれる。赤血球内で二酸化炭素 (CO2) と水 (H2O) は炭酸脱水酵素によって重炭酸イオン (HCO−
3) と水素イオン (H+) になり、水素イオンが増加することにより酸性が強くなった赤血球内では、酸素とヘモグロビンが結びついたオキシヘモグロビンから酸素分子が遊離し、細胞膜を通って体細胞に酸素が供給される(ボーア効果)。酸素を放出したヘモグロビンは水素イオンと結びついて赤血球内が極端に酸性に傾くのを防ぐ[24][25]。
血液中の二酸化炭素のほとんどは赤血球内に取り込まれ、二酸化炭素の約70%は赤血球内の炭酸脱水酵素によって重炭酸イオンに変換され、重炭酸イオンの多くはバンド3 (band 3) と呼ばれる赤血球膜を縦貫する膜輸送たんぱく質によって塩素イオンと交換に赤血球外に出され血漿に溶け込んで肺に循環する。二酸化炭素の15-20%は酸素を放出したヘモグロビンに結びつきカルバミノヘモグロビンとして赤血球により肺に運ばれ、約10%はそのまま血漿に溶け込んで肺に循環する[26]。
人の場合だと肺では酸素分圧はほぼ 100mmHg であり二酸化炭素はほとんどないので赤血球の酸素飽和度はほぼ100%になる。酸素を含んだ赤血球は組織に循環するが、組織内の酸素分圧は組織によって違い、一般的な組織内では 40mmHg、活動中の筋肉内では 20mmHg 程度になる[注 5]。酸素分圧の差でも赤血球は酸素を放出するが二酸化炭素が存在せず酸素分圧の差のみであると、赤血球は持っている酸素の内 10-30% 程度しか赤血球外へ放出できない。しかし組織内に二酸化炭素が発生していると二酸化炭素が炭酸に変換されることで pH が低下し、pH の低下によっておきるボーア効果で赤血球は大半の酸素を放出することができるようになる[27](右上図も参照のこと)。
酸素に富み二酸化炭素の少ない肺では、赤血球は逆の行程で重炭酸イオンを二酸化炭素に戻して吐き出し、酸素を取り込む[24]。つまり、二酸化炭素の少ない肺では赤血球内の二酸化炭素が出て行くが、赤血球内の二酸化炭素濃度が下がると炭酸脱水酵素は組織内のときとは逆に水素イオンと重炭酸イオン (HCO−
3) から二酸化炭素 (CO2) と水を生成して、赤血球内の細胞質の pH は上昇する。また赤血球内の重炭酸イオンが減少したことで赤血球外の重炭酸イオンが塩素イオンと交換で取り込まれ、二酸化炭素に変換されて再び放出される。pH が上昇した赤血球内では酸素を取り込みやすくなり、もともと酸素に富んだ肺組織内であるのでヘモグロビンはいっぱいに酸素を取り込む。酸素飽和度が上がった赤血球は、再び末端の組織細胞に酸素を運搬する[28]。
過剰な酸素は細胞を傷つけるが、赤血球に酸素を取り込み末端組織内で酸素を吐き出す過程では二酸化炭素の存在によって酸素が供給されるので、二酸化炭素の濃度が濃い(一般に活動の盛んな細胞ほど二酸化炭素の排出が多い)ほど赤血球が供給する酸素の量が増えてくるので酸素を必要とする細胞に必要とする適量の酸素を供給することができる。この点が液体に酸素を溶かし込んで供給するシステムとの大きな違いである[24]。
ヘモグロビンの酸素親和性の調節
[編集]ヘモグロビンの酸素親和性の調節では前述のように血液循環で肺と組織を巡る間で H+ の作用(pH の変化)によるボーア効果によって酸素の親和性が変化し赤血球は二酸化炭素の少ない肺では酸素を取り込みやすく、二酸化炭素が発生している組織内では酸素を放出しやすくなる。だが、ヘモグロビンの酸素親和性の調節には pH の変化だけでなく 2,3-BPG(2,3-ビスホスホグリセリン酸あるいは 2,3-DPG 2,3-ジホスホグリセリン酸とも表記する)も関わる。
精製したヘモグロビンは赤血球中のヘモグロビンよりも酸素親和性が高い。赤血球には 2,3-BPG が含まれるが 2,3-BPG はヘモグロビンの酸素親和性を弱める。人が空気の薄い高山に行くと酸素不足状態に陥るが、1日ほどで相当に適応することができる。高地に行き低酸素状態になると数時間ほどで血液中の 2,3-BPG濃度が上昇し酸素親和性が低下する。酸素親和性の低下は肺でよりも組織内での効果が大きく、そのため組織内での酸素放出量を増やすことができる。人では高地適応の例だけではなく、貧血や心不全・呼吸不全などによる低酸素血症でも、2,3-BPG濃度を上昇させて血液の低酸素状態に対してある程度の対応を行うことができる[20]。
胎児の赤血球に含まれるヘモグロビンFは成人のヘモグロビン(ヘモグロビンA)よりも 2,3-BPG に対する結合が弱く、そのため酸素親和性が高い。これは胎盤内で母親側から酸素を受け取らなければならないために、胎児のヘモグロビンは母親のヘモグロビンよりも高い酸素親和性が必要なためである[20]。
赤血球細胞膜
[編集]


赤血球は自分の直径の半分以下の径の微小な毛細血管にも入り込まなければならないので非常に柔軟な変形能力を持ち、また120日間の寿命の間、絶えず循環し繰り返しの変形に耐える安定性が求められる[4]。その赤血球を構成している赤血球細胞膜は、主にリン脂質が隙間なく並んだ層が二重の層を形成している膜脂質二重層と、鎖状のタンパク質が網状に連結され細胞膜を裏打ちして支持している膜骨格、脂質二重層と膜骨格の連結し保持する膜縦貫タンパク質やアンカータンパク、細胞膜を貫通し物質の細胞内外の交換の役割を果たすポンプ・キャリア・チャネルと呼ばれる膜縦貫タンパク質や情報のやり取りのためのレセプター、表面を産毛のように覆い細胞間の情報伝達や、他の細胞との接着・分離にも関係する糖鎖などからなっている[29]。
膜脂質二重層
[編集]親水性のリン酸部分の頭部に疎水性である脂肪酸が2本の尾部が付いたのがリン脂質分子である。赤血球の内外は主に水で満たされているのでリン脂質分子は頭部を外側に、水に反発する尾部を内側に厚さが 3.5-5.6nm[30][注 6]程度の厚さの二重層を自発的に作って並ぶ(右の各図で丸い頭に2本足で描かれているのがリン脂質分子で、それが無数に並んでいるのが二重層である)。二重層の両外側は親水性なので膜全体は赤血球内外の環境になじみ、内側には疎水性の脂肪酸が充満しているので細胞の内外をしっかり遮断することができる、単位時間、単位面積あたりに透過する水分子の数は少ない。このリン脂質二重層は電気的に中性で極めて小さな分子、例えば酸素分子や二酸化炭素分子は通すが、極性を持つ水分子は通りにくく、大きな分子やイオンは通ることができない[31][32]。
リン脂質分子同士の結合は緩いので、各リン脂質分子はリン脂質二重層の中を横方向に自由に移動することができ、細胞の変形や細胞分裂などでも2重層構造が破けることはない、さらに血漿中のリン脂質分子が脂質二重層に入り込んだり、逆に血漿中に抜け出ることも可能である。また脂質2重層を貫通している膜縦貫タンパクやレセプターなども膜脂質二重層上を移動することができる(膜骨格にアンカーされているものは膜骨格の自由度の範囲内で動ける)、実際、マウスとヒトの細胞を融合させる実験では細胞膜上の分子は移動しマウス由来の分子とヒト由来の分子が混ざり合うことが確認されている[32][33]。
このリン脂質分子はリン酸の先に付いた分子によりホスファチジルコリン (PC)、スフィンゴミエリン (SM)、ホスファチジルエタノールアミン (PE)、ホスファチジルセリン (PS) などがあり、赤血球の膜脂質二重層では PC が21%、PS と PE が併せて29%、SM が21%、コレステロールが26%、他が数%で構成される[34]。
並んだリン脂質分子の間にコレステロールが入り込むと分子が動ける自由度は低下し、膜は硬くなり柔軟性が弱くなる。膜脂質二重層の多くの部分ではコレステロールは多くはないのでリン脂質分子は比較的自由に動けるが、次に解説する膜脂質ラフト部分ではリン脂質の間に入り込んだコレステロールが非常に多くなる[35][36]。
これらの PC や PS, PE, SM などは二重層の外側(血漿側)と内側(細胞質側)で分布にムラがあり、外側には PC, SM と糖脂質が多く、内側には PE, PS が多く非対称分布を成している。リン脂質分子の膜の表裏間の移動(フリップフロップ)は3種類の酵素が関わっており、flippase は PE、PS を膜の外側(血漿側)から内側(細胞質側)に移動させ、floppase はすべての脂質分子を内側から外側に移動させ、scramblase はすべての分子を両方向に混同する。これらの酵素の働きによって膜内外のリン脂質の非対称分布がなされていると考えられている[33][37]。非対称分布の一つの理由として、主なリン脂質の中で PS は陰性荷電を持ち、細胞質内のタンパク質が持つ陽性荷電と相互作用しやすいことが細胞膜の機能に好都合であるからだと考えられている[38]。
膜脂質ラフト (Lipid Raft)
[編集]
リン脂質二重層膜上には他の部分より少し厚さが厚く少し硬い脂質二重層上を移動することができる領域があり、海に浮かぶ筏に例えられ脂質ラフト (Lipid Raft) と呼ばれている。ラフト部分ではリン脂質は主にスフィンゴミエリン (SM) で構成され、SM分子の間にコレステロール分子が非常に多く入り込んで分子間の結合を強化している。スフィンゴミエリンの脂肪酸部分は PC や PS, PE より長いのでラフトは若干厚さを増し、コレステロールが分子間結合を強化するので硬くなる。ラフトでは SM とコレステロールの他に、膜縦貫タンパクやレセプター、糖脂質なども多く存在している。多くの積荷を積んだ筏のようなイメージでラフトと通称されているが、通常の脂質二重層もラフトも、どちらもリン脂質を主要構成分子にしている点は海上に浮かぶ筏とは違う。ラフトの直径は数十nm 程度で赤血球膜状には多数あり、タンパク質や糖鎖など多種の分子を多く載せているラフトは赤血球の機能に大きく関わっている部分だと考えられている[39][40]。
膜骨格
[編集]
α鎖スペクトリン (Spectrin) と β鎖スペクトリンが連結した一本の線状のタンパク質が並んで2本絡まった長さ 200nm のひも状のタンパク質(α鎖2本β鎖2本の4量体スペクトリン)が、4.1タンパク (Band4.1) やアクチン (Actin) など[注 7]のタンパク質によって連結され網状になり脂質二重層に接するように存在するのが膜骨格である[29]。スペクトリンは収縮性に富み、伸びきると4量体で 200nm の長さが普段はスプリングのように40nm程度に収縮し、その収縮したスペクトリンが網状に連結された膜骨格はアンキリン (Ankyrin) や4.1タンパクによって膜縦貫タンパク質・バンド3タンパク (Band3) やグリコフォリン (Glycophorin) に結合され脂質二重層にぶら下がるように接している[41]。
この膜骨格は赤血球が狭い毛細血管に入り込むときに変形するとスプリングが伸びたような状態で赤血球の変形に対応し毛細血管をくぐり抜けた後には収縮して赤血球の形を保つ[41]。この脂質二重層の細胞膜を膜骨格が裏打ち補強している構造が赤血球膜の柔軟性と安定性をもたらしている[29]。
表面タンパク
[編集]赤血球の役割は酸素や二酸化炭素の輸送であり、そのために赤血球膜では酸素 (O2) と二酸化炭素 (CO2)、重炭酸イオン (HCO−
3) の交換が重要であり、また細胞の維持に必要なグルコースや各イオンなどの交換も重要である。
赤血球膜縦貫タンパク質であるバンド3は一つの赤血球に120万個あり赤血球膜縦貫タンパク質では最も多いが、赤血球膜に適度な間隔をおいて存在し、脂質二重層と膜骨格のアンカーの役とともに重炭酸イオンと塩素イオンの交換や一部の有機物の輸送を行っている。グルコースやナトリウムイオン、カリウムイオン、カルシウムイオンなどはその他の赤血球膜縦貫タンパク質によって輸送され、酸素分子や二酸化炭素分子などの電気的に中性で小さな分子は脂質二重層を直接通過する[29][42][43][44]。
| 物質輸送機関 | 被輸送体 | 輸送方法 |
|---|---|---|
| 脂質二重層 |
酸素 O2、二酸化炭素 CO2 | 受動輸送(単純拡散) |
| Na+, K+ ATPaseタンパク質
(adenosine triphosphatase) |
Na+ と K+ | Na+ と K+ の交換を行う能動輸送(対向輸送) |
| Ca2+ ATPaseタンパク質
(adenosine triphosphatase) |
Ca2+ | Ca2+ の能動輸送(単輸送) |
| バンド3タンパク質
(anion exchange protein) |
HCO− 3, Cl−, ピルビン酸など |
受動輸送(陰イオン交換体) |
| バンド4.5タンパク質
(glucose transporter) |
グルコース | 受動輸送(促進拡散) |
| アクアポリン
(aquaporin) |
H2O(水) | 選択通過チャネル(選択透過孔) |
上記以外にも多くのトランスポーターやレセプターが赤血球膜にはあることが報告されている[46]。
また、これらの赤血球膜縦貫タンパク質は血液型抗原にも関係している。一例では AB型はバンド3 とバンド4.5タンパクの赤血球膜外構造である糖鎖構造が抗原になっている[47]。
また、物質輸送には関わらないが、赤血球膜上には膜貫通タンパク質であるグリコホリンが100万個[48]ほど存在する。赤血球膜上ではバンド3についで多いタンパク質であるが、グリコホリンの細胞質側は膜骨格に連結されアンカーの役を果たし、赤血球外面に出た部分には大量の糖鎖を有している[49]。糖鎖の先端にはシアル酸があり、シアル酸は COOH基を持つために陰性荷電しているので同じく陰性荷電している赤血球同士や血管内皮細胞との接着を防いだり、同じく陰性荷電している細菌の侵入を防ぐ働きを持っている。
※バンド4.1 や 4.5 などは名称は似ているが、電気泳動分析のバンド番号であり、分子量による命名であって、それぞれは異なるタンパク質である。
生成と破壊
[編集]生成
[編集]

通常骨髄で観察される幼弱な赤芽球系の細胞は、染色性が塩基好性の細胞質を持つため、灰青色を呈する。これらは成熟するにしたがって、徐々にヘモグロビンの赤色が明らかになっていき、最終的に核が脱落した赤血球となって末梢血に送り出される。
造血幹細胞から分化し始めた幼若な血液細胞は盛んに分裂して数を増やしながら少しずつ分化を進めていく。最終的に赤血球に分化・成熟する場合は造血幹細胞、骨髄系幹細胞(骨髄系前駆細胞)、赤芽球・巨核球系前駆細胞、前期赤芽球系前駆細胞 (BFU-E)、後期赤芽球系前駆細胞 (CFU-E)、前赤芽球、好塩基性赤芽球、多染性赤芽球、正染性赤芽球、(網赤血球)、赤血球と成熟していく[50]。
骨髄系幹細胞(骨髄系前駆細胞)、赤芽球・巨核球系前駆細胞、前期赤芽球系前駆細胞 (BFU-E)、後期赤芽球系前駆細胞 (CFU-E) などの前駆細胞の段階では、細胞は非常に活発に細胞分裂して数を増やすが、顕微鏡による形態観察では赤血球系との判別は困難である[51]。
前赤芽球の段階から形態的にも赤血球への分化の方向がはっきりしてくる。赤血球系と判別できるようになった前赤芽球から多染性赤芽球までの細胞も前駆細胞ほど盛んではないが細胞分裂能を持ち、1つの前赤芽球は多染性赤芽球の段階までに3-4回細胞分裂を起して8-16個の細胞に増える[52]。
前赤芽球は直径が 20-25µm で前の段階の前駆細胞より大きくなり、赤血球への分化・成熟の段階で一番大きい細胞であり、顕微鏡観察で赤血球への分化の方向が明らかな最初の段階の細胞であり、核構造は繊細で、細胞質は塩基性[注 8]が強く、リボゾームが多い[51]。
好塩基性赤芽球では大きさは前赤芽球より小さくなり(この後の段階でさらに小さくなり続ける)16-18µm ほどであり、前赤芽球ほどではないが細胞質は塩基性であり、核構造はやや粗くなる[51]。
多染性赤芽球ではヘモグロビンの合成が開始され[53]、ヘモグロビン量が増えるにつれ細胞質の塩基性は弱くなり、細胞はさらに小さくなり、核構造は凝縮しさらに粗くなる。この段階でも弱いながらも細胞分裂能を残している[54]。
正染性赤芽球では細胞分裂能は失われ細胞核は凝縮し細胞質は赤血球に近くなる。直径は 10-15µm でやがて細胞核が脱落して赤血球に成熟する[51]。
これらの幼若な段階の細胞、造血幹細胞、前駆細胞、赤芽球は骨髄にのみ存在する。骨髄にはバリアがあり、幼若な血液細胞は骨髄から出ることができず、脱核して赤血球になって初めて血液中に出ることができるため、通常は末梢血では有核の赤芽球は観察されない。
正染性赤芽球から核が脱したばかりの若い赤血球では、まだリボゾームが残っており、ニューメチレンブルーによる超生体染色を行うとタンパク質と RNA の複合体であるリボソームがその他の細胞内小器官を巻き込みながら網状に凝集し、凝集したリボソームの RNA が青く染まり、顕微鏡観察では網状に見えるので網赤血球と呼ぶ。網赤血球の段階でも 10%-30% ほどのヘモグロビンが合成される。網赤血球は骨髄内に2日ほど留まり、その後血液中に移動して1-2日ほどでリボソームやミトコンドリアが抜け落ちて成熟し完成した赤血球になる[14]。通常、網赤血球は赤血球の 0.5-1.5% 程度であるが、造血が盛んになると若い出来立ての赤血球である網赤血球の割合が増え、骨髄での造血機能が衰えると網赤血球の割合が減る。
赤血球は骨髄で造血幹細胞から作られるが、その分化・成熟には骨髄においてマクロファージが大きく関わっている。骨髄において、赤血球の幼若な段階である赤芽球はマクロファージを中心にその回りを取り囲むように数個から数十個が集団で寄り集まっている。中心に存在するマクロファージは赤芽球に接し、ヘモグロビンの合成に不可欠な鉄や細胞の生育に必要な物質を供給し、成熟をコントロールし、また脱核させた核の処理や、不要になった赤血球細胞の除去にも関与している[14][55]。この、骨髄内においてマクロファージを中心に赤芽球が集まり、赤血球の形成に関わっている細胞集団を赤芽球島もしくは赤芽球小島という[14]。
胎児における造血
[編集]以上で説明しているのは出生後のヒトの造血であるが、胎児の造血は出生後とは様相が違う。まずは胎生15-18日頃に卵黄嚢において一次造血が始まり胚型赤血球が産出される。胚型赤血球は胎生4週以降血液循環を行って酸素を運搬する。一次造血で産出される胚型赤血球は胎生5-6週頃から始まる二次造血による胎児型赤血球(胎児ヘモグロビン、ヘモグロビンF、HbF)および出生後の成熟赤血球(ヘモグロビンA、ヘモグロビンA2)とは大きく異なる。胎生初期に卵黄嚢で作られる胚型赤血球は胎児型赤血球および成体型赤血球と比べて4-5倍の大きさがあり、成熟しても脱核はせず有核である。形態的には赤芽球に似るが、胚型赤血球のヘモグロビンは胎児型ヘモグロビンとも出生後の赤血球のヘモグロビンとも違うものである[注 9]。この胚型赤血球は胎生10週頃には消滅する。ヒトでは胎生5-6週目辺りから肝臓での造血が始まる。この肝臓で始まる造血で生み出される赤血球は成人の赤血球と同じ造血幹細胞から産出され、同じ大きさ・構造であり、赤血球の細胞核は脱核する。この胎児型赤血球はヘモグロビンこそ主として胎児型ヘモグロビンで成体型とは違うものの出生後の造血に直接繋がるものであってこれを二次造血という。肝臓での造血は3-6ヶ月頃は造血の中心であり、胎生6-7ヶ月で肝臓での造血はピークに達する。また脾臓での造血も加わる。これらの肝臓・脾臓での造血はピークを迎えた後に減少し出生時には終了する。骨髄での造血は胎生4ヶ月頃から始まり徐々にその役割を増していく。6-7ヶ月以降は骨髄が造血の中心となり出生時には唯一の造血器官となる[56]。胎児の赤血球では妊娠のごく初期には胚型ヘモグロビンを含むが、まもなく胎児の赤血球は胎児型ヘモグロビン (HbF) を含むようになる。妊娠期間の大部分では胎児の赤血球のヘモグロビンは胎児型ヘモグロビン (HbF) が大半を占め、成体型ヘモグロビン (HbA) はわずかであるが、出生が近づいていくにつれ成体型ヘモグロビン (HbA) は急激に割合を増していく[57][58]。妊娠中期にはヘモグロビンのほとんどを占めていた HbF は、出生時にはヘモグロビンの60-80%になり[59]、あるいは別の資料では妊娠末期の臍帯血のヘモグロビンでは平均で83%が HbF であるとされるが[58]、出生後には急激に HbA に置き換わっていき、生後6ヶ月では HbF は3%程度まで減り、成人のヘモグロビンでは HbA が97%、HbA2 が2%、HbF は1%以下の割合になる[59]。HbF は HbA より高い酸素親和性を持ち、胎内での低い酸素濃度下での酸素運搬に適している(HbA は酸素濃度の高い環境(肺呼吸)での酸素運搬に適している)[60]。
エリスロポエチン
[編集]骨髄では1日あたり2000億個弱の赤血球を生み出すが、骨髄にはこれの3-5倍の赤血球産出能力があり、貧血などで低酸素状態になると赤血球の産出は盛んになる[1]。造血幹細胞から赤血球などの血液細胞の分化・増殖には40種類以上の因子が関わるが、とくに赤血球の増殖にはエリスロポエチン (EPO) が大きく関わる[61]。エリスロポエチンは分子量約34kDa の糖蛋白質であり主に腎臓(一部は肝臓)で産出される[62][63]。貧血や慢性の肺疾患、空気の薄い高地での生活などで慢性の低酸素状態になると腎臓ではエリスロポエチンを盛んに産出するようになる。赤血球の造成の途中の段階である CFU-E(後期赤血球系前駆細胞)は非常にエリスロポエチンの感受性が高くエリスロポエチンを受け取ると細胞分裂能を高め、赤血球の数的増加に結びつく。やがて赤血球の数量が増え、貧血などの低酸素状態が改善されると腎臓ではエリスロポエチンの産出が減少し、したがって骨髄での赤血球産出も落ち着くようになる[63]。しかし慢性腎不全などで腎臓の機能が低下している患者では EPO の産出が減り、貧血になっても赤血球の産出が亢進されず貧血が改善されない[64]。
破壊
[編集]赤血球は血液中で約120日働くと老化し、老化した赤血球は脾臓でマクロファージに捕捉・貪食され分解される。分解された赤血球の構成材のアミノ酸の多くや鉄は回収され再利用されるが、ヘムの分解代謝物であるビリルビンは胆汁もしくは尿として排出される。
赤血球が老化すると嫌気性解糖系のエネルギー産出が衰え、そのために細胞膜上の Na+, K+ ATPaseタンパク質や Ca2+ ATPaseタンパク質が働かなくなりイオンバランスが崩れるため細胞質は水分が減少し赤血球の変形能も衰えてくる。すると老化赤血球は脾臓や肝臓・骨髄の血管内に張り巡らされている網内系と呼ばれる血管内腔を覆う細網細胞と付随する細網線維による網目構造状の組織につかまるが、そこには老化赤血球を捕捉・貪食するマクロファージが待ち構えている別府正敏、菊川清見「細胞の脂質過酸化と老化」『油化学』第44巻第10号、1995年、738-750頁、doi:10.5650/jos1956.44.738。[65]。
赤血球の細胞膜に存在する膜縦貫タンパク質であるバンド3 は若い赤血球では間隔を空けて存在し、バンド3 から赤血球表面に露出している糖鎖には、それに対応する自然抗体(抗バンド3IgG抗体)が存在するが、この自然抗体はバンド3 の糖鎖が十分な間隔を置いている場合(単独の糖鎖)には親和性が低く結合することができない。しかし、赤血球が老化してくるとヘモグロビンの酸化物(この酸化物は、ヘムに酸素を取り入れたオキシヘモグロビンではない)が増え、ヘモグロビン酸化物はバンド3 の細胞質側に結合する。さらにバンド3に結合したヘモグロビンの酸化物はお互いに架橋し、バンド3 を凝集させる。バンド3 が凝集すると細胞表面の糖鎖も凝集し、凝集した糖鎖は抗バンド3IgG抗体との親和性が高いので抗体が結合することができるようになる。脾臓には抗バンド3IgG抗体に対するレセプターを持つマクロファージが存在し、凝集糖鎖に抗バンド3IgG抗体が結合した老化赤血球はマクロファージに容易に認識・捕捉されるようになる。このような過程で老化した赤血球は取り除かれると考えられている[66][67]。
また、若い赤血球では脂質2重層を構成するリン脂質であるホスファチジルセリン (PS) は2重層では赤血球膜内面・細胞質側に多く存在するが、赤血球が老化し嫌気性解糖系のエネルギー産出が衰えてくるとホスファチジルセリンを膜内面側に移動させていた酵素flippase の働きも衰えホスファチジルセリンは膜表面に多く現れる。この赤血球膜外面側表面に多く現れたホスファチジルセリンもマクロファージによる貪食の標的になると考えられている[66][33][37][68]。
赤血球と臨床
[編集]赤血球に関する基準値
[編集]赤血球に関する一般的な項目の基準値[注 10][2]を挙げる。
- 赤血球数 男性420-554万個/µL 女性384-488万個/µL
- ヘモグロビン濃度 (Hb) 男性13.8-16.6g/dL 女性11.3-15.5g/dL(基準下限値を下回ると貧血とされる)
- ヘマトクリット(Ht:赤血球容積率)男性40.2-49.4% 女性34.4-45.6%(血液の濃さであり、貧血で数字は小さくなる)
- MCV(赤血球1個の容積)76-96fL(赤血球の大きさであり、ヘマトクリット÷赤血球数で求められる。鉄欠乏性貧血では小さくなる)
- MCH (en)(赤血球1個あたりのヘモグロビン量)27-35pg(ヘモグロビン濃度÷赤血球数で求められる)
- MCHC (en)(赤血球容積に対するヘモグロビン量)29.7-34.7g/dL(ヘモグロビン濃度÷ヘマトクリットで求められる)[4]
- 比重 1.090-1.120 (血漿の比重は1.024-1.030なので、試験管の中で長時間放置、あるいは遠心分離を行うと下に沈殿する)[69]
- ヘモグロビンA1c(グリコヘモグロビン)4.3%-5.8%(ヘモグロビンにグルコース(血糖)が結び付いたものであり糖尿病で高値になる)[注 11]
血液型
[編集]赤血球の表面には250種以上の表面抗原があるが、A/B型抗原はその代表的な抗原である。赤血球の表面にA抗原があるとA型、B抗原があるとB型、AとB、両方の抗原があるとAB型、両抗原がないとO型とする[70]。逆に血漿中には各抗原に反応する抗体があり、通常A型の血漿中には抗B抗体があり、B型の血漿中には抗A抗体があり、AB型の血漿中には抗A抗体も抗B抗体のどちらもなし、O型の血漿には抗A抗体と抗B抗体両方が存在する[70](血漿中の抗体を調べることで血液型を判定することを裏試験ともいう[70])。
表面抗原に、それぞれ対応する抗体が反応すると赤血球は凝集してしまう。
重要な栄養素
[編集]他の細胞と同様に、赤血球は、水やタンパク質あるいは脂質といった物質から構成されている。一方で一部の微量な栄養素が、赤血球を生成する上で重要な役目を担っているとされる。特に体内で合成することのできない鉄、ビタミンB12、および葉酸は臨床上重要な栄養素とされる。
成人の体内には 3-4g の鉄があるがその2/3はヘモグロビンの構成材として赤血球中にあり、古くなった赤血球は脾臓や肝臓で壊されるが、その際に鉄は回収され、失われるのは1日あたり数mg に過ぎない[71]。しかし、出血などで鉄を多く失うとヘモグロビンの合成に必要な鉄分が不足し、一般的には鉄欠乏性貧血の典型として赤血球は小型であったり低色素型になる[72]。
ビタミンB12 はコバルトを含むビタミンの総称で、ある種のバクテリアしか生産することはできないが、食物連鎖によって動物は十分な量の B12 を体内に持っており、ヒトも肉類、魚類、乳製品などの動物性食品を食することで B12 を取り入れるので普通の状態では体内に数年分の量の B12 を貯えている。B12 は食物ではタンパク質と結び付いているが、胃酸によってタンパク質から遊離し、胃壁から分泌される内因子 (IF) と B12 とが膵液の作用によって結び付くことで B12 は回腸から吸収されるようになる。したがって胃の切除者、萎縮性胃炎での内因子分泌障害(悪性貧血)などで内因子が不足したり、あるいは腸の吸収障害、あるいは極端な菜食主義者などでは数年ののちに B12 は不足する。B12 が不足すると細胞の DNA の合成が障害されて、赤血球系造血では巨赤芽球(その名の通り巨大な赤芽球)が産生され、それは正常な赤血球に分化できないため無効造血となり巨赤芽球性貧血に陥る[73]。
葉酸はレバー、緑黄色野菜、果物などに含まれている水溶性ビタミンであるが、B12 と共に働いて赤血球の成熟に関わる。通常では葉酸は食物から酵素の働きで空腸から吸収され、体内に数か月分の量が貯えられているが、何らかの理由で不足すると B12 の不足と同様に赤血球は DNA の合成が阻害され、正常な成熟ができずに巨赤芽球性貧血になる[74]。
赤血球の変形
[編集]浸透圧による変形
[編集]
赤血球は外部からの力が掛からずとも、様々な要因で変形することがある。赤血球膜には水分を効率的に輸送する輸送タンパク質アクアポリンがあり、浸透圧の低い、例えば真水に赤血球を入れると赤血球は水を吸収して膨らみ、赤血球膜が膨張の圧力に耐えられなくなると終いには破裂する(溶血)。逆に濃い塩水中などでは赤血球は水分を失う。人の生理食塩水(等張液)は0.9%だが、正常な赤血球は食塩水では濃度0.5%が溶血するかしないかのギリギリの濃度である。0.48-0.5%で溶血し始め、0.4-0.42%で50%が溶血し、0.33-0.35%ですべて溶血する[注 12][75][76]。遺伝性球状赤血球症などのように赤血球膜に異常があり脆弱であると、膨張に耐える力が弱いためにより容易に溶血する[75]。
疾患による変形
[編集]ウニ状赤血球または金平糖の様な形状の有棘赤血球は解糖系酵素異常症や尿毒症、血清βリポ蛋白欠乏血症、肝機能障害、便秘や下痢など腸の異常時などに現れ[77]、涙滴状の赤血球は骨髄線維症や癌の骨転移で現れる[78]。各種の溶血性疾患などでは粉々にされ破片となった破砕赤血球が見られ[79]、ある種の遺伝性の貧血病では鎌状赤血球が見られる[80]。赤血球が破裂したり、膜異常などで赤血球が壊れることを溶血と言い、大量に溶血すると貧血を招くばかりでなく、赤血球の内部に高濃度に存在していたカリウムが放出され一時的に高カリウム血症になる。元々高カリウム血症の者が大量の溶血を起こすと高カリウム状態が高度になり徐脈や不整脈など心臓の異常が出現し最悪死に到る[注 13][81]。さらにヘモグロビンが分解される過程で生じるビリルビンによって高ビリルビン血症となり黄疸を生じ、特に出生時低体重児では生命の危険を伴うことがある[82]。
 |
 |
赤血球に影響が現れる主な疾患
[編集]赤血球に影響が現れる疾患は無数にあるが、その中で成書において赤血球系の疾患として取り上げられた主なものを記す[83]。
- 主に赤血球数もしくはヘモグロビン量が減少する疾患
- 赤芽球癆、腎性貧血、巨赤芽球性貧血、鉄欠乏性貧血、無トランスフェリン血症、鉄芽球性貧血、自己免疫性溶血性貧血[84]、鎌状赤血球症[注 14]、サラセミア、発作性夜間ヘモグロビン尿症、脾機能亢進症など
- 真性多血症など
- 色素代謝異常
赤血球とレオロジー
[編集]血液の粘稠性(ねばりけ)は、血液中の細胞成分によって規定される。中でも細胞成分の大部分を占める赤血球は、血液の物性を決定する因子として重要である。一般に流体の物性を定量化する学問領域をレオロジーと呼び、血流に関するものは特にヘモレオロジーと称される。この節ではヘモレオロジーのうち、赤血球に関する議論を概説する。
赤血球は生体では血管という管の中を血漿という流体に乗って流れ、その形状と柔軟性で肺や組織内の毛細血管を通過し循環しているが、血漿の浸透圧の低下や赤血球細胞膜の変質、薬剤の影響、各種疾患などで、赤血球形状がコンペイトウ形や球状に変形すると赤血球の変形能が低下して毛細血管を通過しにくくなり、あるいは赤血球が流れにくくなるため血液粘度が上昇し血圧が上昇したり血栓を起こしやすくなったりする[85][86][87]。また逆に浸透圧の上昇や薬剤の影響、各種疾患などで形状が扁平や奇形形状などの形態変化を起こしても赤血球の変形能は低下する[85][86]。

また、赤血球表面はシアル酸で覆われ陰性荷電しているため、赤血球同士は陰性荷電同士が反発し合うので赤血球同士が接着することは通常はない[88]。しかし、血管内の低ずり応力領域内では高分子化合物の影響により血液粘度が上昇し、赤血球がコインを積み重ねたような状態(連銭形成、rouleau formation)になることがある[88][89]。
ずり応力とは流体力学・ストークスの関係式で説明される力で、円筒管内を流れる流体の速度は管壁近傍では遅く、円筒管中央では早く、またその流速度の変化率は管壁に近いほど大きい。このとき生じる速度差によって生じる力がずり応力である[90]。したがって、流れの遅い血管、あるいは血管の中央付近では赤血球に掛かるずり応力は小さくなり、血管壁付近や血流の早い血管内ではずり応力が大きくなる。ずり応力が小さいと赤血球は集合しやすく、しかし、一旦集合した赤血球もずり応力が大きくなると分離する[88][91]。
| ストークスの関係式 いま、半径 r、長さ l の円筒管内に圧力差 ΔP で流体を流す。ΔP / l は圧力勾配になる。流れの方向に円筒管に働く外力(管の両端に働く力の差)は、πr2ΔP である。この流れとは逆方向に、円筒管内の流体の側面に対して接線応力が働いている。この力は、単位面積当りの接線応力(ずり応力 τ)と側面の全面積 (2πrl) の積 2πrlτ である。両者の力は釣り合っているので πr2ΔP = 2πrlτ となる。したがって、ずり応力 τ は τ = ΔP / 2l × r と表現される。-引用(『血液のレオロジーと血流』, p. 8-9) |
上記で説明されたようにずり応力 τ は血流が遅いほど、あるいは血管の中心に近いほど小さい。
ずり応力が小さくなると赤血球が集合し連銭形成する機序は正確には分かっていないが、血漿中のトリグリセリド(中性脂肪)、フィブリノーゲン、免疫グロブリン(特に IgM)、その他高分子タンパク質が多いと赤血球は集合しやすい。中でも多発性骨髄腫・原発性マクログロブリン血症などで作られる病的な高分子タンパク質は特に赤血球を集合させることが知られている。また、赤血球の変形能が低下していても集合しやすい[88]。血漿中の高分子が多く赤血球の集合の程度が大きいと、血液の粘度が増し血液の流れが滞ってずり応力が小さくなることもあり、するとさらに赤血球が集合してますます血液粘度が上昇するという悪循環に陥ることがある[88][91]。
血液の粘稠性はその人の健康の指標となるとされ、一般に粘稠性が低く流動性が高いほうが好ましいとされる。このことは2000年頃からマスコミでたびたび取り上げられ、いわゆる血液サラサラとしてブームにもなった。一方でこの分野は研究途上の段階にあり、上述のような異常タンパク質の徴候を除けば、血液サラサラに関する臨床的な意義は明らかになっておらず、日本ヘモレオロジー学会においても共通の見解は未だ得られていない。近年ではこのブームを利用した悪質な業者によって高額な商品を売りつけられるといった事例がいくつか報告されており、国民生活センターは注意を呼びかけている。
ヒト以外の赤血球
[編集]



脊椎動物
[編集]わずかな例外(ノトテニア亜目コオリウオ科)を除き、脊椎動物は赤血球を持っている[93]。
哺乳類の成熟した赤血球はヒトの赤血球に似ていて無核[注 16]であり、色は赤くヘモグロビンに富み、丸い円盤状である(ラクダ科のみ楕円の円盤であるが、ラクダ科の赤血球もヒトと同様に無核である[注 17])。ヒトの赤血球と他の哺乳類の赤血球は構造[注 18]やヘモグロビン濃度はほぼ同じで基本的には大きさと寿命が違うのみである[94]。マウスの赤血球はヒトの赤血球の半分程度の大きさであるが、代わりに血液 1µL あたりの赤血球数はおよそ2倍である。哺乳類のなかではヒトの赤血球は比較的大きく、ほとんどの哺乳類では赤血球はヒトのものより小さめであるが、赤血球が小さいものほど代わりに赤血球の数は多く赤血球容積率はどの哺乳類でも35-50%前後とあまり変わらない[95][96]。ゾウの赤血球(直径 9-10µm[94])はヒトの赤血球 (7-8µm) より大きいが、ヒトより体の大きいウシやウマの赤血球はマウスの赤血球と大きさはあまり変わらなく数は多く、ヤギの赤血球ではヒトの赤血球の1/5程度の体積しかないなど動物種によって様々である[95][97]。哺乳類の赤血球の寿命はマウスの20-30日からネコの68日、ヤギの125日、ウマの140-150日と広範であるが、どちらかというと体の大きい者の赤血球は寿命が長い傾向がある[98]。
哺乳類以外の脊椎動物(鳥類、爬虫類、魚類、両生類)の赤血球は楕円で有核であるが、その細胞質はやはりヘモグロビンで充満し色は赤い[99]。
鳥類の赤血球はヒトの赤血球よりやや大きく[注 19]、細胞も核も楕円であるがその形状は滑らかであり、数はやや少ないが大きな差はない。鳥類の赤血球のヘモグロビン濃度は濃く、また赤血球容積率も35-55%と鳥類の赤血球は形と核の有無以外は哺乳類と大差はない[100]。ただし、鳥類のヘモグロビンは哺乳類のものとグロビンの構造が異なり、酸素解離曲線が哺乳類より右方変異しており筋肉などの組織内で酸素を遊離しやすくなっている。鳥類の赤血球の寿命は短く1か月前後である[100]。鳥類の赤血球造血もエリスロポエチンに反応し[100]、その成熟過程は核が脱核しないこと以外はヒトの赤血球の成熟過程に似ている[92]。
魚類の赤血球もヒトのものより数は少なくやや大きい。両生類の赤血球はとても大きく数は少ない。爬虫類は両生類と鳥類の間にある[101][102]爬虫類、両生類、魚類の赤血球も細胞質にはヘモグロビンがあり赤いが、哺乳類や鳥類に比べて両生類と魚類の赤血球細胞質のヘモグロビン濃度は薄く MCHC はコイで 20.5g/dL、カエルで 26-28g/dL 程度であり[93]、また爬虫類や両生類、魚類の赤血球細胞核はいびつなことが多い[92]。
造血の場は哺乳類と鳥類では主に骨髄、魚類では主に腎臓、両生類では脾臓である。爬虫類は種によってさまざまである[93][103]。
無脊椎動物
[編集]無脊椎動物ではある程度の体の大きさを持っているものは白血球に相当する細胞を持っているが、赤血球を持っているものは極めて少なく例外的な存在とも言える[注 20]。その赤血球を持つ例外的な無脊椎動物はアカガイやシャミセンガイ、ホウキムシ、ホシムシなどすべて海棲であり、特に種類が多い昆虫類を含め陸上の無脊椎動物には赤血球を持つものはいない[92][104]。その無脊椎動物の赤血球は脊椎動物の赤血球とはずいぶん異なる面が多く、その一つの特徴は核の他に何らかの顆粒が細胞質にあることであり、またそれ以外にも種によっては以下のような特徴がある[104]。
- シロナマコの赤血球は数本の突起があり、核以外にも目立って大きい数個の顆粒がある。
- ユムシやアカガイの赤血球では顆粒の数は数十個に及ぶ。
- タマキガイの赤血球には複数の核がある。
- 星口動物(ホシムシ)の赤血球には数個の六面体の結晶が存在する。
ホシムシ類の赤血球にはヘムエリスリン、それ以外にはヘモグロビン[注 21]が存在する[104]。
これらのわずかな例外を除くほとんどの無脊椎動物は赤血球を持たない。無脊椎動物の多数を占める赤血球を持たない者の血液ではヘモグロビン、エリスロクルオリン、ヘムエリスリンやヘモシアニンなどの血色素が直接血漿に溶け込んで循環し酸素供給している。血が赤くない軟体類や節足動物などの動物の多くではヘモグロビンではなく銅を用いたヘモシアニンで酸素を運ぶため血液は青みがかかっている[93][102][105]。
このように様々な動物が赤血球を持ち無脊椎動物の中にも赤血球を持つものがおよそ100種類程度いるが、無脊椎動物の赤血球は種によって様々であり、いずれの赤血球も脊椎動物の赤血球とは異なる点が多い。無脊椎動物の赤血球は同時に白血球としての機能を持つものが多く、その細胞質でも血色素は顆粒内にある。赤血球を持つ無脊椎動物は様々な門に点々と分かれて存在し、例えば同じ二枚貝の仲間でも赤貝は赤血球を持ち他の二枚貝の多くは赤血球を持っていないなどであり[106]、さらに無脊椎動物の中で進化の上では脊椎動物に近いホヤ類には赤血球を持つものはおらず[107]、またホヤ類に次いで脊椎動物に近い棘皮動物にも赤血球を持つものはほとんどいない[106]。これに比べて脊椎動物の赤血球には白血球の機能はなく細胞質には均質にヘモグロビンが満ちている[105]。これらのことなどから脊椎動物の赤血球と無脊椎動物の赤血球には進化の上での繋がりのある可能性は低いと考えられている[106]。
無脊椎動物の血色素は様々であるが、脊椎動物の血色素は皆ヘモグロビンであり、脊椎動物で最も原始的な無顎類の造血は発生学的には卵黄嚢に近い腸管粘膜下で行われ、どの脊椎動物でも受精卵から発生したばかりでは卵黄嚢で造血が行われその後に造血の場を変えていくので、脊椎動物の赤血球は脊椎動物の登場と共に現れ進化してより洗練されて行ったのだという可能性がある。最も進化した哺乳類において、赤血球も酸素運搬には不要な核を捨てて酸素輸送に特化するなどさらに進化をした可能性があり[106]、酸素運搬の観点からは哺乳類の赤血球が最も進化し、比較的下等なものほど酸素運搬には非効率的なものが多いので進化が遅れていると思われるが、それ以上の赤血球の進化については確実なことは分かっていない。
赤血球の発見と研究史
[編集]
赤血球の発見は顕微鏡の発明によってもたらされた。古代から凸レンズを使えば物を拡大して見られることは知られていたが、1590年代にヤンセン父子によって二枚のレンズを使った現代の顕微鏡の祖となる最初の複式顕微鏡が発明された[注 22]。しかし、この17世紀中の複式顕微鏡は収差が大きく性能が低く、17世紀中はレンズが一枚の単式顕微鏡が性能を上げ大きな成果を上げていた[108]。
1658年、オランダのスワンメルダムはその単式顕微鏡でカエルの赤血球を初めて観察し、さらに1660年にマルピーギが毛細血管の血球の循環を観察した[108]。これらの観察はラフなものであったが[注 23]、1674年レーヴェンフックは単レンズの単式顕微鏡としては最高度の性能の顕微鏡[注 24]を自作し、ヒトの赤血球を観察して大きさが 8.5µm の円盤状であると報告している[注 25][108]。またレーヴェンフックは、哺乳類の赤血球は円盤状であるが哺乳類以外の動物の赤血球は卵型であることも発見している[109]。
その後、1747年にメンギニが赤血球は鉄を含むことを磁石を用いて発見し、1774年プリーストリーは赤血球が酸素に反応することを観察し、1780年ラヴォアジエとラプラスは赤血球が酸素を運搬することを明らかにしている[110]。
1825年ライヘルトによって結晶化に成功したヘモグロビンは、1865年 ホッペ=ザイラーによって研究されている[110]。ABO型の血液型は1900年に ラントシュタイナーによって発見されたが、当初ラントシュタイナーは A, B, C の3型に分類し1901年の発表論文では A, B, O の3分類、1902年に共同研究者らと現在の A, B, O, AB型に分類し直している[111][112]。1904年デンマークの ボーアは赤血球の酸素の結合と遊離と二酸化炭素の関係を調べて酸素解離曲線を示し、二酸化炭素の存在によって赤血球のヘモグロビンと酸素の結合し易さが変化することを発見した(ボーア効果)[113]。
1933年ロートンらが赤血球内に炭酸脱水酵素を発見し[114]、1948年 サンガーとポーターはヘモグロビンの構造研究の開始し、1961年ペルーツはヘモグロビンの立体構造を解析した[115]。
1967年チャヌタンは赤血球に含まれる DPG(2,3-ビスホスホグリセリン酸)の量の変化によっても酸素解離曲線が移動することを発見した[116]。
赤血球を真水に入れると溶血し細胞膜が得られるので、細胞膜の存在自体は早くから知られていたが、当初は赤血球細胞膜については何も理解されていなかった。1935年ダブソンらは細胞膜のリン脂質二重層構造を提唱し、1966年シンガーとニコルソンによって現在の知られている膜構造の流動モザイクモデルの基本モデルが提案されるようになった。さらに1970年代以降電子顕微鏡の発達で赤血球膜の微細構造は次々に明らかになっている[117]。
人工赤血球
[編集]
大怪我などで大量に出血すると人は生命の危険があり、緊急に輸血を行わないとならないが、血液はいつどこでも十分な量を確保できるとは限らない。そのため、救急用に人工赤血球の開発の必要は昔から指摘されていた。古くは欧米にてヘモグロビンを加工したものを血液に流せないか研究が進められていたが、剥き出しのヘモグロビンの毒性[注 26]を除去することは困難であり、1製品が南アフリカで承認されたものの安全性と有用性に疑問が持たれ主要国では実用化の目途は立っていない。そのため、現在ではヘモグロビンを内包した小胞体の開発が行われている[118][119][120]。
リン脂質分子は自発的に二重層、あるいはリポソーム、ミセルの形状に並ぶので、リポソームの内側にヘモグロビンを封入すれば酸素運搬能力を持たせることができ、またヘモグロビンの毒性も閉じ込めることができる[119][120]。
2010年現在では赤血球の数十分の一の大きさ(直径数百ナノメートル程度)のリポソーム内に(輸血に使用されなかった廃棄血液から抽出した)ヘモグロビンを封入したヘモグロビン小胞体が動物実験で短期的には効果を認められるところまで開発が進んでいる[119][121]。
脚注
[編集]注釈
[編集]- ^ 血液の55%程度を占める血漿はやや黄色を帯びてはいるがほとんど透明であり、血液の色は主に45%程度を占める赤血球の色である。
- ^ 基準値の設定は研究機関・検査施設ごとに違う
- ^ ヒトでは安静時に心臓は4-8L/分の血液を拍出し-出典、寺野『シンプル内科学』p.110-人の体内の血液はおよそ3.5-5Lなので血液は平均しておよそ1分弱で体内を巡ることになる。1日で2000回前後、120日では20-30万回程度になる。
- ^ 造血幹細胞を源とし、完成形を赤血球とすると、造血幹細胞から赤血球への分化・成熟の途中段階である。
- ^ 短距離走などの激しい運動をしている筋肉では組織内の酸素分圧は一気に 5mmHg 程度に下がる。この酸素分圧レベルになると筋肉組織内のミオグロビンが蓄えていた酸素を放出して一時的に賄うがミオグロビンは酸素に対する親和性がヘモグロビンより高いので通常の組織内の酸素分圧レベル 20mmHg 以上では酸素を供給することはできない。
- ^ リン脂質二重層の厚さに関しては文献によって異なり、(『三輪血液病学』, p. 129)では 7.5nm、H. Lodish, 他 著『分子細胞生物学』p381では 3.5-5.6nm、日本検査血液学会編『スタンダード検査血液学』では 8nm、浅島『図解分子細胞生物学』では 3-5nm など様々である。これは膜に存在するタンパク質の厚さも影響していると思われる。タンパク質を考慮しない脂質二重層のみの厚さは3-6nmの範囲と思われる。ここでは『分子細胞生物学』の数字を挙げた。
- ^ スペクトリンの結合・連結には4.1タンパク (Band4.1) やアクチン (Actin) が関わり、結合部には他に4.2タンパク・4.9タンパク・アデューシンなどのタンパク質が見られるが、4.2タンパク・4.9タンパク・アデューシンの役割は不明である-出典、日本生化学会『新生化学実験講座6』(上)p405-408
- ^ 血液細胞はヘモグロビン以外の物質は無色半透明であり、そのままでは顕微鏡を用いても細胞の様子を見ることはできない。そのために細胞に染色をして特徴を見やすくする。染色の方法は目的によって様々であるが、一般的なライトギムザあるいはメイギムザ染色は二重染色であり、塩基性色素が DNA や RNA, 細胞質のアズール顆粒などを青色に染め、エオジン色素がヘモグロビンや好酸性顆粒を赤橙色に染めるが、若い赤芽球では細胞質が塩基性色素で特に青色が強く染まり、ヘモグロビンが作られ始めた多染性赤芽球では細胞質の青が弱くなってヘモグロビンを染める赤が加わって「多染」となり、さらにヘモグロビンが増えた正染性赤芽球では赤が強くなり細胞質の青色は分からなくなる。
- ^ 成人のヘモグロビン (HbA) は2本のポリペプチドα鎖グロビンと2本のポリペプチドβ鎖グロビンからなる四量体 (α2β2) であるが、人のグロビンには α鎖と β鎖の他に、γ鎖、δ鎖、ε鎖、ζ鎖がある。α鎖とζ鎖の遺伝子は16番染色体上に並び、ζ鎖は胚期初期にのみ発現する。胎生期の大部分と出生後は α鎖のみが発現する。11番染色体上ではグロビン遺伝子は ε鎖、γ鎖、δ鎖およびβ鎖の順に並びスイッチングが起きて発現するグロビンが変化する。胚性ヘモグロビンは α2ε2, ε4, ζ2ε2, ζ2γ2 などであるが、グロビン遺伝子のスイッチングで ε鎖、ζ鎖はまもなく作られなくなり、次に作られる胎児型ヘモグロビンHbF は α2γ2 であるが、出生に近づくとγ鎖も次第に減っていき、出生後にはヘモグロビンの大半を占める α2β2 の HbA と少数の α2δ2 からなる HbA2 に置き換わっていく。-出典 (三輪史朗 監修ほか 1998, p. 114-118)および(野村 ほか『赤血球』, p. 22-24)
- ^ 研究機関・検査施設ごとに多少の基準値設定の差はある。
- ^ 赤血球の30日から120日の寿命の間中に赤血球内のヘモグロビンはグルコース(血糖)と結びついていくが、その反応は緩徐的(ゆっくり)で非酵素反応のため、一時的なグルコース濃度の変化やグルコース以外の要素の影響を受けにくく、Hb 中の HbA1c の割合は過去1 - 3か月のグルコース濃度(血糖値)の平均に相関することが分かっている。血中にはグルコースは必ずあるため健康人でもヘモグロビンの4.3%-5.8%は HbA1c であるが、血中の血糖値が長期間の平均で高いほど HbA1c も高値になり、糖尿病では6.5%以上の高値になる(日本薬学会.HbA1c)
- ^ 数値は文献によって微妙に違い岡田泰伸監訳『ギャノング生理学23版』p.613では0.5%がギリギリの濃度で0.35%ですべて溶血するとし、杉晴夫編著『人体機能生理学』p.305では0.48%で溶血し始め、0.33%で完全に溶血するとしている
- ^ ただし、実際には正常な血液が採血後に採血管の中で溶血し高カリウム血症状態になることが多く、それを偽性高カリウム血症と言い、この場合は体を流れている血液が高カリウム血症であるわけでないので心配要らないことが多い。急激な上昇や腎疾患でない限り過剰なカリウムは迅速に排出されるが、しかし、原因がはっきりするまでは高カリウム血症は要注意である。また輸血用の血液製剤に含まれる赤血球はある程度は必然的に壊れ、輸血用赤血球製剤は高カリウム状態である。輸血量が多いと一時的に高カリウム血症となるため、急激な輸血は注意が必要である。
- ^ 鎌状赤血球症は遺伝疾患であり、その遺伝子を持つものは本来は生存競争に不利であるが、鎌状赤血球症の赤血球はマラリアに抵抗性がある。そのため、マラリアの流行地では鎌状赤血球症の遺伝子を持つものが淘汰されずに現代に残っていると考えられている。
- ^ 多血症も大きく分けると3パターンある。
- 赤血球の絶対量は増加していないのだが、血漿が減少するために血液単位量あたりの赤血球量が相対的に増える、脱水やストレス多血症などの相対的多血症
- 喫煙者でタバコの煙にふくまれる一酸化炭素がヘモグロビンに強力に結びついてヘモグロビンの機能が低下し酸欠状態になる常習的喫煙者や肺機能障害、酸素の薄い高地での生活、これらは慢性的な酸欠をもたらし、酸欠に反応して腎臓でのエリスロポエチンの産出が増加することで多血症が起きる。あるいはエリスロポエチン産出細胞が腫瘍性の増加をすることで起きる多血症もある。これらの多血症はエリスロポエチン量の増加に赤芽球が反応した多血症である。
- 真性多血症などの造血細胞の腫瘍性疾患で赤血球が増えることもある。腫瘍性の増加では腎臓はエリスロポエチンの産出を抑え赤血球数のコントロールを試みるが、腫瘍性の造血細胞はもはやエリスロポエチン量によるコントロールを受け付けず、血中のエリスロポエチン量が低値にもかかわらず赤血球は増加を続ける。
- ^ 例外としてコアラでは赤血球の4から40%程度が核を持つ-Nemi『最新・獣医血液学』p.71。
- ^ 1928年までは英米でもラクダ科の赤血球は有核であるとの誤解はあったが、1928年以降にはその誤解は解消している。しかし日本ではその後も何故かラクダ科の動物の赤血球には核があるとの俗説が信じられて書籍にも載り続けている。それらの俗説は実際にラクダの赤血球を観察したものではなく伝聞で書かれているものである。実際にはラクダ科の動物の赤血球も無核である。-山崎英雄「ラクダの赤血球は有核か?」『生物の科学 遺伝』40巻8号、裳華房、1986年、p.78-79を参照、および出典-越田『比較動物学』p.56。ラクダ科の動物の赤血球には核があるとの誤説は広辞苑第5版などにあるが、広辞苑第6版以降は訂正されている。-中山裕之『獣医学を学ぶ君たちへ』東京大学出版会、2019年、p.32
- ^ ただし、哺乳類の赤血球の構造は血液学的にはどれも似ているが、生化学的には、細胞膜のリン脂質の組成は種によって異なり、マウスではホスファチジルコリン (PC) はヒトより多くスフィンゴミエリン (SM) は少ない。逆にウシでは PC はなく SM はヒトより多い。脂質組成の差は膜の透過性に影響する。(水上『赤血球の生化学』, p. 96)
- ^ 鳥類の赤血球の大きさは 10.7µm × 6.1µm から 15.8µm × 10.2µm 程度であり、ヒトの赤血球の直径 7-8µm より若干大きめである。-Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.8- ただし、シジュウカラの仲間カロライナチカディのように1µm程度の極小さい赤血球を持つ例外もいる-越田『光学顕微鏡でみる比較動物学』p.58-59
- ^ 極めて古い1954年の資料ではあるが、百万とも、あるいはそれ以上とも言われる無脊椎動物全種の中で赤血球を持っている種の数を100種程度としている。-出典 岡田『生物学実験法講座 第8巻 A』p.31-33
- ^ アカガイなどはエリスロクルオリンを持つが、参考にした岡田『生物学実験法講座 第8巻 A』p31-33は古い資料でありエリスロクルオリンはヘモグロビンの近縁として同一視していると思われる。
- ^ この発明の記録には異論もある。-田中『顕微鏡の歴史』p.19-26
- ^ スワンメルダムらの報告は「赤い小球体」を見たことを報告したのみであり、赤血球の真の発見者はレーヴェンフックであると考える研究者もいる。-マックスウェル・M.ウイントローブ著『顕微鏡の歴史』西村書店、1981年 p.7-9
- ^ 後年の検証では分解能が3.5µm、あるいは検証者によっては 1µm に達していたと言われる-田中『顕微鏡の歴史』p.31-34
- ^ レーヴェンフックはスワンメルダムらの観察を知らなかったため、独力での発見である。ただし、レーヴェンフック自身は赤血球は本来は球状であると信じていたため、円盤状になっているのは観察時に何らかの要因で変形したのだと思っていた。
- ^ 血管は少量の一酸化窒素 (NO) の存在によって弛緩し拡張するが修飾Hb(ヘモグロビンそのものあるいは重合化など加工されたヘモグロビン、ここで言う剥き出しのヘモグロビン)は一酸化窒素 (NO) との高い親和度を持ち血管内皮から一酸化窒素 (NO) を奪い去ってしまうため、血管収縮による血圧の異常亢進や心筋梗塞があり、死亡率が明らかに高くなることが分かっている。-石塚「人工酸素運搬体の開発の現状」。余談になるが、体内で一酸化窒素 (NO) に変換される硝酸薬ニトログリセリンが狭心症の特効薬になるのは一酸化窒素 (NO) の血管拡張作用のためである。-出典、高久『新臨床内科学』p.243
出典
[編集]- ^ a b c d 杉本『内科学』p.1559
- ^ a b 小川『血液学』p.23
- ^ 小川 ほか『内科学書』, p. 35.
- ^ a b c 杉本『内科学』p.1558
- ^ エヌ・ティー・エス『幹細胞の分化誘導と応用』p.3
- ^ 杉本『内科学』p.1560
- ^ 小川 ほか『内科学書』, p. 6.
- ^ a b 三輪史朗 監修ほか 1998, p. 7.
- ^ 小川 ほか『内科学書』, p. 10.
- ^ 野村 ほか『赤血球』, p. 30.
- ^ 『三輪血液病学』, p. 214-215.
- ^ a b 『血液のレオロジーと血流』, p. 24.
- ^ 『三輪血液病学』, p. 116,214-218.
- ^ a b c d 『三輪血液病学』, p. 120-124.
- ^ 『三輪血液病学』, p. 49-50,214.
- ^ 『三輪血液病学』, p. 214-216.
- ^ 野村 ほか『赤血球』, p. 47-61.
- ^ 小川 ほか『内科学書』, p. 5.
- ^ 野村 ほか『赤血球』, p. 22.
- ^ a b c 『三輪血液病学』, p. 179.
- ^ 小川 ほか『内科学書』, p. 12.
- ^ 『三輪血液病学』, p. 117-118.
- ^ a b 『三輪血液病学』, p. 116-118.
- ^ a b c 三輪史朗 監修ほか 1998, p. 99-100.
- ^ 『三輪血液病学』, p. 179,234.
- ^ 『血液のレオロジーと血流』, p. 3.
- ^ Robert K『ハーパー生化学』p.49
- ^ 八幡『細胞膜のしくみ』, p. 88-89.
- ^ a b c d 三輪史朗 監修ほか 1998, p. 81-98.
- ^ H. Lodish『分子細胞生物学』p.381
- ^ 八幡『赤血球膜研究史』p.260
- ^ a b Geoffrey『クーパー細胞生物学』p.49-51
- ^ a b c 浅島『図解分子細胞生物学』p.7-8
- ^ H. Lodish『分子細胞生物学』p.380
- ^ 浅島『図解分子細胞生物学』p.9
- ^ 八幡『細胞膜のしくみ』, p. 44-47.
- ^ a b 八幡『細胞膜のしくみ』, p. 36-39.
- ^ 八幡『赤血球膜研究史』p.258
- ^ 浅島『図解分子細胞生物学』p.9-10
- ^ 八幡『細胞膜のしくみ』, p. 48-50.
- ^ a b 八幡『細胞膜のしくみ』, p. 58.
- ^ 『三輪血液病学』, p. 235.
- ^ a b 野村 ほか『赤血球』, p. 45-46.
- ^ 八幡『細胞膜のしくみ』, p. 86-91.
- ^ H. Lodish『分子細胞生物学』p.403-404
- ^ 『三輪血液病学』, p. 111-112.
- ^ 野村 ほか『赤血球』, p. 46-47.
- ^ 『三輪血液病学』, p. 130.
- ^ 日本検査血液学会『スタンダード検査血液学』初版 p.22
- ^ 『三輪血液病学』, p. 120-124,242-244.
- ^ a b c d 『三輪血液病学』, p. 242-244.
- ^ 野村 ほか『赤血球』, p. 28.
- ^ 『三輪血液病学』, p. 121.
- ^ 『三輪血液病学』, p. 242-24.
- ^ 三輪『血液細胞アトラス』p.77
- ^ 『三輪血液病学』, p. 2-4,23-25,31.
- ^ 西田 朗「赤ちゃんは胎外の高酸素環境にどのように適応しているの?」『周産期医学』Vol.31 No.7、周産期医学編集委員会 編、東京医学社、2001年、pp872-874
- ^ a b 荻田幸雄、「HbF(ヘモグロビンF)」『産科と婦人科』Vol.43 No.4 p.413-415、診断と治療社、1976年 (有償閲覧)
- ^ a b 三輪史朗 監修ほか 1998, p. 119.
- ^ 小林道頼、今井清博「ヘモグロビンの酸素平衡特性に秘められた意義-成人と胎児を比べて」『日本生理学雑誌』Vol.59 No.10、日本生理学会、1997年、pp.439-444
- ^ 小川 ほか『内科学書』, p. 8.
- ^ 三輪史朗 監修ほか 1998, p. 24.
- ^ a b 『三輪血液病学』, p. 244-245.
- ^ 『三輪血液病学』, p. 971.
- ^ 八幡『細胞膜のしくみ』, p. 158-162.
- ^ a b 別府 & 菊川 1995.
- ^ 三輪史朗 監修ほか 1998, p. 74-79.
- ^ 『三輪血液病学』, p. 248.
- ^ 日本検査血液学会『スタンダード検査血液学』初版p.5
- ^ a b c 小川 ほか『内科学書』, p. 49.
- ^ 杉本『内科学』p.1563
- ^ 塩崎宏子,泉二登志子、「鉄欠乏性貧血の検査と診断」 日本内科学会雑誌 2010年 99巻 6号 p.1213-1219, doi:10.2169/naika.99.1213
- ^ 『三輪血液病学』, p. 184-186,974-977.
- ^ 『三輪血液病学』, p. 189-194.
- ^ a b 岡田『ギャノング生理学23版』p.613
- ^ 杉『人体機能生理学』p.305
- ^ 橋詰 明英, 鈴木 隆一, 横内 久猛 ほか、「赤血球自動識別アルゴリズムとその評価」 医用電子と生体工学 1990年 28巻 1号 p.25-32, doi:10.11239/jsmbe1963.28.25
- ^ 小松則夫、「真性赤血球増加症」 日本内科学会雑誌 2007年 96巻 7号 p.1382-1389, doi:10.2169/naika.96.1382
- ^ 田中龍二,藤村欣吾,岡田浩佑 ほか、「赤血球ピルビン酸キナーゼ欠乏および骨髄細胞染色体異常を伴った急性骨髄性白血病の1例」 臨床血液 1979年 20巻 2号 p.187-195, doi:10.11406/rinketsu.20.187
- ^ 菊池佑二、「赤血球変形能の測定と環境因子による変化」 日本バイオレオロジー学会誌 1992年 6巻 1号 p.2-16, doi:10.11262/jpnbr1987.6.1_2
- ^ メルクマニュアル・カリウム 2011.05.08閲覧
- ^ メルクマニュアル・高ビリルビン血症 2011.05.08閲覧
- ^ 『三輪血液病学』, p. 4-5.
- ^ 近江俊徳, 梶井英治, 小山田隆 ほか、「温式自己免疫性溶血性貧血患者における赤血球結合IgG量の測定とその意義」 日本輸血学会雑誌 1992年 38巻 5号 p.601-606, doi:10.3925/jjtc1958.38.601
- ^ a b 『三輪血液病学』, p. 49-50.
- ^ a b 『血液のレオロジーと血流』, p. 18-34.
- ^ 『三輪血液病学』, p. 133-134.
- ^ a b c d e 『三輪血液病学』, p. 51-53.
- ^ 『血液のレオロジーと血流』, p. 6-9,37.
- ^ 『血液のレオロジーと血流』, p. 6-9.
- ^ a b 『血液のレオロジーと血流』, p. 37.
- ^ a b c d 越田『光学顕微鏡でみる比較動物学』p.58-59
- ^ a b c d 『三輪血液病学』, p. 2031-2036.
- ^ a b Nemi『最新・獣医血液学』p.71
- ^ a b 『実験動物の血液学』, p. 195-197.
- ^ 『血液のレオロジーと血流』, p. 32.
- ^ 『血液のレオロジーと血流』.
- ^ Nemi『最新・獣医血液学』p.153
- ^ Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.58-100
- ^ a b c Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.8
- ^ 『実験動物の血液学』, p. 195-197,13-19.
- ^ a b Terry W『鳥類とエキゾチックアニマルの血液学、細胞診』p.58-100
- ^ 『実験動物の血液学』, p. 13-19.
- ^ a b c 岡田『生物学実験法講座 第8巻 A』p.31-33
- ^ a b 『実験動物の血液学』, p. 5-7.
- ^ a b c d 森岡清和 著『素顔の赤血球』p.122-124
- ^ 和合『動物の血液細胞と生体防御』p.129
- ^ a b c 田中『顕微鏡の歴史』p.19-26
- ^ 小林『世界の顕微鏡の歴史』p.160
- ^ a b 水上『赤血球の生化学』, p. 2.
- ^ 水上『赤血球の生化学』, p. 104.
- ^ ABO血液型の分子遺伝学 2011.05.07閲覧
- ^ 水上『赤血球の生化学』, p. 26-28.
- ^ 水上『赤血球の生化学』, p. 28-29.
- ^ 水上『赤血球の生化学』, p. 21.
- ^ 水上『赤血球の生化学』, p. 34.
- ^ 八幡『赤血球膜研究史』p.13-14
- ^ 石塚「人工酸素運搬体の開発の現状」
- ^ a b c 武田『人工赤血球のICU使用を目的とした最適化およびME技術の改良』p.1-2
- ^ a b 酒井「ヘモグロビン小胞体の開発の歴史と現状」
- ^ 堀之内「Hb小胞体の動物投与の成績」
参考文献
[編集]- 書籍
-
- 浅島誠、駒崎伸二 共著『図解分子細胞生物学』裳華房、2010年、ISBN 978-4-7853-5841-9
- 浅野茂隆、池田康夫、内山卓『三輪血液病学』文光堂 東京〈第3版〉、2006年。ISBN 978-4830614194。
- エヌ・ティー・エス編『幹細胞の分化誘導と応用』エヌ・ティー・エス、2009年、ISBN 978-4-86043-160-0
- 岡田泰伸 監訳『ギャノング生理学』原書23版、丸善、2011年、ISBN 978-4-621-08319-2
- 岡田弥一郎 編『生物学実験法講座』 第8巻 A-体液生理実験法、中山書店、1954年
- 小川聡、伊藤裕、塩沢昌英『内科学書』(改訂第7版)中山書店〈Vol.6〉、2009年。ISBN 9784521731735。国立国会図書館書誌ID:000010602718。
- 小川哲平、大島年照、浅野茂隆 編著『血液学』、中外医学社、1991年、ISBN 978-4-498-02544-8
- 越田豊、常木和日子 共著『光学顕微鏡でみる比較動物学』培風館、1994年、ISBN 4-563-07730-5
- 小林義雄 著『世界の顕微鏡の歴史』1980年
- 菅原基晃、前田信治『血液のレオロジーと血流』コロナ社〈ME教科書シリーズ ; B-7〉、2003年。ISBN 9784339071474。国立国会図書館書誌ID:000004072400。
- 杉晴夫 編著『人体機能生理学』改訂第5版、南江堂、2009年、ISBN 978-4-524-25364-7
- 杉本恒明、矢崎義雄 総編集『内科学』第9版、朝倉書店、2007年、ISBN 978-4-254-32230-9
- 関正利『実験動物の血液学』ソフトサイエンス社、1981年。doi:10.11501/12652658。NDLJP:12652658。
- 高久史麿 ほか監修『新臨床内科学』第9版、医学書院、2009年、ISBN 978-4-260-00305-6
- 田中新一 著『顕微鏡の歴史』九州文庫出版社、1979年
- 武田純三 ほか著『人工赤血球のICU使用を目的とした最適化およびME技術の改良 : 平成21年度総括・分担研究報告書 : 厚生労働科学研究費補助金政策創薬総合研究事業』
- 寺野彰 総編集『シンプル内科学』南江堂、2008年、ISBN 978-4-524-22344-2
- 中山裕之『獣医学を学ぶ君たちへ』東京大学出版会、2019年、ISBN 978-4-130-72066-3
- 日本検査血液学会 編『スタンダード検査血液学』初版、医歯薬出版、2003年、ISBN 4-263-22271-7
- 日本生化学会 編『新生化学実験講座 6(上)』生体膜と膜輸送、東京化学同人、1992年、ISBN 4-8079-1071-X
- 野村武夫、古澤新平、長尾大『赤血球』中外医学社〈図解血球-生理・病態・臨床〉、1994年。ISBN 4498025547。
- 水上茂樹『赤血球の生化学』(第2版)東京大学出版会〈UP biology〉、1993年。ISBN 4130632094。国立国会図書館書誌ID:000002283819。
- 藤井寿一、高桑雄一、三輪史朗、中畑龍俊『赤血球』医学書院、1998年。ISBN 4260109464。国立国会図書館書誌ID:000002732136。
- 三輪史朗、渡辺陽之輔共著『血液細胞アトラス』第5版、文光堂、2004年、ISBN 978-4-8306-1417-0
- 森岡清和 著『素顔の赤血球』金原出版、1994年、ISBN 4-307-50513-1
- 八幡義人 著『赤血球膜研究史』医薬ジャーナル社、2007年、ISBN 978-4-7532-2238-4
- 八幡義人『細胞膜のしくみ : 構造と機能』裳華房〈ポピュラーサイエンス〉、2008年。ISBN 9784785387846。
- 和合治久 編著『動物の血液細胞と生体防御』菜根出版、1997年、ISBN 4-7820-0133-9
- Geoffrey M.Cooper, Robert E.Hausman 著『クーパー細胞生物学』須藤和夫,他,訳、東京化学同人、2008年、ISBN 978-4-8079-0686-4
- H. Lodish, ほか著『分子細胞生物学』石浦章一他 訳、東京化学同人、2010年、ISBN 978-4-8079-0732-8
- Nemi C.Jain 著『最新・獣医血液学』作野幸孝 訳、LLLセミナー、1996年
- Robert K.Murray, Daryl K.Granner, Victor W.Rodwell著『ハーパー・生化学』上代淑人監訳、丸善、2007年、ISBN 978-4-621-07801-3
- Terry W.Campbell, Christine K.Ellis 著 『鳥類とエキゾチックアニマルの血液学、細胞診』斑目広郎訳、文永堂出版、2010年、ISBN 978-4-8300-3228-8
- “HbA1c”. 日本薬学会. 2024年12月24日閲覧。
外部リンク
[編集]- 『赤血球』 - コトバンク
- 『科学映像館』より
- 『赤血球の誕生-エリスロポエチンと造血の場-』(1989年) - キリンビールと三共(現・第一三共)の企画の下でヨネ・プロダクションが制作。
- 『肝臓 生体防御の謎を追って』(1993年) - 体に侵入してきた異物は、補体や赤血球で捕らえられて肝臓に流れ込む。ここで、異物を捕らえた赤血球は肝臓の類洞を通過して肝静脈に入る時にはすっかり浄化されているといわれるが、これらは肝臓に備わった防御機能によるという。第一製薬(現・第一三共)と東レの企画の下でヨネ・プロダクションが制作。
