「ピオグリタゾン」の版間の差分
マウス投与量をヒト患者でなく一般の「平均体重」で換算するのは独自研究。 |
|||
| 83行目: | 83行目: | ||
[[膀胱癌]]、[[膵臓癌]]、[[前立腺癌]]などが統計的有意にリスク増加することが分かっている。 |
[[膀胱癌]]、[[膵臓癌]]、[[前立腺癌]]などが統計的有意にリスク増加することが分かっている。 |
||
米国での10年間の疫学研究の中間報告が[[武田薬品工業]]から示された。それはピオグリタゾンと膀胱癌の関係を示唆するものであった(長期間の使用に因る上昇傾向)<ref>{{cite web |url=https://www.takeda.co.jp/patients/safety-information/pdf/index/actos05.pdf |title=ピオグリタゾン塩酸塩と膀胱癌について |date=2011-06 |accessdate=2014-11-04}}</ref><ref name="pmda">{{cite web |url=http://www.mhlw.go.jp/stf/shingi/2r9852000001le8l-att/2r9852000001lenp.pdf |title=ピオグリタゾン塩酸塩含有製剤の安全対策について |date=2011-06-23 |accessdate=2014-11-04}}</ref><sup>pp1 2(2)</sup>。又相次いで複数の疫学研究の結果が示されたが、膀胱癌リスクの上昇が有るとしたものと無いとしたものが有った<ref name="pmda"/>。これによりFDAは2010年9月に安全性についてのレビューを指示した<ref>{{cite news|last=Peck |first=Peggy|title=FDA Says It Will Review Pioglitazone Safety|url=http://www.medpagetoday.com/Endocrinology/Diabetes/22274|accessdate=18 September 2010|newspaper=MedPage Today|date=September 17, 2010}}</ref>。 |
米国での10年間の疫学研究の中間報告が[[武田薬品工業]]から示された。それはピオグリタゾンと膀胱癌の関係を示唆するものであった(長期間の使用に因る上昇傾向)<ref>{{cite web |url=https://www.takeda.co.jp/patients/safety-information/pdf/index/actos05.pdf |title=ピオグリタゾン塩酸塩と膀胱癌について |date=2011-06 |accessdate=2014-11-04}}</ref><ref name="pmda">{{cite web |url=http://www.mhlw.go.jp/stf/shingi/2r9852000001le8l-att/2r9852000001lenp.pdf |title=ピオグリタゾン塩酸塩含有製剤の安全対策について |date=2011-06-23 |accessdate=2014-11-04}}</ref><sup>pp1 2(2)</sup>。又相次いで複数の疫学研究の結果が示されたが、膀胱癌リスクの上昇が有るとしたものと無いとしたものが有った<ref name="pmda"/>。これによりFDAは2010年9月に安全性についてのレビューを指示した<ref>{{cite news|last=Peck |first=Peggy|title=FDA Says It Will Review Pioglitazone Safety|url=http://www.medpagetoday.com/Endocrinology/Diabetes/22274|accessdate=18 September 2010|newspaper=MedPage Today|date=September 17, 2010}}</ref>。しかし、同疫学調査の最終結果では、膀胱癌リスクの上昇が認められないとされた<ref name="takeda">{{cite web |url=http://www.takeda.co.jp/news/2014/20140829_6713.html |title=ピオグリタゾン含有製剤に関する市販後に課された疫学研究の完了と各国規制当局へのデータ提出について |date=2014-08-29 |accessdate=2014-10-29}}</ref>。尚、リスク上昇の有無について相反する結果が存在する事については、「使用経験有り群と無し群を単純に比較すると、割付バイアスが生じ易い為」と説明されている<ref>{{cite web |url=http://medical.nikkeibp.co.jp/leaf/mem/pub/special/dmns/lecture/201501/540503.html |title=ピオグリタゾンに有意な膀胱癌リスク上昇なし |date=2015-01-31 |accessdate=2015-01-31}}</ref>。 |
||
{{Quotation|ラット及びマウスに24ヵ月間強制経口投与した試験では、ラット雄の3.6㎎/㎏/日以上の群に膀胱腫瘍がみられた。|[[武田薬品工業|武田薬品工業株式会]]|[https://www.pmda.go.jp/PmdaSearch/iyakuDetail/ResultDataSetPDF/400256_3969007F1024_1_32 PMDA - 医薬品添付文書(2015年3月改訂 第29版)日本薬局方 ピオグリタゾン塩酸塩錠(アクトス錠)]}} |
|||
:''[[アメリカ食品医薬品局]]{{enlink|Food_and_Drug_Administration|FDA|s=off}}の勧告<ref name=www.fda.gov_guidance_hed>{{cite web |title=Guidance for Industry Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers |url=http://www.fda.gov/downloads/Drugs/Guidances/UCM078932.pdf |format=pdf |work=www.fda.gov |publisher=アメリカ食品医薬品局(FDA) |month=July |year=2015 |accessdate=2016-5-10}}</ref>に従い ラット 3.6 mg/kg を体表面積換算<ref name=human_equivalent_doses_mouse>ラット用量(mg/kg)をヒト用量(mg/kg)へ体表面積換算するには6.2で除算か0.16で乗算。</ref>すると ヒト 0.58 mg/kg となる。日本人男性(成人)の平均体重 65-70 kg<ref name=www.e-stat.go.jp_2015-10-11_body-weight>{{cite web |title=年齢別体格測定の結果(身長、体重、座高) |url=https://www.e-stat.go.jp/SG1/estat/GL08020103.do?_xlsDownload_&fileId=000007480510&releaseCount=1 |format=xlsx |work=www.e-stat.go.jp |publisher=総務省統計局 |date=2015-10-11 |accessdate=2016-5-10}}</ref>は 37.7-40.6 mg が相当する。それは1日上限の 45 mg<ref name=www.pmda.go.jp_label_serenace>{{cite web |title=医薬品添付文書(2015年3月改訂 第29版) 日本薬局方 ピオグリタゾン塩酸塩錠(アクトス錠) |url=https://www.pmda.go.jp/PmdaSearch/iyakuDetail/ResultDataSetPDF/400256_3969007F1024_1_32 |format=pdf |work=www.pmda.go.jp |publisher=武田薬品工業株式会 |month=3 |year=2015 |accessdate=2016-5-10}}</ref>よりも少ない。'' |
|||
2015年7月、武田薬品の関連企業が出資した膀胱癌に関する欧州でのコホート研究の結果が発表された。最長フォローアップ10年間の観察の結果、膀胱癌の[[リスク比#ハザード比|ハザード比]]は 1.06 (95%信頼区間 0.89-1.26) であった。[[前立腺癌]]のハザード比は 1.13 (95%信頼区間 1.02-1.26) 、[[膵臓癌]]のハザード比は 1.41 (95%信頼区間 1.16-1.71) であった。前立腺癌、特に膵臓癌のリスク増加と関連が示された<ref name="pmid26197187">{{cite journal |author=Lewis JD, Habel LA, Quesenberry CP, Strom BL, Peng T, Hedderson MM, Ehrlich SF, Mamtani R, Bilker W, Vaughn DJ, Nessel L, Van Den Eeden SK, Ferrara A |title=Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes |journal=[[:en:JAMA]] |volume=314 |issue=3 |page=265-77 |date=2015-7-21 |url=http://jama.jamanetwork.com/article.aspx?articleid=2397834 |pmid=26197187 |doi=10.1001/jama.2015.7996}}</ref>。 |
2015年7月、武田薬品の関連企業が出資した膀胱癌に関する欧州でのコホート研究の結果が発表された。最長フォローアップ10年間の観察の結果、膀胱癌の[[リスク比#ハザード比|ハザード比]]は 1.06 (95%信頼区間 0.89-1.26) であった。[[前立腺癌]]のハザード比は 1.13 (95%信頼区間 1.02-1.26) 、[[膵臓癌]]のハザード比は 1.41 (95%信頼区間 1.16-1.71) であった。前立腺癌、特に膵臓癌のリスク増加と関連が示された<ref name="pmid26197187">{{cite journal |author=Lewis JD, Habel LA, Quesenberry CP, Strom BL, Peng T, Hedderson MM, Ehrlich SF, Mamtani R, Bilker W, Vaughn DJ, Nessel L, Van Den Eeden SK, Ferrara A |title=Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes |journal=[[:en:JAMA]] |volume=314 |issue=3 |page=265-77 |date=2015-7-21 |url=http://jama.jamanetwork.com/article.aspx?articleid=2397834 |pmid=26197187 |doi=10.1001/jama.2015.7996}}</ref>。 |
||
2016年3月、大規模な人口ベースのコホート研究結果が公表された。[[膀胱癌]]の発生率は、ピオグリタゾンが121.0人/10万人/年、他の糖尿病薬が88.9人/10万人/年、[[リスク比#ハザード比|ハザード比]] 1.63(95%信頼区間 1.22-2.19)であった。この研究結果は、ピオグリタゾンが膀胱癌のリスク増加と関連していることを示した<ref name="pmid27029385">{{cite journal |author=Tuccori M, Filion KB, Yin H, Yu OH, Platt RW, Azoulay L |title=Pioglitazone use and risk of bladder cancer: population based cohort study |journal=[[:en:British Medical Journal]] (BMJ) |volume=352 |page=i1541 |date=2016-3-30 |url=http://www.bmj.com/content/352/bmj.i1541 |pmc=4816602 |pmid=27029385 |doi=10.1136/bmj.i1541}}</ref>。 |
2016年3月、大規模な人口ベースのコホート研究結果が公表された。[[膀胱癌]]の発生率は、ピオグリタゾンが121.0人/10万人/年、他の糖尿病薬が88.9人/10万人/年、[[リスク比#ハザード比|ハザード比]] 1.63(95%信頼区間 1.22-2.19)であった。この研究結果は、ピオグリタゾンが膀胱癌のリスク増加と関連していることを示した<ref name="pmid27029385">{{cite journal |author=Tuccori M, Filion KB, Yin H, Yu OH, Platt RW, Azoulay L |title=Pioglitazone use and risk of bladder cancer: population based cohort study |journal=[[:en:British Medical Journal]] (BMJ) |volume=352 |page=i1541 |date=2016-3-30 |url=http://www.bmj.com/content/352/bmj.i1541 |pmc=4816602 |pmid=27029385 |doi=10.1136/bmj.i1541}}</ref>。この報告は、割付バイアスでは説明できない統計的に有意なリスク増加である。 |
||
2016年3月の報告は、割付バイアスでは説明できない統計的に有意なリスク増加である。 |
|||
==米国での訴訟== |
==米国での訴訟== |
||
| 104行目: | 98行目: | ||
米連邦裁判所でのアクトス関連訴訟は2700件以上起こされている<ref>http://www.bloomberg.co.jp/news/123-N3QN506K50Z301.html</ref>。 |
米連邦裁判所でのアクトス関連訴訟は2700件以上起こされている<ref>http://www.bloomberg.co.jp/news/123-N3QN506K50Z301.html</ref>。 |
||
==参 |
==参考資料== |
||
{{Reflist|colwidth=30em}} |
{{Reflist|colwidth=30em}} |
||
2016年6月26日 (日) 08:56時点における版
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | アクトス |
| Drugs.com | monograph |
| MedlinePlus | a699016 |
| ライセンス | EMA:リンク、US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 | |
| 薬物動態データ | |
| 血漿タンパク結合 | >99% |
| 代謝 | liver (CYP2C8) |
| 半減期 | 3–7 時間 |
| 排泄 | 胆汁排泄型 |
| データベースID | |
| CAS番号 |
111025-46-8 |
| ATCコード | A10BG03 (WHO) |
| PubChem | CID: 4829 |
| IUPHAR/BPS | 2694 |
| DrugBank |
DB01132 |
| ChemSpider |
4663 |
| UNII |
X4OV71U42S |
| KEGG |
D08378 |
| ChEBI |
CHEBI:8228 |
| ChEMBL |
CHEMBL595 |
| 化学的データ | |
| 化学式 | C19H20N2O3S |
| 分子量 | 356.44 g/mol |
| |
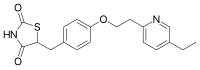
ピオグリタゾン(Pioglitazone、商品名:アクトス)はチアゾリジン(TZD)系の経口血糖降下薬である。 日本においては1999年9月22日に武田薬品工業が承認を取得している[1]。2009年12月21日付けで再審査結果が通知され、効能・効果及び用法・用量に変更なく了解された。
2012年12月現在は後発品も多数販売されている[2]。
薬理
ピオグリタゾンは核内転写因子であるPPARγのアゴニストとして作用し、TNF-αの発現を抑制することでインスリン抵抗性を改善する。また、インスリン受容体に作用してインスリン抵抗性を軽減し、肝における糖産生を抑制し、末梢組織における糖利用を高め血糖を低下させる。この作用は、インスリン抵抗性の主因である細胞内インスリン情報伝達機構を正常化することによると推測される[3]。
効能・効果
2型糖尿病。
米国では、非アルコール性脂肪性肝炎にも有効であるとの研究も有る[4]。
禁忌
- 心不全の患者及び心不全の既往歴のある患者[ 動物試験において循環血漿量の増加に伴う代償性の変化と考えられる心重量の増加がみられており、また、臨床的にも心不全を増悪あるいは発症したとの報告がある。]
- 重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[ 輸液、インスリンによる速やかな高血糖の是正が必須となる。]
- 重篤な肝機能障害のある患者[ 本剤は主に肝臓で代謝されるため、蓄積するおそれがある。]
- 重篤な腎機能障害のある患者
- 重症感染症、手術前後、重篤な外傷のある患者 [ インスリン注射による血糖管理が望まれるので本剤の投与は適さない。]
- 本剤の成分に対し過敏症の既往歴のある患者
- 妊婦又は妊娠している可能性のある婦人
副作用
重大な副作用として、添付文書に 心不全、浮腫、肝機能障害、黄疸、低血糖症状、横紋筋融解症、間質性肺炎、胃潰瘍 が記載されている。
膀胱癌、膵臓癌、前立腺癌などが統計的有意にリスク増加することが分かっている。
米国での10年間の疫学研究の中間報告が武田薬品工業から示された。それはピオグリタゾンと膀胱癌の関係を示唆するものであった(長期間の使用に因る上昇傾向)[5][6]pp1 2(2)。又相次いで複数の疫学研究の結果が示されたが、膀胱癌リスクの上昇が有るとしたものと無いとしたものが有った[6]。これによりFDAは2010年9月に安全性についてのレビューを指示した[7]。しかし、同疫学調査の最終結果では、膀胱癌リスクの上昇が認められないとされた[8]。尚、リスク上昇の有無について相反する結果が存在する事については、「使用経験有り群と無し群を単純に比較すると、割付バイアスが生じ易い為」と説明されている[9]。
2015年7月、武田薬品の関連企業が出資した膀胱癌に関する欧州でのコホート研究の結果が発表された。最長フォローアップ10年間の観察の結果、膀胱癌のハザード比は 1.06 (95%信頼区間 0.89-1.26) であった。前立腺癌のハザード比は 1.13 (95%信頼区間 1.02-1.26) 、膵臓癌のハザード比は 1.41 (95%信頼区間 1.16-1.71) であった。前立腺癌、特に膵臓癌のリスク増加と関連が示された[10]。
2016年3月、大規模な人口ベースのコホート研究結果が公表された。膀胱癌の発生率は、ピオグリタゾンが121.0人/10万人/年、他の糖尿病薬が88.9人/10万人/年、ハザード比 1.63(95%信頼区間 1.22-2.19)であった。この研究結果は、ピオグリタゾンが膀胱癌のリスク増加と関連していることを示した[11]。この報告は、割付バイアスでは説明できない統計的に有意なリスク増加である。
米国での訴訟
米国にて、2014年2月、ピオグリタゾンが膀胱癌を誘発するリスクについて患者や医師に警告する事を怠ったとして、武田薬品工業及びイーライ・リリーが提訴された。米連邦地裁は2014年9月、懲罰的損害賠償金として総額約90億ドル(約9160億円)の支払いを命じた[12]が、2014年10月27日、3680万ドルに減額した[13]。
武田薬品工業は日米欧各国の規制当局に対して、市販後に課された10年間の疫学研究の結果を示し、膀胱癌発生リスクの統計学的有意な増加は見られなかったと報告した[8]。また、米ネバダ州での同様の訴訟について、裁判所陪審は原告の膀胱癌はピオグリタゾンに因るものではないとの評決を下している[13]。
2014年4月に米国の男性が武田薬品工業を相手取って起こしていた訴訟で、ルイジアナ州ラファイエットの連邦地裁の陪審は4月7日、武田薬品工業に60億ドル(約6200億円)の懲罰的損害賠償金の支払い義務があると認定した。武田薬品工業#医療用医薬品をめぐり米連邦裁判所で判断
米連邦裁判所でのアクトス関連訴訟は2700件以上起こされている[14]。
参考資料
- ^ “医薬品インタビューフォーム”. 2014年10月29日閲覧。
- ^ “QLifeお薬検索 ピオグリタゾン塩酸塩”. 2014年10月29日閲覧。
- ^ “アクトス錠15/アクトス錠30 添付文書”. 2014年10月29日閲覧。
- ^ Belfort, R; Harrison, SA; Brown, K; Darland, C; Finch, J; Hardies, J; Balas, B; Gastaldelli, A et al. (November 2006). “A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis”. N. Engl. J. Med. 355 (22): 2297–307. doi:10.1056/NEJMoa060326. PMID 17135584.
- ^ “ピオグリタゾン塩酸塩と膀胱癌について” (2011年6月). 2014年11月4日閲覧。
- ^ a b “ピオグリタゾン塩酸塩含有製剤の安全対策について” (2011年6月23日). 2014年11月4日閲覧。
- ^ Peck, Peggy (September 17, 2010). “FDA Says It Will Review Pioglitazone Safety”. MedPage Today 18 September 2010閲覧。
- ^ a b “ピオグリタゾン含有製剤に関する市販後に課された疫学研究の完了と各国規制当局へのデータ提出について” (2014年8月29日). 2014年10月29日閲覧。
- ^ “ピオグリタゾンに有意な膀胱癌リスク上昇なし” (2015年1月31日). 2015年1月31日閲覧。
- ^ Lewis JD, Habel LA, Quesenberry CP, Strom BL, Peng T, Hedderson MM, Ehrlich SF, Mamtani R, Bilker W, Vaughn DJ, Nessel L, Van Den Eeden SK, Ferrara A (2015-7-21). “Pioglitazone Use and Risk of Bladder Cancer and Other Common Cancers in Persons With Diabetes”. en:JAMA 314 (3): 265-77. doi:10.1001/jama.2015.7996. PMID 26197187.
- ^ Tuccori M, Filion KB, Yin H, Yu OH, Platt RW, Azoulay L (2016-3-30). “Pioglitazone use and risk of bladder cancer: population based cohort study”. en:British Medical Journal (BMJ) 352: i1541. doi:10.1136/bmj.i1541. PMC 4816602. PMID 27029385.
- ^ “武田「アクトス」にぼうこうがん責任なし-ネバダ州地裁陪審” (2014年5月22日). 2014年10月29日閲覧。
- ^ a b 武田薬品のアクトス訴訟、米裁判所が賠償金を大幅減額, (2014-10-27) 2014年10月29日閲覧。
- ^ http://www.bloomberg.co.jp/news/123-N3QN506K50Z301.html
