「弾性線維」の版間の差分
Smilesworth (会話 | 投稿記録) en:Elastic fiber (12:26, 30 December 2023 UTC) の翻訳をもとに作成 タグ: リダイレクト解除 サイズの大幅な増減 |
|||
| 1行目: | 1行目: | ||
{{Infobox anatomy |
|||
#REDIRECT [[エラスチン]] |
|||
| Name = Elastic fiber |
|||
| Latin = |
|||
| Image = Gray377.png |
|||
| Caption = 若年ウサギの皮下組織。弾性線維(Elastic fibres)が示されている。 |
|||
| System = |
|||
| Precursor = |
|||
}} |
|||
'''弾性線維'''(だんせいせんい、{{Lang-en-short|elastic fiber}})、'''弾力線維'''(だんりょくせんい)または'''エラスチン線維'''(エラスチンせんい)は、[[タンパク質]](主に[[エラスチン]])の束から構成される、[[細胞外マトリックス]]の必須の構成要素である。[[線維芽細胞]]、[[内皮細胞]]、[[平滑筋]]細胞、{{仮リンク|気道上皮|en|Respiratory epithelium}}細胞などさまざまな細胞種から産生される<ref name=":0">{{cite journal|date=November 2019|title=Elastin architecture|journal=Matrix Biology|volume=84|pages=4–16|doi=10.1016/j.matbio.2019.07.005|pmid=31301399|vauthors=Vindin H, Mithieux SM, Weiss AS|s2cid=196458819}}</ref>。弾性線維は何倍にも伸長することができ、また弛緩した場合にはエネルギーを喪失することなく元の長さに戻ることができる。弾性線維には{{仮リンク|エラウニン|en|Elaunin}}、[[オキシタラン]]線維も含まれる場合がある。 |
|||
弾性線維はエラストジェネシス(elastogenesis)と呼ばれる過程によって形成される<ref name=":1">{{cite journal|date=2005|title=Elastin|journal=Advances in Protein Chemistry|volume=70|pages=437–61|publisher=Elsevier|doi=10.1016/s0065-3233(05)70013-9|isbn=978-0-12-034270-9|pmid=15837523|vauthors=Mithieux SM, Weiss AS}}</ref><ref name="Thunnissen">{{cite journal|date=August 2021|title=Elastin in pulmonary pathology: relevance in tumours with a lepidic or papillary appearance. A comprehensive understanding from a morphological viewpoint|url=|journal=Histopathology|volume=80|issue=3|pages=457–467|doi=10.1111/his.14537|pmc=9293161|pmid=34355407|vauthors=Thunnissen E, Motoi N, Minami Y, Matsubara D, Timens W, Nakatani Y, Ishikawa Y, Baez-Navarro X, Radonic T, Blaauwgeers H, Borczuk AC, Noguchi M|doi-access=free}}</ref>。この過程はきわめて複雑であり、{{仮リンク|EFEMP2|en|EFEMP2|label=ファイブリン4}}、{{仮リンク|FBLN5|en|FBLN5|label=ファイブリン5}}、LTBP4、{{仮リンク|MFAP4|en|MFAP4}}など、いくつかの重要なタンパク質が関与する<ref name=":2">{{cite journal|date=September 2015|title=Latent TGF-β-binding proteins|journal=Matrix Biology|volume=47|pages=44–53|doi=10.1016/j.matbio.2015.05.005|pmc=4844006|pmid=25960419|vauthors=Robertson IB, Horiguchi M, Zilberberg L, Dabovic B, Hadjiolova K, Rifkin DB}}</ref><ref name=":3">{{cite journal|date=January 2016|title=Characterization of Microfibrillar-associated Protein 4 (MFAP4) as a Tropoelastin- and Fibrillin-binding Protein Involved in Elastic Fiber Formation|journal=The Journal of Biological Chemistry|volume=291|issue=3|pages=1103–14|doi=10.1074/jbc.M115.681775|pmc=4714194|pmid=26601954|vauthors=Pilecki B, Holm AT, Schlosser A, Moeller JB, Wohl AP, Zuk AV, Heumüller SE, Wallis R, Moestrup SK, Sengle G, Holmskov U, Sorensen GL|display-authors=6|doi-access=free}}</ref><ref name=":4">{{cite journal|date=April 2009|title=Dual functions for LTBP in lung development: LTBP-4 independently modulates elastogenesis and TGF-beta activity|journal=Journal of Cellular Physiology|volume=219|issue=1|pages=14–22|doi=10.1002/jcp.21643|pmc=2719250|pmid=19016471|vauthors=Dabovic B, Chen Y, Choi J, Vassallo M, Dietz HC, Ramirez F, von Melchner H, Davis EC, Rifkin DB|display-authors=6}}</ref><ref name=":5">{{cite journal|date=January 2002|title=Fibulin-5/DANCE is essential for elastogenesis in vivo|journal=Nature|volume=415|issue=6868|pages=171–5|doi=10.1038/415171a|pmid=11805835|vauthors=Nakamura T, Lozano PR, Ikeda Y, Iwanaga Y, Hinek A, Minamisawa S, Cheng CF, Kobuke K, Dalton N, Takada Y, Tashiro K, Ross J, Honjo T, Chien KR|display-authors=6|s2cid=4343659}}</ref>。弾性線維の可溶性単量体型前駆体であるトロポエラスチンは、エラスチン生成細胞によって産生されて細胞表面へ送られる。細胞から分泌された後、トロポエラスチンは直径約200 nmの粒子へと自己重合する。この過程は[[コアセルベート|コアセルベーション]]と呼ばれ、トロポエラスチンの疎水性ドメイン間の相互作用を伴う[[エントロピー]]駆動過程であり、[[グリコサミノグリカン]]、[[ヘパラン硫酸]]やその他の分子によって媒介される<ref name=":6">{{cite journal|date=September 2011|title=Coacervation of tropoelastin|journal=Advances in Colloid and Interface Science|volume=167|issue=1–2|pages=94–103|doi=10.1016/j.cis.2010.10.003|pmid=21081222|vauthors=Yeo GC, Keeley FW, Weiss AS}}</ref><ref name=":7">{{cite journal|date=July 1999|title=Glycosaminoglycans mediate the coacervation of human tropoelastin through dominant charge interactions involving lysine side chains|journal=The Journal of Biological Chemistry|volume=274|issue=31|pages=21719–24|doi=10.1074/jbc.274.31.21719|pmid=10419484|vauthors=Wu WJ, Vrhovski B, Weiss AS|doi-access=free}}</ref><ref name=":8">{{cite journal|date=July 2008|title=Glycosaminoglycan-mediated coacervation of tropoelastin abolishes the critical concentration, accelerates coacervate formation, and facilitates spherule fusion: implications for tropoelastin microassembly|journal=Biomacromolecules|volume=9|issue=7|pages=1739–44|doi=10.1021/bm7013153|pmid=18547105|vauthors=Tu Y, Weiss AS}}</ref>。こうした粒子はさらに融合して直径1–2 μmの球状となり、細胞表面から移動しながら成長を続け、[[フィブリリン]]からなるミクロフィブリルの足場に沈着する<ref name=":0" />。 |
|||
ミクロフィブリル上に沈着したトロポエラスチンは、[[タンパク質-リシン-6-オキシダーゼ|リジルオキシダーゼ]](LOX)ファミリーやLOX様銅依存性アミンオキシダーゼファミリーのメンバーによって広範にわたって架橋反応が行われることで不溶化し、無定形エラスチン(amorphous elastin)となる。無定形エラスチンはきわめて弾力性の高い不溶性ポリマーであり、ヒトの一生を通じて代謝的に安定である<ref name=":0" />。これら2つのファミリーの酵素はトロポエラスチンに含まれる多くの[[リジン]]残基と反応し、{{仮リンク|酸化的脱アミノ化|en|Oxidative deamination}}によって反応性[[アルデヒド]]や[[アリシン (アミノ酸)|アリジン]]を形成する<ref name=":9">{{cite journal|date=October 2006|title=Lysyl oxidase: an oxidative enzyme and effector of cell function|journal=Cellular and Molecular Life Sciences|volume=63|issue=19–20|pages=2304–16|doi=10.1007/s00018-006-6149-9|pmid=16909208|vauthors=Lucero HA, Kagan HM|s2cid=31863161}}</ref>。 |
|||
こうした反応性アルデヒドやアリジンは他のリジンやアリジン残基と反応し、[[デスモシン]]や{{仮リンク|イソデスモシン|en|Isodesmosine}}、その他多くの他官能性架橋を形成し、周囲のトロポエラスチン分子を連結して広く架橋されたエラスチンマトリックスを作り出す。この過程によって多種多様な分子内・分子間架橋が形成され<ref name=":10">{{cite journal|date=September 2018|title=Elastin is heterogeneously cross-linked|journal=The Journal of Biological Chemistry|volume=293|issue=39|pages=15107–15119|doi=10.1074/jbc.RA118.004322|pmc=6166741|pmid=30108173|vauthors=Schräder CU, Heinz A, Majovsky P, Karaman Mayack B, Brinckmann J, Sippl W, Schmelzer CE|doi-access=free}}</ref>、エラスチンの耐久性や持続性に寄与している。架橋型エラスチンの維持は、{{仮リンク|LOXL1|en|LOXL1}}などいくつかのタンパク質によって担われている<ref name="pmid14745449">{{cite journal|date=February 2004|title=Elastic fiber homeostasis requires lysyl oxidase-like 1 protein|journal=Nature Genetics|volume=36|issue=2|pages=178–82|doi=10.1038/ng1297|pmid=14745449|vauthors=Liu X, Zhao Y, Gao J, Pawlyk B, Starcher B, Spencer JA, Yanagisawa H, Zuo J, Li T|display-authors=6|doi-access=free}}</ref>。 |
|||
成熟型弾性線維は無定形エラスチンのコアからなり、グリコサミノグリカン、ヘパラン硫酸<ref name=":11">{{cite journal|date=February 2005|title=Heparan sulphate interacts with tropoelastin, with some tropoelastin peptides and is present in human dermis elastic fibers|journal=Matrix Biology|volume=24|issue=1|pages=15–25|doi=10.1016/j.matbio.2004.12.001|pmid=15748998|vauthors=Gheduzzi D, Guerra D, Bochicchio B, Pepe A, Tamburro AM, Quaglino D, Mithieux S, Weiss AS, Pasquali Ronchetti I|display-authors=6}}</ref>、そしてミクロフィブリル結合性[[糖タンパク質]]、フィブリリン、{{仮リンク|ファイブリン|en|Fibulin}}、{{仮リンク|GLB1|en|GLB1|label=エラスチン受容体}}といったタンパク質に囲まれている。 |
|||
== 分布 == |
|||
[[File:STD 190219 SWITCH Tissue 2 93x CMLE 20SNR 50IT Elastin.png|thumb|ヒト肺の臓側[[胸膜]]の太い弾性線維]] |
|||
弾性線維は、[[皮膚]]、[[肺]]、[[動脈]]、[[静脈]]、[[結合組織|固有結合組織]]、[[弾性軟骨]]、[[胚]]組織やその他機械的伸展の必要性がある組織に存在している<ref name=":0" />。肺には太い弾性線維と細い(微細な)弾性線維が存在する<ref name="Thunnissen" />。 |
|||
弾性線維は[[瘢痕]]、[[ケロイド]]、{{仮リンク|皮膚線維腫|en|Dermatofibroma}}には存在せず、{{仮リンク|斑状皮膚萎縮症|en|Anetoderma}}では大きく減少しているか、または存在しない<ref name="elasticFibersScars">{{cite book |vauthors=Ackerman AB, Böer A, Bennin B, Gottlieb GJ |title=Histologic Diagnosis of Inflammatory Skin Diseases An Algorithmic Method Based on Pattern Analysis: Embryologic, Histologic, and Anatomic Aspects: Elastic Fibers |quote=Elastic fibers are absent from scarring processes such as scars, keloids, and dermatofibromas |publisher=Ardor Scribendi |edition=Third |date=January 2005 |pages=522 |url=https://www.derm101.com/inflammatory/embryologic-histologic-and-anatomic-aspects/elastic-fibers/ |isbn=9781893357259 |access-date=December 28, 2016 |archive-date=June 20, 2018 |archive-url=https://web.archive.org/web/20180620024213/https://www.derm101.com/inflammatory/embryologic-histologic-and-anatomic-aspects/elastic-fibers/ |url-status=dead}}</ref>。 |
|||
== 組織学 == |
|||
組織切片中の弾性線維は、{{仮リンク|シッフ試薬|en|Schiff test|label=アルデヒド・フクシン染色}}、{{仮リンク|オルセイン|en|Orcein}}染色<ref name="urlConnective Tissue">{{cite web |url=http://www.courseweb.uottawa.ca/medicine-histology/English/SS_BasicTissues/Connective_Tissue.htm |title=Connective Tissue |url-status=dead |archive-url=https://web.archive.org/web/20081107231710/http://www.courseweb.uottawa.ca/medicine-histology/English/SS_BasicTissues/Connective_Tissue.htm |archive-date=2008-11-07 |access-date=2024-05-12}}</ref>、{{仮リンク|ワイゲルト染色|en|Weigert's elastic stain}}によって良く染色される。 |
|||
PBT(permanganate-bisulfite-toluidine blue)反応は、偏光下で弾性線維を観察するための選択的かつ高感度の手法であり、[[複屈折]]によって弾性線維中のエラスチン分子のきわめて規則的構造が示される<ref>{{Cite journal|last=Fischer|first=J.|date=1979|title=Ultrastructure of elastic fibers as shown by polarization optics after the topo-optical permanganate-bisulfite-toluidine blue (PBT) reaction|url=https://pubmed.ncbi.nlm.nih.gov/93385|journal=Acta Histochemica|volume=65|issue=1|pages=87–98|doi=10.1016/S0065-1281(79)80037-9|issn=0065-1281|pmid=93385}}</ref>。通常の光学顕微鏡でこうした構造を観察することは容易ではない。 |
|||
== 欠陥と疾患 == |
|||
[[皮膚弛緩症]]や[[ウィリアムズ症候群]]ではエラスチンマトリックスに欠陥がみられ、エラスチン遺伝子の変化が直接関係している<ref>{{Cite web |title=Entry - #123700 - CUTIS LAXA, AUTOSOMAL DOMINANT 1; ADCL1 - OMIM |url=https://omim.org/entry/123700 |website=omim.org |access-date=2024-05-12}}</ref><ref>{{Cite journal|last=Lowery|first=M. C.|last2=Morris|first2=C. A.|last3=Ewart|first3=A.|last4=Brothman|first4=L. J.|last5=Zhu|first5=X. L.|last6=Leonard|first6=C. O.|last7=Carey|first7=J. C.|last8=Keating|first8=M.|last9=Brothman|first9=A. R.|date=1995-07|title=Strong correlation of elastin deletions, detected by FISH, with Williams syndrome: evaluation of 235 patients|url=https://pubmed.ncbi.nlm.nih.gov/7611295|journal=American Journal of Human Genetics|volume=57|issue=1|pages=49–53|issn=0002-9297|pmc=1801249|pmid=7611295}}</ref>。 |
|||
[[α1-アンチトリプシン欠乏症]]では、[[エラスターゼ]]を主としたプロテアーゼによってエラスチンが過剰に破壊され、[[慢性閉塞性肺疾患|COPD]]に至る可能性がある<ref>{{Cite web |title=α1-アンチトリプシン欠乏症 診療の手引き2016 - 学会誌・出版物|一般社団法人日本呼吸器学会 |url=https://www.jrs.or.jp/publication/jrs_guidelines/20161001123252.html |website=一般社団法人日本呼吸器学会 |access-date=2024-05-12 |language=ja}}</ref>。 |
|||
{{仮リンク|Buschke-Ollendorff症候群|en|Buschke–Ollendorff syndrome}}、{{仮リンク|メンケス病|en|Menkes disease}}、[[弾性線維性仮性黄色腫]]、[[マルファン症候群]]は、銅代謝やリジルオキシダーゼの欠陥、もしくはミクロフィブリルの欠陥(フィブリリンやファイブリンの欠陥)と関連している<ref>{{Cite journal|last=Uitto|first=J.|last2=Ryhänen|first2=L.|last3=Abraham|first3=P. A.|last4=Perejda|first4=A. J.|date=1982-07|title=Elastin in diseases|url=https://pubmed.ncbi.nlm.nih.gov/7086187|journal=The Journal of Investigative Dermatology|volume=79 Suppl 1|pages=160s–168s|doi=10.1111/1523-1747.ep12546063|issn=0022-202X|pmid=7086187}}</ref>。 |
|||
{{仮リンク|ハーラー症候群|en|Hurler syndrome|redirect=1}}は[[ライソゾーム病]]の1つであり、弾性線維形成の欠陥と関連している<ref>{{Cite journal|last=Hinek|first=A.|last2=Wilson|first2=S. E.|date=2000-03|title=Impaired elastogenesis in Hurler disease: dermatan sulfate accumulation linked to deficiency in elastin-binding protein and elastic fiber assembly|url=https://pubmed.ncbi.nlm.nih.gov/10702409|journal=The American Journal of Pathology|volume=156|issue=3|pages=925–938|doi=10.1016/S0002-9440(10)64961-9|issn=0002-9440|pmc=1876830|pmid=10702409}}</ref>。 |
|||
== 弾性線維症 == |
|||
弾性線維症(エラストーシス、elastosis)は組織に弾性線維が蓄積する疾患であり、[[変性疾患]]の一種である<ref name="dermnetnz">{{cite web |url=https://dermnetnz.org/topics/elastosis/ |title=Elastosis |vauthors=Wright B |website=DermNet NZ |access-date=2024-05-12}}</ref>。その原因は多くあるが、最も一般的なものは皮膚の{{仮リンク|日光弾性線維症|en|Actinic elastosis}}(光線性弾性線維症)であり、太陽光へ長期間過剰に曝露することで[[光老化]]と呼ばれる過程によって引き起こされる。その他、{{仮リンク|蛇行性穿孔性弾性線維症|en|Elastosis perforans serpiginosa}}、[[:en:Perforating_calcific_elastosis|perforating calcific elastosis]]、[[:en:Linear_focal_elastosis|linear focal elastosis]]などがある<ref name="dermnetnz" />。 |
|||
{| class="wikitable" |
|||
|+ 皮膚の弾性線維症 |
|||
! 疾患 !! 特徴 !! 組織病理 |
|||
|- |
|||
! {{仮リンク|日光弾性線維症|en|Actinic elastosis}}(光線性弾性線維症) |
|||
| [[真皮]]の乳頭層と網状層の[[コラーゲン]]線維がエラスチンに置き換わる |
|||
| [[File:Micrograph of solar elastosis.jpg|190px]] |
|||
|- |
|||
! {{仮リンク|蛇行性穿孔性弾性線維症|en|Elastosis perforans serpiginosa}} |
|||
| 変性した弾性線維が経表皮的に排出される<ref name="HosenLamoen2012">{{cite journal | vauthors = Hosen MJ, Lamoen A, De Paepe A, Vanakker OM | title = Histopathology of pseudoxanthoma elasticum and related disorders: histological hallmarks and diagnostic clues | journal = Scientifica | volume = 2012 | pages = 598262 | year = 2012 | pmid = 24278718 | pmc = 3820553 | doi = 10.6064/2012/598262 | doi-access = free }}<br>-[https://creativecommons.org/licenses/by/3.0/ Creative Commons Attribution 3.0 Unported] license</ref> |
|||
| [[File:Histopathology of elastosis perforans serpiginosa.jpg|100px]] |
|||
|- |
|||
! [[:en:Perforating_calcific_elastosis|Perforating calcific elastosis]] |
|||
| 真皮内で短い弾性線維が凝集する<ref name="HosenLamoen2012" /> |
|||
| [[File:Histopathology of perforating calcific elastosis.jpg|190px]] |
|||
|- |
|||
! [[:en:Linear_focal_elastosis|Linear focal elastosis]] |
|||
| 真皮乳頭層に断片化した弾性線維性物質(elastotic material)が蓄積し、弾性線維が経皮的に排出される<ref name="HosenLamoen2012" /> |
|||
|[[File:Histopathology of linear focal elastosis.jpg|190px]] |
|||
|} |
|||
== 出典 == |
|||
{{reflist}} |
|||
== 関連項目 == |
|||
* [[弾性型動脈]] |
|||
== 外部リンク == |
|||
* {{BUHistology|00801ooa}} - "Connective Tissue elastic fibers " |
|||
* {{UCDavisOrganology|TermsCells&Tissues/connective/elastic/elastic2}} - "Connective tissue, elastic (LM, High)" |
|||
{{DEFAULTSORT:たんせいせんい}} |
|||
[[Category:構造タンパク質]] |
|||
2024年5月12日 (日) 08:53時点における最新版
| Elastic fiber | |
|---|---|
 若年ウサギの皮下組織。弾性線維(Elastic fibres)が示されている。 | |
| 表記・識別 | |
| グレイ解剖学 | p.377 |
| FMA | 63868 |
| 解剖学用語 | |
弾性線維(だんせいせんい、英: elastic fiber)、弾力線維(だんりょくせんい)またはエラスチン線維(エラスチンせんい)は、タンパク質(主にエラスチン)の束から構成される、細胞外マトリックスの必須の構成要素である。線維芽細胞、内皮細胞、平滑筋細胞、気道上皮細胞などさまざまな細胞種から産生される[1]。弾性線維は何倍にも伸長することができ、また弛緩した場合にはエネルギーを喪失することなく元の長さに戻ることができる。弾性線維にはエラウニン、オキシタラン線維も含まれる場合がある。
弾性線維はエラストジェネシス(elastogenesis)と呼ばれる過程によって形成される[2][3]。この過程はきわめて複雑であり、ファイブリン4、ファイブリン5、LTBP4、MFAP4など、いくつかの重要なタンパク質が関与する[4][5][6][7]。弾性線維の可溶性単量体型前駆体であるトロポエラスチンは、エラスチン生成細胞によって産生されて細胞表面へ送られる。細胞から分泌された後、トロポエラスチンは直径約200 nmの粒子へと自己重合する。この過程はコアセルベーションと呼ばれ、トロポエラスチンの疎水性ドメイン間の相互作用を伴うエントロピー駆動過程であり、グリコサミノグリカン、ヘパラン硫酸やその他の分子によって媒介される[8][9][10]。こうした粒子はさらに融合して直径1–2 μmの球状となり、細胞表面から移動しながら成長を続け、フィブリリンからなるミクロフィブリルの足場に沈着する[1]。
ミクロフィブリル上に沈着したトロポエラスチンは、リジルオキシダーゼ(LOX)ファミリーやLOX様銅依存性アミンオキシダーゼファミリーのメンバーによって広範にわたって架橋反応が行われることで不溶化し、無定形エラスチン(amorphous elastin)となる。無定形エラスチンはきわめて弾力性の高い不溶性ポリマーであり、ヒトの一生を通じて代謝的に安定である[1]。これら2つのファミリーの酵素はトロポエラスチンに含まれる多くのリジン残基と反応し、酸化的脱アミノ化によって反応性アルデヒドやアリジンを形成する[11]。
こうした反応性アルデヒドやアリジンは他のリジンやアリジン残基と反応し、デスモシンやイソデスモシン、その他多くの他官能性架橋を形成し、周囲のトロポエラスチン分子を連結して広く架橋されたエラスチンマトリックスを作り出す。この過程によって多種多様な分子内・分子間架橋が形成され[12]、エラスチンの耐久性や持続性に寄与している。架橋型エラスチンの維持は、LOXL1などいくつかのタンパク質によって担われている[13]。
成熟型弾性線維は無定形エラスチンのコアからなり、グリコサミノグリカン、ヘパラン硫酸[14]、そしてミクロフィブリル結合性糖タンパク質、フィブリリン、ファイブリン、エラスチン受容体といったタンパク質に囲まれている。
分布[編集]

弾性線維は、皮膚、肺、動脈、静脈、固有結合組織、弾性軟骨、胚組織やその他機械的伸展の必要性がある組織に存在している[1]。肺には太い弾性線維と細い(微細な)弾性線維が存在する[3]。
弾性線維は瘢痕、ケロイド、皮膚線維腫には存在せず、斑状皮膚萎縮症では大きく減少しているか、または存在しない[15]。
組織学[編集]
組織切片中の弾性線維は、アルデヒド・フクシン染色、オルセイン染色[16]、ワイゲルト染色によって良く染色される。
PBT(permanganate-bisulfite-toluidine blue)反応は、偏光下で弾性線維を観察するための選択的かつ高感度の手法であり、複屈折によって弾性線維中のエラスチン分子のきわめて規則的構造が示される[17]。通常の光学顕微鏡でこうした構造を観察することは容易ではない。
欠陥と疾患[編集]
皮膚弛緩症やウィリアムズ症候群ではエラスチンマトリックスに欠陥がみられ、エラスチン遺伝子の変化が直接関係している[18][19]。
α1-アンチトリプシン欠乏症では、エラスターゼを主としたプロテアーゼによってエラスチンが過剰に破壊され、COPDに至る可能性がある[20]。
Buschke-Ollendorff症候群、メンケス病、弾性線維性仮性黄色腫、マルファン症候群は、銅代謝やリジルオキシダーゼの欠陥、もしくはミクロフィブリルの欠陥(フィブリリンやファイブリンの欠陥)と関連している[21]。
ハーラー症候群はライソゾーム病の1つであり、弾性線維形成の欠陥と関連している[22]。
弾性線維症[編集]
弾性線維症(エラストーシス、elastosis)は組織に弾性線維が蓄積する疾患であり、変性疾患の一種である[23]。その原因は多くあるが、最も一般的なものは皮膚の日光弾性線維症(光線性弾性線維症)であり、太陽光へ長期間過剰に曝露することで光老化と呼ばれる過程によって引き起こされる。その他、蛇行性穿孔性弾性線維症、perforating calcific elastosis、linear focal elastosisなどがある[23]。
| 疾患 | 特徴 | 組織病理 |
|---|---|---|
| 日光弾性線維症(光線性弾性線維症) | 真皮の乳頭層と網状層のコラーゲン線維がエラスチンに置き換わる | 
|
| 蛇行性穿孔性弾性線維症 | 変性した弾性線維が経表皮的に排出される[24] | 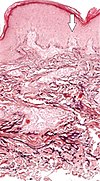
|
| Perforating calcific elastosis | 真皮内で短い弾性線維が凝集する[24] | 
|
| Linear focal elastosis | 真皮乳頭層に断片化した弾性線維性物質(elastotic material)が蓄積し、弾性線維が経皮的に排出される[24] | 
|
出典[編集]
- ^ a b c d “Elastin architecture”. Matrix Biology 84: 4–16. (November 2019). doi:10.1016/j.matbio.2019.07.005. PMID 31301399.
- ^ “Elastin”. Advances in Protein Chemistry (Elsevier) 70: 437–61. (2005). doi:10.1016/s0065-3233(05)70013-9. ISBN 978-0-12-034270-9. PMID 15837523.
- ^ a b “Elastin in pulmonary pathology: relevance in tumours with a lepidic or papillary appearance. A comprehensive understanding from a morphological viewpoint”. Histopathology 80 (3): 457–467. (August 2021). doi:10.1111/his.14537. PMC 9293161. PMID 34355407.
- ^ “Latent TGF-β-binding proteins”. Matrix Biology 47: 44–53. (September 2015). doi:10.1016/j.matbio.2015.05.005. PMC 4844006. PMID 25960419.
- ^ “Characterization of Microfibrillar-associated Protein 4 (MFAP4) as a Tropoelastin- and Fibrillin-binding Protein Involved in Elastic Fiber Formation”. The Journal of Biological Chemistry 291 (3): 1103–14. (January 2016). doi:10.1074/jbc.M115.681775. PMC 4714194. PMID 26601954.
- ^ “Dual functions for LTBP in lung development: LTBP-4 independently modulates elastogenesis and TGF-beta activity”. Journal of Cellular Physiology 219 (1): 14–22. (April 2009). doi:10.1002/jcp.21643. PMC 2719250. PMID 19016471.
- ^ “Fibulin-5/DANCE is essential for elastogenesis in vivo”. Nature 415 (6868): 171–5. (January 2002). doi:10.1038/415171a. PMID 11805835.
- ^ “Coacervation of tropoelastin”. Advances in Colloid and Interface Science 167 (1–2): 94–103. (September 2011). doi:10.1016/j.cis.2010.10.003. PMID 21081222.
- ^ “Glycosaminoglycans mediate the coacervation of human tropoelastin through dominant charge interactions involving lysine side chains”. The Journal of Biological Chemistry 274 (31): 21719–24. (July 1999). doi:10.1074/jbc.274.31.21719. PMID 10419484.
- ^ “Glycosaminoglycan-mediated coacervation of tropoelastin abolishes the critical concentration, accelerates coacervate formation, and facilitates spherule fusion: implications for tropoelastin microassembly”. Biomacromolecules 9 (7): 1739–44. (July 2008). doi:10.1021/bm7013153. PMID 18547105.
- ^ “Lysyl oxidase: an oxidative enzyme and effector of cell function”. Cellular and Molecular Life Sciences 63 (19–20): 2304–16. (October 2006). doi:10.1007/s00018-006-6149-9. PMID 16909208.
- ^ “Elastin is heterogeneously cross-linked”. The Journal of Biological Chemistry 293 (39): 15107–15119. (September 2018). doi:10.1074/jbc.RA118.004322. PMC 6166741. PMID 30108173.
- ^ “Elastic fiber homeostasis requires lysyl oxidase-like 1 protein”. Nature Genetics 36 (2): 178–82. (February 2004). doi:10.1038/ng1297. PMID 14745449.
- ^ “Heparan sulphate interacts with tropoelastin, with some tropoelastin peptides and is present in human dermis elastic fibers”. Matrix Biology 24 (1): 15–25. (February 2005). doi:10.1016/j.matbio.2004.12.001. PMID 15748998.
- ^ Histologic Diagnosis of Inflammatory Skin Diseases An Algorithmic Method Based on Pattern Analysis: Embryologic, Histologic, and Anatomic Aspects: Elastic Fibers (Third ed.). Ardor Scribendi. (January 2005). pp. 522. ISBN 9781893357259. オリジナルのJune 20, 2018時点におけるアーカイブ。 2016年12月28日閲覧. "Elastic fibers are absent from scarring processes such as scars, keloids, and dermatofibromas"
- ^ “Connective Tissue”. 2008年11月7日時点のオリジナルよりアーカイブ。2024年5月12日閲覧。
- ^ Fischer, J. (1979). “Ultrastructure of elastic fibers as shown by polarization optics after the topo-optical permanganate-bisulfite-toluidine blue (PBT) reaction”. Acta Histochemica 65 (1): 87–98. doi:10.1016/S0065-1281(79)80037-9. ISSN 0065-1281. PMID 93385.
- ^ “Entry - #123700 - CUTIS LAXA, AUTOSOMAL DOMINANT 1; ADCL1 - OMIM”. omim.org. 2024年5月12日閲覧。
- ^ Lowery, M. C.; Morris, C. A.; Ewart, A.; Brothman, L. J.; Zhu, X. L.; Leonard, C. O.; Carey, J. C.; Keating, M. et al. (1995-07). “Strong correlation of elastin deletions, detected by FISH, with Williams syndrome: evaluation of 235 patients”. American Journal of Human Genetics 57 (1): 49–53. ISSN 0002-9297. PMC 1801249. PMID 7611295.
- ^ “α1-アンチトリプシン欠乏症 診療の手引き2016 - 学会誌・出版物|一般社団法人日本呼吸器学会”. 一般社団法人日本呼吸器学会. 2024年5月12日閲覧。
- ^ Uitto, J.; Ryhänen, L.; Abraham, P. A.; Perejda, A. J. (1982-07). “Elastin in diseases”. The Journal of Investigative Dermatology 79 Suppl 1: 160s–168s. doi:10.1111/1523-1747.ep12546063. ISSN 0022-202X. PMID 7086187.
- ^ Hinek, A.; Wilson, S. E. (2000-03). “Impaired elastogenesis in Hurler disease: dermatan sulfate accumulation linked to deficiency in elastin-binding protein and elastic fiber assembly”. The American Journal of Pathology 156 (3): 925–938. doi:10.1016/S0002-9440(10)64961-9. ISSN 0002-9440. PMC 1876830. PMID 10702409.
- ^ a b “Elastosis”. DermNet NZ. 2024年5月12日閲覧。
- ^ a b c “Histopathology of pseudoxanthoma elasticum and related disorders: histological hallmarks and diagnostic clues”. Scientifica 2012: 598262. (2012). doi:10.6064/2012/598262. PMC 3820553. PMID 24278718.
-Creative Commons Attribution 3.0 Unported license
関連項目[編集]
外部リンク[編集]
- Histology image: 00801ooa — ボストン大学の組織学学習システム - "Connective Tissue elastic fibers "
- Anatomy photo: TermsCells&Tissues/connective/elastic/elastic2 - Comparative Organology at University of California, Davis - "Connective tissue, elastic (LM, High)"
