呼吸興奮薬
呼吸興奮薬(英:Analeptic)または呼吸促進薬とは、中枢神経に直接的に、または末梢の受容体を介して間接的に作用して呼吸を促進させる薬剤の総称である。中枢神経を刺激する薬剤には、うつ病、注意欠陥多動性障害(ADHD)、呼吸抑制の治療に用いられる様々な薬剤が含まれる。中枢性の呼吸興奮薬は痙攣薬としても使われることがあり、低用量では意識の高揚、落ち着きのなさ、頻呼吸などが見られる[1]。これらの薬剤の主な医療用途は、麻酔薬からの回復手段または緊急時の呼吸抑制の治療である[2]。 このカテゴリーの他の薬剤には、プレトカミド、ペンチレンテトラゾール、ニケタミドが挙げられる。ニケタミドは痙攣の危険性があるため、現在は販売されていない。最近、バルビツール酸系薬物の過剰摂取の治療法としての呼吸興奮薬の使用法が理解されて来ている。この薬剤を使用することで、研究者たちは昏睡状態と呼吸抑制を治療することができた[3]。
医療用途
[編集]呼吸興奮薬は歴史上、主に2つの目的で使用されてきた。一つは、患者の麻酔からの回復をより効率的にすること、もう一つの目的は、特に乳幼児の呼吸困難や無呼吸の管理である。
麻酔の回復
[編集]
呼吸興奮薬は、プロポフォール、レミフェンタニル、セボフルランからの回復速度を速めるために使用できる。臨床現場では、ドキサプラムのような呼吸興奮薬が、患者の麻酔からの回復を助け、強力な麻酔薬の潜在的な悪影響を取り除くために使用されている。
呼吸困難の管理
[編集]カフェインの呼吸興奮薬としての代表的な臨床用途を3つ挙げるとすれば、喘息、未熟児無呼吸発作未熟児無呼吸発作、新生児の気管支肺異形成症の治療であろう[4]。カフェインには弱い気管支拡張作用があり、それで喘息の呼吸苦が緩和されることが説明できる。カフェインが脳性麻痺や認知遅滞の発生率を下げるという予備的な研究があるが、更なる追加研究が必要である[5]。未熟児無呼吸発作は、公式には、通常 徐脈と低酸素症を伴う15〜20秒以上の呼吸停止とされている[6]。この呼吸停止は、未熟児では呼吸制御部位である延髄が未発達であることが原因である。
気管支肺異形成症は、月経後年齢36週以降に酸素吸入が必要となる慢性的な肺疾患で、カフェインがその発生を有意に減少させることが示唆されている[6]。気管支肺異形成症は、低出生体重児(2500g未満)および超低出生体重児(1500g未満)の内、呼吸窮迫症候群の管理のために機械式人工呼吸器の装着を受けた乳児に多く見られる。現在、気管支肺異形成症の治療法はない。一般的に、治療のリスクが機械式人工呼吸器の使用の必要性を上回ると考えられているからである。カフェインは発生を抑えるのみに過ぎない。
テオフィリンは、新生児の呼吸器興奮薬としては使用されなくなった。テオフィリンは非常に狭い治療指数を持つため、毒性を避けるために血清テオフィリン濃度を直接測定して投与量を管理する必要がある。
作用機序
[編集]呼吸興奮薬は様々な化学経路で作用する多様な薬剤群であるが、呼吸を刺激するために呼吸興奮薬が作用するメカニズムは主に4つある。その4つとは、カリウムチャネル遮断薬、アンパキン、セロトニン受容体作動薬、アデノシン受容体拮抗薬である。
カリウムチャネル遮断薬
[編集]カリウムチャネル遮断薬で代表的なものはドキサプラムとGAL-021である。これらは頚動脈小体のカリウムチャネルに作用する。頚動脈小体の細胞は、酸素濃度の低下を感知してその情報を中枢神経系に伝達し、最終的に呼吸を増加させる役割を担っている。この細胞膜上のカリウムチャネルを遮断すると、膜電位が効果的に脱分極され、電位依存性カルシウムチャネルが開き、神経伝達物質が放出される。これにより、中枢神経系に信号を伝達するプロセスが開始される。ドキサプラムは、タンデムポア型カリウムチャネルファミリーのリーク型カリウムチャネルを阻害し、GAL-021は、膜電位の変化や内部カルシウムの増加によって活性化されるBKチャネル(大コンダクタンスカルシウム活性化カリウムチャネル)を阻害する[7]。
アンパキン
[編集]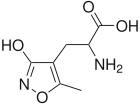
アンパキン(AMPAkine)は、上記とは異なるメカニズムで呼吸促進作用を引き起こす。アンパキンはAMPA受容体(アミノ-3-ヒドロキシ-5-メチル-D-アスパラギン酸受容体)に結合し、プレベツィンガー複合体を形成する。プレベツィンガー複合体は腹側呼吸器群の一部であり、これらの神経細胞のシナプス後膜に長期電位が誘導されることで、呼吸数が増加する。内因性のAMPA受容体のリガンドはグルタミン酸であり、アンパキンはグルタミン酸と受容体との相互作用を反映する。リガンドが結合するとAMPA受容体が開き、ナトリウムイオンが細胞内に流入し、脱分極とシグナル伝達が起こる。現時点では、CX717はヒトでの臨床試験において最も成功したアンパキンであり、副作用もほとんどない[7]。
セロトニン受容体作動薬
[編集]3つ目のメカニズムは、セロトニン受容体のアゴニストとして作用するものである。ブスピロンとモサプリドは、セロトニン受容体(Gタンパク質共役型受容体)に結合することで、動物の呼吸量を増加させることに成功した。セロトニン受容体は、活性化されると二次的なメッセンジャーカスケードを誘発し、この場合、そのカスケードが呼吸促進作用をもたらす[7]。
アデノシン受容体拮抗薬
[編集]呼吸に関しては、カフェインは競合的アデノシン受容体拮抗薬として作用する。研究者は、アデノシンまたはその誘導体を投与するとカフェインとは逆の作用を示すことを発見したことで、この作用を見出した。アデノシン濃度の上昇は、神経細胞の自発的な電気活動の抑制、神経伝達の阻害、神経伝達物質の放出の減少を引き起こすことが知られている。アデノシンは、呼吸器系ニューロンの電気的活動を阻害することにより、呼吸器系の駆動を抑制する[8]。カフェインは、アデノシン受容体拮抗薬として、この呼吸神経細胞を刺激し、分時換気量の増加を引き起こす。
その他
[編集]ジモルホラミンは延髄および橋の外側網様体に存在する呼吸中枢を興奮させる作用を持つ[9][10][11][12]。
ドキサプラム
[編集]ドキサプラムは、静脈内投与の中枢神経系・呼吸器系刺激薬で、通常、麻酔や慢性閉塞性肺疾患による呼吸抑制の治療に用いられる。ドキサプラムは新生児無呼吸症候群の治療薬としても使用されるが、危険性があるため注意を必要とする。ドキサプラムは、薬物の過剰摂取による呼吸抑制の治療にも使用されているが、これが有効でない薬剤も多く存在する。ドキサプラムの副作用は稀であるが、過量投与により、高血圧、頻脈、振戦、痙攣、反射亢進等が認められている[13]。
メチルキサンチン
[編集]
天然化合物であるカフェインやテオフィリンは、構造的にはメチル化キサンチンに分類される。キサンチン系薬剤を使用した場合、一般的な副作用として、ほろ酔い、過激な行動、不眠等が見られる。また頻度は低いものの、利尿、胃腸障害、まれに耳鳴り等の副作用がある。大量に摂取すると精神的依存を引き起こすこともある[13]。
歴史
[編集]20世紀初頭にバルビツール酸系医薬品が導入された後、バルビツール酸過剰摂取という新たな生命の問題を研究するために、呼吸興奮薬が使用された。1930年代以前には、バルビツール酸過剰摂取の治療に、樟脳[要出典]やカフェインなどの天然の興奮剤が利用されていた。1930年から1960年にかけて、バルビツール酸過剰症の治療には、天然由来の化合物に代わって、ニケタミド、ペンチレンテトラゾール、ベメグリド、アンフェタミン、メチルフェニデートなどの合成呼吸興奮薬が使用された。最近では、バルビツール酸過剰摂取をより効率的に治療する方法が開発されたため、ADHDの治療にも呼吸興奮薬が使われるようになった[14]。
最初に広く使われた呼吸興奮薬の一つがストリキニーネで、抑制性の神経伝達物質であるグリシンに拮抗して中枢神経系を興奮させる[1]。ストリキニーネは、ピクロトキシンやビククリンと並んで痙攣薬に分類されるが、これらの痙攣薬はグリシンの代わりにGABA受容体を阻害する。ストリキニーネは20世紀初頭まで使用されていたが、毒性の強い痙攣薬であることが判明した。ストリキニーネは現在、殺鼠剤として利用されているほか、ヘロインなどの薬物に混入されている[1]。他の2つの痙攣薬はGABA受容体に拮抗するが、どちらも現在は一般には入手できない[1]。
ドキサプラムは有効な中枢神経系・呼吸器系の刺激薬であるにもかかわらず、ヒトではあまり使われなくなりはじめている。使用が減少した主な理由は、より持続時間の短い麻酔薬が豊富になったためであるが、一部の研究で乳児への潜在的な副作用が示されたためでもある[2][15]。早産児を対象としたいくつかの研究では、ドキサプラムが脳血流を低下させ、脳の酸素要求量を増加させることが判明した。その結果、これらの乳児は、薬を投与されていない乳児に比べて精神的な遅れが生じる可能性が上昇した[2]。このように、ドキサプラムには潜在的な危険性があるため、ヒトに対する多くの治療法から除外されている。
参考資料
[編集]- ^ a b c d Young, Simon; Campbell, Ryan (January 2015). “Central nervous system stimulants: basic pharmacology and relevance to anaesthesia and critical care”. Anaesthesia & Intensive Care Medicine 16 (1): 21–25. doi:10.1016/j.mpaic.2014.10.005.
- ^ a b c Heggem, Brittany (July 2011). “Doxapram”. Journal of Exotic Pet Medicine 20 (3): 237–240. doi:10.1053/j.jepm.2011.04.011.
- ^ Kim, Y. J.; Lee, H; Kim, C. H.; Lee, G. Y.; Baik, H. J.; Han, J. I. (2012). “Effect of flumazenil on recovery from anesthesia and the bispectral index after sevoflurane/fentanyl general anesthesia in unpremedicated patients”. Korean Journal of Anesthesiology 62 (1): 19–23. doi:10.4097/kjae.2012.62.1.19. PMC 3272523. PMID 22323949.
- ^ Nehlig, Astrid (June 2, 1992). “Caffeine and the central nervous system:mechanisms of action, biochemical, metabolic and psychostimulant effects”. Brain Research Reviews 17 (2): 139–170. doi:10.1016/0165-0173(92)90012-b. PMID 1356551.
- ^ Schmidt, Barbara (November 8, 2007). “Long-Term Effects of Caffeine Therapy for Apnea of Prematurity”. New England Journal of Medicine 357 (19): 1893–1902. doi:10.1056/nejmoa073679. PMID 17989382.
- ^ a b Schmidt, Barbara (May 18, 2006). “Caffeine Therapy for Apnea of Prematurity”. New England Journal of Medicine 354 (20): 2112–2121. doi:10.1056/nejmoa054065. PMID 16707748.
- ^ a b c Van Der Schier, Rutger; Roosekrans, Margo; Van Velzen, Monique; Dahan, Albert; Niester, Marieke (2014). “Opioid-induced respiratory depression reversal by non-opioid drugs”. F1000Prime Reports 6 (79): 79. doi:10.12703/P6-79. PMC 4173639. PMID 25343036.
- ^ Nehlig, Astrid (June 2, 1992). “Caffeine and the central nervous system: mechanisms of action, biochemical, metabolic and psychostimulant effects”. Brain Research Reviews 17 (2): 139–170. doi:10.1016/0165-0173(92)90012-b. PMID 1356551.
- ^ 臼井亮平ら (1957). 麻酔 6: 121.
- ^ 横山哲朗 (1957). 呼吸と循環 5: 717.
- ^ 福嶋文雄 (1956). 福岡医学誌 47: 2014.
- ^ Asakawa, S. (1965). Med. J. Shinshu. Univ. 10: 29.
- ^ a b Kee, Joyce L.; Hayes, Evelyn; McCuistion, Linda E. (2012). Pharmacology : a nursing process approach (7th ed.). St. Louis, MO.: Elsevier Saunders. pp. 289–291. ISBN 978-1437717112
- ^ Wax, P. M. (1997). “Analeptic use in clinical toxicology: A historical appraisal”. Journal of Toxicology. Clinical Toxicology 35 (2): 203–9. doi:10.3109/15563659709001195. PMID 9120893.
- ^ McLeod, James; Hewitt, Matthew; Golder, Francis (1 November 2013). “Respiratory stimulant drugs in the post-operative setting”. Respiratory Physiology & Neurobiology 189 (2): 395–402. doi:10.1016/j.resp.2013.06.010. PMID 23791825.
