AB5型毒素
| Enterotoxin (OB-fold B subunit) | |
|---|---|
| 識別子 | |
| 略号 | Enterotoxin |
| InterPro | IPR008992 |
| SCOP | 2bos |
| SUPERFAMILY | 2bos |
AB5型毒素(AB5がたどくそ)またはAB5型トキシン(英: AB5 toxin)は、コレラ、赤痢、溶血性尿毒症症候群などの原因となる特定種の病原性細菌によって分泌されるタンパク質複合体であり、6つの構成要素からなる。構成要素の1つはAサブユニット、残りの5つの構成要素はBサブユニットである。これらの毒素は全て共通した構造と標的宿主細胞への進入機構を有する。Bサブユニットは宿主細胞の受容体への結合を担い、Aサブユニットが細胞内へ進入するための経路を開く。その後、Aサブユニットは自身の触媒装置を用いて宿主細胞の正常な機能を乗っ取る[1][2]。
ファミリー
[編集]


AB5型毒素には4つの主要なファミリーが存在する。これらのファミリーはAサブユニット(触媒サブユニットの)配列と触媒活性によって特徴づけられている[4]。
コレラ毒素
[編集]このファミリーはCtまたはCtxとしても知られており、LTと呼ばれる易熱性エンテロトキシンも含まれる[5]。コレラ毒素の発見は多くがSambhu Nath Deによるところのものである。彼はカルカッタ(現在のコルカタ)で研究を行い、1959年にコレラ毒素を発見したが、最初の精製は1883年にロベルト・コッホによって行われた。コレラ毒素はコレラ菌Vibrio choleraeによって分泌されるタンパク質複合体から構成される[6]。この毒素の症状としては水様便や脱水症状が慢性的に広くみられ、場合によっては死に至ることもある。
百日咳毒素
[編集]このファミリーはPtxとしても知られ、百日咳を引き起こす毒素が含まれる。百日咳毒素はグラム陰性菌である百日咳菌Bordetella pertussisによって分泌される。百日咳は非常に感染性が高く、アメリカ合衆国では予防接種が行われているにもかかわらず徐々に拡大している[7]。症状としてはwhoopingと呼ばれる発作性の咳があり、嘔吐する場合もある[8]。百日咳菌は1900年にフランスでジュール・ボルデとオクターブ・ジャングによって百日咳の原因として同定され、単離された[9]。この毒素の機構はコレラ毒素と共通している[10]。
サルモネラSalmonella entericaのArtAB毒素は2つの異なるファミリーの毒素と類似した構成要素からなる。ArtAサブユニット(Q404H4)は百日咳毒素Aサブユニットと相同であり、ArtBサブユニット(Q404H3)は、他のサルモネラ株と同様スブチラーゼ毒素Bサブユニット(subB)と相同である。Aサブユニットによって分類するという規則のため、この毒素はPtxファミリーに属する[4][11]。
志賀毒素
[編集]志賀毒素はStxとしても知られ、桿菌である志賀赤痢菌Shigella dysenteriaeと大腸菌Escherichia coli(STEC)によって産生される毒素である。これらの細菌に汚染された食品や飲料水は感染源となり、この毒素の拡散源となる[12]。症状としては腹痛と水様便、場合によっては血便がみられる。生命を脅かす重症例は出血性大腸炎を特徴とする[13]。この毒素は1898年に志賀潔によって発見された。
スブチラーゼ毒素
[編集]このファミリーはSubABとしても知られており[4]、1990年代に発見された[14]。LEE遺伝子領域を持たないSTEC株で産生され[15]、溶血性尿毒症症候群を引き起こすことが知られている。スブチラーゼ毒素と呼ばれるのは、Aサブユニットの配列が炭疽菌Bacillus anthracisのスブチラーゼ様セリンプロテアーゼの配列と類似しているためである。この毒素によって引き起こされる症状には、血小板減少症(血液中の血小板数の減少)、白血球増加症(白血球数の増加)、腎細胞の損傷がある[16]。
スブチラーゼ毒素Aサブユニット(subA、Q6EZC2)はBiP(binding immunoglobulin protein)を切断することが知られているプロテアーゼであり、小胞体ストレスと細胞死をもたらす。Bサブユニット(subB、Q6EZC3)は細胞表面のN-グリコリルノイラミン酸(Neu5Gc)糖鎖に高い親和性で結合する[17]。ベロ細胞の空胞化を引き起こすにはsubBだけで十分である[18]。Neu5Gcはヒトでは産生されないが、赤肉や乳製品などの食品から獲得され、高い頻度でヒトの消化管壁に対するSTECの感染源となる[19]。
構造
[編集]完全なAB5型毒素複合体には6つのタンパク質ユニットが含まれる。5つのユニットは構造的に類似しているか同一のものであり、Bサブユニットと呼ばれる。残りの1つは独特なものであり、Aサブユニットと呼ばれる。


Aサブユニット
[編集]AB5型毒素のAサブユニットは特異的な標的に対する触媒を担う部分である。志賀毒素ファミリーでは、Aサブユニットにはトリプシン感受性領域が存在し、切断されて2つの断片化されたドメインとなる。こうした領域は他のAB5型毒素ファミリーでは未だ確認されていない[2]。一般的に、Aサブユニットの2つのドメインはA1、A2と呼ばれ、ジスルフィド結合によって連結されている。ドメインA1(コレラ毒素や易熱性エンテロトキシンでは約22 kDa)は毒素の毒性を担う部分である。ドメインA2(コレラ毒素や易熱性エンテロトキシンでは約5 kDa)はBサブユニット中心部のポアとの非共有結合的な連結を担う[10]。コレラ毒素のA1鎖は、ADPリボシル化因子を利用してニコチンアミドアデニンジヌクレオチド(NAD)からアルギニンや他のグアニジン化合物へのADPリボースの転移を触媒する。アルギニンや単純なグアニジン化合物が存在しない場合には、水分子を求核剤として毒素によるNAD+ヌクレオシダーゼ活性が進行する[20]。
Bサブユニット
[編集]Bサブユニットは五量体からなるリング構造を形成し、Aサブユニットの一端を保持する。また、Bサブユニットリングは受容体、多くの場合宿主細胞表面に存在する糖タンパク質または糖脂質に対する結合能を有する[10][21]。BサブユニットがなければAサブユニットは細胞に接着したり進入する手段を持たず、そのため毒性を発揮することができない。コレラ毒素、志賀毒素、SubAB毒素はすべて、5つの同一なタンパク質構成要素から構成されるBサブユニットを持ち、すなわちこれらのBサブユニットはホモ五量体である。百日咳毒素はこれらとは異なり、五量体リングは4つの異なるタンパク質構成要素からなる。構成要素の1つは2コピー存在し、ヘテロ五量体が形成される[10]。
機構
[編集]コレラ毒素、百日咳毒素、志賀毒素の標的はすべて細胞内の細胞質基質に位置する。Bサブユニットが細胞表面の受容体に結合した後、毒素は細胞によって内包され、クラスリン依存的または非依存的なエンドサイトーシスによって細胞内へ輸送される[22]。
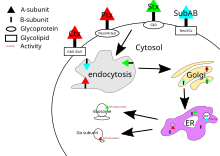
コレラ毒素の主な糖脂質受容体はガングリオシドGM1である[21]。ゴルジ体へのエンドサイトーシス後、毒素は小胞体へ送られる[10]。Aサブユニットが標的に到達するためには、ドメインA1とA2の間のジスルフィド結合が壊されなければならない。この切断は小胞体のプロテインジスルフィドイソメラーゼ(PDI)によって触媒される[23]。分離後、A1ドメインのフォールディングはほどかれ、細胞質へ送られた後に再びフォールディングを行う[10]。そして特定のGタンパク質のαサブユニットのADPリボシル化を触媒する。その結果、アデニル酸シクラーゼの活性化によってGタンパク質シグナル伝達経路の下流の作用が破壊される[4][21]。これによって細胞内のcAMPの濃度が高くなり、イオン輸送機構の調節が破綻する[10]。
百日咳毒素には特異的な受容体は存在しないが、シアル化された糖タンパク質に結合する[14]。エンドサイトーシス後の機構はコレラ毒素と同様である。
志賀毒素の主要な受容体はグロボトリアオシルセラミド(Gb3)である[24]。志賀毒素もゴルジ体へ送られた後に小胞体へ送られ、PDIによってジスルフィド結合が切断される。その後志賀毒素は細胞質基質に送られ、rRNA-N-グリコシラーゼ活性によって28S rRNAの特定のアデニン塩基を切断することでタンパク質合成を阻害し[4][10]、最終的には細胞死を引き起こす。
SubABの標的は小胞体に位置し、SubABはクラスリン依存的エンドサイトーシスによって細胞内へもたらされる[21]。通常、SubABの受容体は末端がα2,3結合型Neu5Gcの糖鎖である[14]。SubABのAサブユニットはセリンプロテアーゼとして作用し、小胞体に位置するシャペロンであるBiP/GRP78を切断する[4]。このシャペロンの切断によってタンパク質合成が阻害され、細胞ストレス[15]、そして細胞死が引き起こされる[10]。
医学における利用
[編集]がん治療
[編集]AB5型毒素のBサブユニットは一部のタイプの腫瘍が持つ糖鎖に対する結合親和性を有するようであり、がん細胞への標的化は容易なものとなっている。志賀毒素Bサブユニット(StxB)は、結腸がん、膵臓がん、乳がんなどのがん細胞表面に発現しているCD77(Gb3)に特異的に結合する。StxBががん細胞を標的とすると、毒素のAサブユニットが輸送され、最終的にがん細胞を死滅させる[10]。
また、小胞体ストレスを誘導する薬剤との併用によって相乗的応答を示すことがマウスで示されている。この実験は上皮成長因子(EGF)と融合させたSubABのAサブユニットを用いて行われ、EGFに対する受容体を発現しているがん細胞はSubABの毒性に見よって薬剤に対する感受性が増大した[25]。
ワクチン
[編集]AB5型毒素の他の利用法としては、LTファミリーのメンバーのアジュバントとしての利用が挙げられる。毒素はIgG2a、IgA、Th17などの免疫応答を促進し、例えばワクチンが投与された際にピロリ菌Helicobacter pyloriの感染を防ぐことが示されている[26][27]。
このように一部のAB5型毒素が細菌感染を防ぐワクチンに利用されるのに加えて、ウイルス感染を防ぐimmunoconjugateとしての利用の研究も行われている。例えば、ウイルス-コレラ毒素結合型ワクチンによる全身免疫によってセンダイウイルスに対して特異的な抗体応答が誘導され、さらに経鼻投与を行うことで上気道もある程度保護される[28]。
近年の研究領域
[編集]ベッセルビームを用いた平面照明顕微鏡(Bessel beam plane illumination microscopy)とFRETベースのセンサー分子の利用などの実験技術の進展により、ギャップ結合プラークの動的構造に関する理解が進んでいる。こうした実験では、細胞にコネキシン欠乏領域(connexin-depleted region、CDR)の迅速な形成を誘導するため、さまざまなタイプのAB5型毒素が利用されている。CDR形成応答はギャップ結合細胞におけるcAMP濃度の変動をFRETベースのセンサー分子を用いて検出することで記録することができる。CDRはギャップ結合プラーク内のコネキシンチャネルのタンパク質と脂質の迅速な再構成と関係していることが研究からは示唆されている。こうした研究は、細菌感染の際の細胞からのK+の喪失に続くシグナル伝達カスケードの理解に有用である[29][30]。
SubAB毒素はBiPに対する特異性を示すことが明らかにされている。この性質は細胞内でのBiP自身の機能や、ストレスを受けたHeLa細胞での小胞体関連分解(ERAD)の役割の研究に利用されている[10]。
出典
[編集]- ^ Le Nours, J.; Paton, A. W.; Byres, E.; Troy, S.; Herdman, B. P.; Johnson, M. D.; Paton, J. C.; Rossjohn, J. et al. (6 August 2013). “Structural Basis of Subtilase Cytotoxin SubAB Assembly”. Journal of Biological Chemistry 288 (38): 27505–27516. doi:10.1074/jbc.M113.462622. PMC 3779744. PMID 23921389.
- ^ a b Middlebrook, JL; Dorland, RB (Sep 1984). “Bacterial toxins: cellular mechanisms of action.”. Microbiological Reviews 48 (3): 199–221. PMC 373009. PMID 6436655.
- ^ Locht, C; Antoine, R (1995). “A proposed mechanism of ADP-ribosylation catalyzed by the pertussis toxin S1 subunit.”. Biochimie 77 (5): 333–40. doi:10.1016/0300-9084(96)88143-0. PMID 8527486.
- ^ a b c d e f Wang, H; Paton, JC; Herdman, BP; Rogers, TJ; Beddoe, T; Paton, AW (Mar 2013). “The B subunit of an AB5 toxin produced by Salmonella enterica serovar Typhi up-regulates chemokines, cytokines, and adhesion molecules in human macrophage, colonic epithelial, and brain microvascular endothelial cell lines.”. Infection and Immunity 81 (3): 673–83. doi:10.1128/IAI.01043-12. PMC 3584882. PMID 23250951.
- ^ Beddoe, Travis; Paton, Adrienne W.; Le Nours, Jérôme; Rossjohn, Jamie; Paton, James C. (July 2010). “Structure, biological functions and applications of the AB5 toxins”. Trends in Biochemical Sciences 35 (7): 411–418. doi:10.1016/j.tibs.2010.02.003. PMC 2929601. PMID 20202851.
- ^ Bharati, K; Ganguly, N. K. (2011). “Cholera toxin: A paradigm of a multifunctional protein”. The Indian Journal of Medical Research 133 (2): 179–187. PMC 3089049. PMID 21415492.
- ^ Millen, S. H.; Schneider, O. D.; Miller, W. E.; Monaco, J. J.; Weiss, A. A. (2013). “Pertussis Toxin B-Pentamer Mediates Intercellular Transfer of Membrane Proteins and Lipids”. PLoS ONE 8 (9): e72885. Bibcode: 2013PLoSO...872885M. doi:10.1371/journal.pone.0072885. PMC 3760862. PMID 24019885.
- ^ Carbonetti, N. H. (2010). “Pertussis toxin and adenylate cyclase toxin: Key virulence factors of Bordetella pertussis and cell biology tools”. Future Microbiology 5 (3): 455–469. doi:10.2217/fmb.09.133. PMC 2851156. PMID 20210554.
- ^ Guiso, Nicole (2009-11-15). “Bordetella pertussis and pertussis vaccines”. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America 49 (10): 1565–1569. doi:10.1086/644733. ISSN 1537-6591. PMID 19839747.
- ^ a b c d e f g h i j k Beddoe, Travis; Paton, Adrienne W.; Le Nours, Jérôme; Rossjohn, Jamie; Paton, James C. (July 2010). “Structure, biological functions and applications of the AB5 toxins”. Trends in Biochemical Sciences 35 (7): 411–418. doi:10.1016/j.tibs.2010.02.003. PMC 2929601. PMID 20202851.
- ^ “1.C.72 The Pertussis Toxin (PTX) Family”. TCDB. 21 March 2019閲覧。
- ^ Faruque, S. M.; Chowdhury, N; Khan, R; Hasan, M. R.; Nahar, J; Islam, M. J.; Yamasaki, S; Ghosh, A. N. et al. (2003). “Shigella dysenteriae Type 1-Specific Bacteriophage from Environmental Waters in Bangladesh”. Applied and Environmental Microbiology 69 (12): 7028–7031. doi:10.1128/AEM.69.12.7028-7031.2003. PMC 310026. PMID 14660345.
- ^ Beutin, L; Miko, A; Krause, G; Pries, K; Haby, S; Steege, K; Albrecht, N (2007). “Identification of human-pathogenic strains of Shiga toxin-producing Escherichia coli from food by a combination of serotyping and molecular typing of Shiga toxin genes”. Applied and Environmental Microbiology 73 (15): 4769–75. doi:10.1128/AEM.00873-07. PMC 1951031. PMID 17557838.
- ^ a b c Paton, AW; Paton, JC (Feb 1, 2010). “Escherichia coli Subtilase Cytotoxin.”. Toxins 2 (2): 215–228. doi:10.3390/toxins2020215. PMC 2943149. PMID 20871837.
- ^ a b Michelacci, V.; Tozzoli, R.; Caprioli, A.; Martínez, R.; Scheutz, F.; Grande, L.; Sánchez, S.; Morabito, S. et al. (2013). “A new pathogenicity island carrying an allelic variant of the Subtilase cytotoxin is common among Shiga toxin producing of human and ovine origin”. Clinical Microbiology and Infection 19 (3): E149–E156. doi:10.1111/1469-0691.12122. PMID 23331629.
- ^ Wang, Hui; Paton, James C.; Paton, Adrienne W. (October 2007). “Pathologic Changes in Mice Induced by Subtilase Cytotoxin, a Potent New AB Toxin That Targets the Endoplasmic Reticulum”. The Journal of Infectious Diseases 196 (7): 1093–1101. doi:10.1086/521364. PMID 17763334.
- ^ Paton, AW; Paton, JC (1 February 2010). “Escherichia coli Subtilase Cytotoxin.”. Toxins 2 (2): 215–228. doi:10.3390/toxins2020215. PMC 2943149. PMID 20871837.
- ^ Morinaga, N; Yahiro, K; Matsuura, G; Watanabe, M; Nomura, F; Moss, J; Noda, M (January 2007). “Two distinct cytotoxic activities of subtilase cytotoxin produced by shiga-toxigenic Escherichia coli.”. Infection and Immunity 75 (1): 488–96. doi:10.1128/IAI.01336-06. PMC 1828409. PMID 17101670.
- ^ Byres, E; Paton, AW; Paton, JC; Löfling, JC; Smith, DF; Wilce, MC; Talbot, UM; Chong, DC et al. (4 December 2008). “Incorporation of a non-human glycan mediates human susceptibility to a bacterial toxin.”. Nature 456 (7222): 648–52. Bibcode: 2008Natur.456..648B. doi:10.1038/nature07428. PMC 2723748. PMID 18971931.
- ^ Gutkind, edited by Toren Finkel, J. Silvio (2003). Signal Transduction and Human Disease.. Hoboken, NJ: John Wiley & Sons. ISBN 0471448370
- ^ a b c d “Raft trafficking of AB5 subunit bacterial toxins”. Biochim Biophys Acta 1746 (3): 314–21. (2005). doi:10.1016/j.bbamcr.2005.07.007. PMID 16153723.
- ^ Smith, Richard D.; Willett, Rose; Kudlyk, Tetyana; Pokrovskaya, Irina; Paton, Adrienne W.; Paton, James C.; Lupashin, Vladimir V. (October 2009). “The COG Complex, Rab6 and COPI Define a Novel Golgi Retrograde Trafficking Pathway that is Exploited by SubAB Toxin”. Traffic 10 (10): 1502–1517. doi:10.1111/j.1600-0854.2009.00965.x. PMC 2756830. PMID 19678899.
- ^ Teter, Ken (10 December 2013). “Toxin Instability and Its Role in Toxin Translocation from the Endoplasmic Reticulum to the Cytosol”. Biomolecules 3 (4): 997–1029. doi:10.3390/biom3040997. PMC 4030972. PMID 24970201. (PDI)
- ^ Thorpe, C. M. (1 May 2004). “Shiga Toxin--Producing Escherichia coli Infection”. Clinical Infectious Diseases 38 (9): 1298–1303. doi:10.1086/383473. PMID 15127344.
- ^ Backer, JM; Krivoshein, AV; Hamby, CV; Pizzonia, J; Gilbert, KS; Ray, YS; Brand, H; Paton, AW et al. (Nov 2009). “Chaperone-targeting cytotoxin and endoplasmic reticulum stress-inducing drug synergize to kill cancer cells”. Neoplasia 11 (11): 1165–73. doi:10.1593/neo.09878. PMC 2767218. PMID 19881952.
- ^ Norton, E. B.; Lawson, L. B.; Mahdi, Z.; Freytag, L. C.; Clements, J. D. (23 April 2012). “The A Subunit of Escherichia coli Heat-Labile Enterotoxin Functions as a Mucosal Adjuvant and Promotes IgG2a, IgA, and Th17 Responses to Vaccine Antigens”. Infection and Immunity 80 (7): 2426–2435. doi:10.1128/IAI.00181-12. PMC 3416479. PMID 22526674.
- ^ Weltzin, R; Guy, B; Thomas WD, Jr; Giannasca, PJ; Monath, TP (May 2000). “Parenteral adjuvant activities of Escherichia coli heat-labile toxin and its B subunit for immunization of mice against gastric Helicobacter pylori infection.”. Infection and Immunity 68 (5): 2775–82. doi:10.1128/iai.68.5.2775-2782.2000. PMC 97487. PMID 10768972.
- ^ Liang, XP; Lamm, ME; Nedrud, JG (Sep 1, 1988). “Oral administration of cholera toxin-Sendai virus conjugate potentiates gut and respiratory immunity against Sendai virus.”. Journal of Immunology 141 (5): 1495–501. PMID 2842395.
- ^ Majoul, IV; Gao, L; Betzig, E; Onichtchouk, D; Butkevich, E; Kozlov, Y; Bukauskas, F; Bennett, MV et al. (Oct 29, 2013). “Fast structural responses of gap junction membrane domains to AB5 toxins.”. Proceedings of the National Academy of Sciences of the United States of America 110 (44): E4125–33. Bibcode: 2013PNAS..110E4125M. doi:10.1073/pnas.1315850110. PMC 3816413. PMID 24133139.
- ^ Börner, S; Schwede, F; Schlipp, A; Berisha, F; Calebiro, D; Lohse, MJ; Nikolaev, VO (Apr 2011). “FRET measurements of intracellular cAMP concentrations and cAMP analog permeability in intact cells.”. Nature Protocols 6 (4): 427–38. doi:10.1038/nprot.2010.198. PMID 21412271.
