BCR (タンパク質)
| Bcr-Abl oncoprotein oligomerisation domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Bcr-Ablがんタンパク質のオリゴマー化ドメインの構造 | |||||||||
| 識別子 | |||||||||
| 略号 | Bcr-Abl_Oligo | ||||||||
| Pfam | PF09036 | ||||||||
| InterPro | IPR015123 | ||||||||
| |||||||||
BCR(breakpoint cluster region protein)は、ヒトではBCR遺伝子によってコードされているタンパク質である。BCR遺伝子は、フィラデルフィア染色体と関係したBCR-ABL融合遺伝子を構成する2つの遺伝子のうちの一方である。BCR遺伝子には、異なるアイソフォームをコードする2種類の転写バリアントが見つかっている。
機能
[編集]BCR-ABL融合タンパク質に関しては多くの研究がなされている一方で、正常なBCR遺伝子産物の機能はいまだ明確ではない。BCRタンパク質はセリン/スレオニンキナーゼ活性を持ち[5]、またRhoAに対するグアニンヌクレオチド交換因子[6]、Racに対するGTPアーゼ活性化タンパク質として機能する[7]。
臨床的意義
[編集]22番染色体と9番染色体との間の相互転座によって形成されるフィラデルフィア染色体は、慢性骨髄性白血病の患者にみられることが多い。この転座における22番染色体上の切断点はBCR遺伝子内に位置している。この転座によって、BCR遺伝子と9番染色体上の切断点に位置するABL遺伝子の双方に由来する配列からBCR-ABL融合タンパク質が産生されるようになる[5]。
構造
[編集]
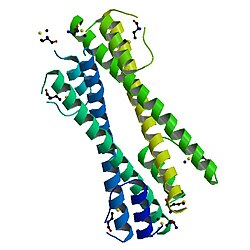
BCR-ABLがんタンパク質のオリゴマー化ドメインはBCRのN末端に位置し、この融合タンパク質の発がん性に必要不可欠である。オリゴマー化ドメインはN末端の短いヘリックス(α1)、柔軟なループ、そしてC末端の長いヘリックス(α2)から構成される。これらはN字型構造を形成し、2つのヘリックスは平行な向きに並ぶ。2つの単量体ドメインは、α2ヘリックスの間での逆平行コイルドコイルの形成、そしてα1ヘリックス間のドメインスワッピングによって一方のα1ヘリックスがもう一方のα2ヘリックスに対してパッキングすることで二量体を形成する。その後、2つの二量体が四量体へと結合する[8]。BCR-ABLがんタンパク質の逆平行コールドコイルドメイン(BCR30-65)を開始構造とした構造ベースの改変によって、pH感受性のホモ二量体逆平行コイルドコイルが作出されている[9]。
相互作用
[編集]BCRは次に挙げる因子と相互作用することが示されている。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000186716 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000009681 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ a b “Entrez Gene: Breakpoint cluster region”. 2022年8月6日閲覧。
- ^ Dubash AD, Koetsier JL, Amargo EV, Najor NA, Harmon RM, Green KJ (August 2013). "The GEF Bcr activates RhoA/MAL signaling to promote keratinocyte differentiation via desmoglein-1". The Journal of Cell Biology. 202 (4): 653–666. doi:10.1083/jcb.201304133. PMC 3747303. PMID 23940119。
- ^ Diekmann, D.; Brill, S.; Garrett, M. D.; Totty, N.; Hsuan, J.; Monfries, C.; Hall, C.; Lim, L. et al. (1991-05-30). “Bcr encodes a GTPase-activating protein for p21rac”. Nature 351 (6325): 400–402. doi:10.1038/351400a0. ISSN 0028-0836. PMID 1903516.
- ^ Zhao X, Ghaffari S, Lodish H, Malashkevich VN, Kim PS (February 2002). "Structure of the Bcr-Abl oncoprotein oligomerization domain". Nature Structural Biology. 9 (2): 117–120. doi:10.1038/nsb747. PMID 11780146. S2CID 17453012。
- ^ Nagarkar, Radhika P.; Fichman, Galit; Schneider, Joel P. (2020-08-14). “Engineering and characterization of a<scp>pH</scp>‐sensitive homodimeric antiparallel coiled coil”. Peptide Science 112 (5). doi:10.1002/pep2.24180. ISSN 2475-8817.
- ^ a b c Puil L, Liu J, Gish G, Mbamalu G, Bowtell D, Pelicci PG, et al. (February 1994). "Bcr-Abl oncoproteins bind directly to activators of the Ras signalling pathway". The EMBO Journal. 13 (4): 764–773. doi:10.1002/j.1460-2075.1994.tb06319.x. PMC 394874. PMID 8112292。
- ^ Ling X, Ma G, Sun T, Liu J, Arlinghaus RB (January 2003). "Bcr and Abl interaction: oncogenic activation of c-Abl by sequestering Bcr". Cancer Research. 63 (2): 298–303. PMID 12543778。
- ^ Pendergast AM, Muller AJ, Havlik MH, Maru Y, Witte ON (July 1991). "BCR sequences essential for transformation by the BCR-ABL oncogene bind to the ABL SH2 regulatory domain in a non-phosphotyrosine-dependent manner". Cell. 66 (1): 161–171. doi:10.1016/0092-8674(91)90148-R. PMID 1712671. S2CID 9933891。
- ^ Hallek M, Danhauser-Riedl S, Herbst R, Warmuth M, Winkler A, Kolb HJ, et al. (July 1996). "Interaction of the receptor tyrosine kinase p145c-kit with the p210bcr/abl kinase in myeloid cells". British Journal of Haematology. 94 (1): 5–16. doi:10.1046/j.1365-2141.1996.6102053.x. PMID 8757502. S2CID 30033345。
- ^ a b c d Bai RY, Jahn T, Schrem S, Munzert G, Weidner KM, Wang JY, Duyster J (August 1998). "The SH2-containing adapter protein GRB10 interacts with BCR-ABL". Oncogene. 17 (8): 941–948. doi:10.1038/sj.onc.1202024. PMID 9747873. S2CID 20866214。
- ^ a b Million RP, Harakawa N, Roumiantsev S, Varticovski L, Van Etten RA (June 2004). "A direct binding site for Grb2 contributes to transformation and leukemogenesis by the Tel-Abl (ETV6-Abl) tyrosine kinase". Molecular and Cellular Biology. 24 (11): 4685–4695. doi:10.1128/MCB.24.11.4685-4695.2004. PMC 416425. PMID 15143164。
- ^ Heaney C, Kolibaba K, Bhat A, Oda T, Ohno S, Fanning S, Druker BJ (January 1997). "Direct binding of CRKL to BCR-ABL is not required for BCR-ABL transformation". Blood. 89 (1): 297–306. doi:10.1182/blood.V89.1.297. PMID 8978305。
- ^ Kolibaba KS, Bhat A, Heaney C, Oda T, Druker BJ (March 1999). "CRKL binding to BCR-ABL and BCR-ABL transformation". Leukemia & Lymphoma. 33 (1–2): 119–126. doi:10.3109/10428199909093732. PMID 10194128。
- ^ Lionberger JM, Smithgall TE (February 2000). "The c-Fes protein-tyrosine kinase suppresses cytokine-independent outgrowth of myeloid leukemia cells induced by Bcr-Abl". Cancer Research. 60 (4): 1097–1103. PMID 10706130。
- ^ a b c Maru Y, Peters KL, Afar DE, Shibuya M, Witte ON, Smithgall TE (February 1995). "Tyrosine phosphorylation of BCR by FPS/FES protein-tyrosine kinases induces association of BCR with GRB-2/SOS". Molecular and Cellular Biology. 15 (2): 835–842. doi:10.1128/MCB.15.2.835. PMC 231961. PMID 7529874。
- ^ Million RP, Van Etten RA (July 2000). "The Grb2 binding site is required for the induction of chronic myeloid leukemia-like disease in mice by the Bcr/Abl tyrosine kinase". Blood. 96 (2): 664–670. doi:10.1182/blood.V96.2.664. PMID 10887132。
- ^ Ma G, Lu D, Wu Y, Liu J, Arlinghaus RB (May 1997). "Bcr phosphorylated on tyrosine 177 binds Grb2". Oncogene. 14 (19): 2367–2372. doi:10.1038/sj.onc.1201053. PMID 9178913. S2CID 9249479。
- ^ Stanglmaier M, Warmuth M, Kleinlein I, Reis S, Hallek M (February 2003). "The interaction of the Bcr-Abl tyrosine kinase with the Src kinase Hck is mediated by multiple binding domains". Leukemia. 17 (2): 283–289. doi:10.1038/sj.leu.2402778. PMID 12592324. S2CID 8695384。
- ^ Lionberger JM, Wilson MB, Smithgall TE (June 2000). "Transformation of myeloid leukemia cells to cytokine independence by Bcr-Abl is suppressed by kinase-defective Hck". The Journal of Biological Chemistry. 275 (24): 18581–18585. doi:10.1074/jbc.C000126200. PMID 10849448。
- ^ Radziwill G, Erdmann RA, Margelisch U, Moelling K (July 2003). "The Bcr kinase downregulates Ras signaling by phosphorylating AF-6 and binding to its PDZ domain". Molecular and Cellular Biology. 23 (13): 4663–4672. doi:10.1128/MCB.23.13.4663-4672.2003. PMC 164848. PMID 12808105。
- ^ a b Salgia R, Sattler M, Pisick E, Li JL, Griffin JD (February 1996). "p210BCR/ABL induces formation of complexes containing focal adhesion proteins and the protooncogene product p120c-Cbl". Experimental Hematology. 24 (2): 310–313. PMID 8641358。
- ^ Salgia R, Li JL, Lo SH, Brunkhorst B, Kansas GS, Sobhany ES, et al. (March 1995). "Molecular cloning of human paxillin, a focal adhesion protein phosphorylated by P210BCR/ABL". The Journal of Biological Chemistry. 270 (10): 5039–5047. doi:10.1074/jbc.270.10.5039. PMID 7534286。
- ^ Skorski T, Kanakaraj P, Nieborowska-Skorska M, Ratajczak MZ, Wen SC, Zon G, et al. (July 1995). "Phosphatidylinositol-3 kinase activity is regulated by BCR/ABL and is required for the growth of Philadelphia chromosome-positive cells". Blood. 86 (2): 726–736. doi:10.1182/blood.V86.2.726.bloodjournal862726. PMID 7606002。
- ^ Liedtke M, Pandey P, Kumar S, Kharbanda S, Kufe D (October 1998). "Regulation of Bcr-Abl-induced SAP kinase activity and transformation by the SHPTP1 protein tyrosine phosphatase". Oncogene. 17 (15): 1889–1892. doi:10.1038/sj.onc.1202117. PMID 9788431. S2CID 42228230。
- ^ Park AR, Oh D, Lim SH, Choi J, Moon J, Yu DY, et al. (October 2012). "Regulation of dendritic arborization by BCR Rac1 GTPase-activating protein, a substrate of PTPRT". Journal of Cell Science. 125 (Pt 19): 4518–4531. doi:10.1242/jcs.105502. PMID 22767509. S2CID 22422544。
- ^ Takeda N, Shibuya M, Maru Y (January 1999). "The BCR-ABL oncoprotein potentially interacts with the xeroderma pigmentosum group B protein". Proceedings of the National Academy of Sciences of the United States of America. 96 (1): 203–207. Bibcode:1999PNAS...96..203T. doi:10.1073/pnas.96.1.203. PMC 15117. PMID 9874796。
関連文献
[編集]関連項目
[編集]外部リンク
[編集]- BCR protein, human - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
- Human BCR genome location and BCR gene details page in the UCSC Genome Browser.
- Overview of all the structural information available in the PDB for UniProt: P11274 (Human Breakpoint cluster region protein) at the PDBe-KB.