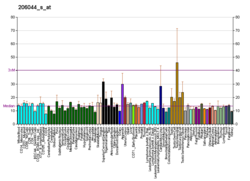
BRAF
BRAFまたはB-Rafは、ヒトではBRAF遺伝子にコードされるタンパク質である[5][6]。その名称は"v-raf murine sarcoma viral oncogene homolog B"の略号に由来する。
B-Rafは細胞成長の指示に関係する細胞内シグナル伝達に関与している。2002年には、ヒトの一部のがんで変異していることが示された[7]。また、その他のBRAFの遺伝性変異は先天性欠陥の原因ともなる。
BRAFの変異によって駆動されるがんに対する治療薬が開発されている。ベムラフェニブ[8]とダブラフェニブは進行期メラノーマに対する利用としてFDAの承認を受けている。ベムラフェニブは、フラグメント創薬によって作出された、最初の承認医薬品である[9]。
機能
[編集]
B-Rafはセリン/スレオニンキナーゼのRAFキナーゼファミリーの一員である。このタンパク質はMAPK/ERK経路の調節に関与し、細胞分裂、分化、そして分泌に影響を与える[10]。
構造
[編集]B-Rafは766アミノ酸からなるセリン/スレオニンキナーゼである。B-RafはRAFキナーゼファミリーの特徴となる3つの保存されたドメインから構成される。CR1(conserved region 1)はGTP結合型Ras(Ras-GTP)を結合する[11]自己調節ドメインであり、CR2はセリンとスレオニンに富む。CR3は触媒を担うプロテインキナーゼドメインであり、タンパク質基質中のコンセンサス配列を認識しリン酸化する[12]。B-Rafが活性型コンフォメーションとなった際には、キナーゼドメイン間の水素結合と静電的相互作用により二量体を形成する[13]。
CR1
[編集]CR1はB-Rafのキナーゼドメイン(CR3)の自己阻害を行い、B-Rafによるシグナルが恒常的に活性化されるのではなく、調節されたものとなるようにしている[12]。155–227番残基[14]はRas結合ドメイン(RBD)を形成し、Ras-GTPのエフェクタードメインと結合してCR1をCR3から解離させ、キナーゼの阻害を停止させる。234–280番残基はホルボールエステル/ジアシルグリセロール結合ジンクフィンガーモチーフを構成し、Ras結合後のB-Rafの膜へのドッキングに関与する[14][15]。
CR2
[編集]CR2はセリンとスレオニンに富む配列である[12]。
CR3
[編集]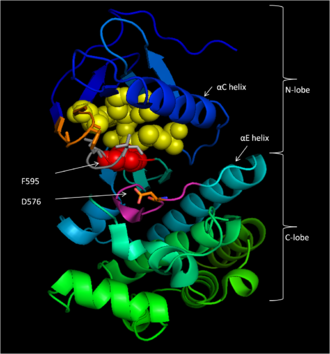
CR3は457–717番残基[14]からなり、B-Rafのキナーゼドメインを構成する。この大部分が保存された構造[16]は2つのローブからなり、両者は短いヒンジ領域で連結されている[17]。小さなNローブ(457–530番残基)は主にATPの結合を担い、大きなCローブ(535–717番残基)は基質タンパク質を結合する[16]。活性部位は2つのローブの間の溝である。触媒を担うAsp576残基はCローブに位置し、溝の内側に向かって位置している[14][16]。
より小さな区分
[編集]Pループ
B-RafのPループ(464–471番残基)はATPの結合時、転移が行われないリン酸基を安定化する。具体的には、S467、F468、G469の主鎖のアミドがATPのβ-リン酸と水素結合することでATP分子は固定される。B-Rafの機能的モチーフはPKAとの相同性の解析によって決定された[16]。
ヌクレオチド結合ポケット
V471、C532、W531、T529、L514、A481は疎水的なポケットを形成し、ATPの結合時にファンデルワールス力によってATPのアデニン部分を固定する[16][18]。
触媒ループ
574–581番残基は、ATPからタンパク質基質へのγ-リン酸の転移の補助を担う領域である。特に、D576はプロトン受容体として基質のセリンまたはスレオニン残基の求核的なヒドロキシル酸素を活性化する作用を果たし、塩基触媒によるリン酸基転移反応を可能にする[16]。
DFGモチーフ
D594、F595、G596は、不活性状態と活性化状態の双方でB-Rafの機能に中心的な役割を果たすモチーフを構成している。不活性状態では、F595はヌクレオチド結合ポケットを占拠し、ATPの進入を防ぐことで酵素触媒の可能性を低下させている[13][18][19]。活性化状態では、D594は二価マグネシウムカチオンをキレートし、ATPのβ-、γ-リン酸基を安定化するとともに、γ-リン酸基を転移に適した配向にする[16]。
活性化ループ
活性化ループの596–600番残基は不活性状態でPループと強力な疎水的相互作用を形成しており、リン酸化されるまでキナーゼを不活性状態に固定する役割を果たしている。リン酸化による負電荷の導入によってこうした相互作用は不安定化され、キナーゼの活性化状態への遷移が開始される。具体的には、活性化ループのL597とV600はPループのG466、F468、V471と相互作用しており、リン酸化されるまでキナーゼドメインを不活性状態に維持している[17]。
酵素反応
[編集]B-Rafはセリン/スレオニン特異的プロテインキナーゼである。そのため、標的タンパク質のコンセンサス配列中のセリンとスレオニン残基に対するATPを用いたリン酸化を触媒し、反応産物としてADPとリン酸化タンパク質が生じる[16]。B-Rafは高度に調節されたシグナル伝達キナーゼであり、酵素として活性化状態となるにはまずRas-GTPの結合が必要である[15]。活性化されると、プロテインキナーゼの保存された触媒コアは基質の活性化セリン/スレオニン残基のヒドロキシル酸素原子のATPγ-リン酸基に対する求核攻撃を促進し、タンパク質基質をリン酸化する。この反応はSN2反応である[16][20][21][22]。
活性化
[編集]CR1による自己阻害の解除
[編集]ヒトのRafキナーゼのキナーゼ(CR3)ドメインは、Ras-GTPを結合するCR1ドメインによる自己阻害、そしてCR2ヒンジ領域の重要なセリンとチロシン残基(c-Rafの場合S338とY341)に対して翻訳後修飾によるリン酸化が行われていないこと、という2つの機構によって阻害されている。B-Rafの活性化時には、まず自己阻害を行っているCR1ドメインにRas-GTPのエフェクタードメインが結合し、CR1ドメインはCR3ドメインから放出される。CR1とRasの相互作用は、CR1のシステインリッチサブドメイン(CRD)のRasと膜リン脂質への結合によってさらに強化される[12]。A-Rafやc-Rafの場合、CR1を完全に放出するためにはCR2のヒドロキシル基含有残基のリン酸化が必要であるが、B-RafのCR2領域はS445が恒常的にリン酸化されている[23]。そのため、負に帯電したリン酸化セリンはCR1調節ドメインが非結合状態となると立体的・静電的相互作用によって速やかに反発し、基質タンパク質と相互作用できるようCR3を遊離させる。
CR3ドメインの活性化
[編集]自己阻害を行っているCR1ドメインが放出された後、B-RafのCR3ドメインがタンパク質のリン酸化を触媒できるようになるには、ATP結合型の活性型コンフォメーションの変化が必要である。不活性コンフォメーションでは、DFGモチーフのF595が疎水的なアデニン結合ポケットを遮断し、活性化ループの残基はPループと疎水的相互作用を行うことでATPの結合部位へのアクセスを防いでいる。活性化ループがリン酸化されると、リン酸基の負電荷はPループの疎水的環境下では不安定であるため、活性化ループはコンフォメーション変化を引き起こし、キナーゼドメインのCローブへ伸展した形となる。この過程で、活性化ループはβ6ストランドと安定なβシート構造を形成する。一方、リン酸化残基はK507に接近し、安定した塩橋を形成することで活性化ループをこの位置に固定する。DFGモチーフも活性化ループとともにコンフォメーション変化を起こし、F595はアデニン結合部位からαCヘリックスとαEヘリックスの間の疎水的ポケットへ移動する。こうしたリン酸化に伴うDFGモチーフと活性化ループの移動によって、ATP結合部位が開放される。他の基質結合ドメインや触媒ドメインは既に正しく配置されているため、活性化ループのリン酸化だけによって、準備された活性部位の蓋を外すような連鎖反応を介してB-Rafのキナーゼドメインは活性化される[17]。
触媒機構
[編集]
SN2反応によるタンパク質のセリン・スレオニン残基のリン酸化を効率的に触媒するため、B-RafはまずATPを結合し、その後にATPのγ-リン酸基が転移される遷移状態を安定化する必要がある[16]。
ATP結合
[編集]B-RafはATPのアデニン部分を非極性ポケットに固定することでATPを結合し、リン酸基との水素結合や静電的相互作用によって分子を配向する。上述したPループやDFGモチーフに加えて、K483やE501が非転移リン酸基の安定化に重要な役割を果たしている。K483の第一級アミンの正電荷は、ATPが結合した際にα-、β-リン酸基の正電荷の安定化を可能にする。ATPが存在しない場合には、E501の負電荷がこの電荷を平衡化している[16][17]。
リン酸化
[編集]ATPがB-Rafのキナーゼドメインに結合すると、触媒ループのD576は基質のヒドロキシル基を活性化し、その求核性を高めることでリン酸化反応を速度論的に駆動し、触媒ループの他の残基は遷移状態を安定化する。N581はATPに結合している二価マグネシウムカチオンをキレートし、活性化セリン/スレオニン残基がリン酸基を攻撃する際に大きな電子間反発が起こらないようにしている。リン酸基の転移が行われると、ADPとリン酸化タンパク質が放出される[16]。
阻害薬
[編集]B-Rafの恒常的活性化型変異体は過剰な細胞成長シグナルを伝達することで広くがんの原因となっている(後述)ため、キナーゼドメインの不活性型・活性化型の双方を標的としたB-Raf阻害剤ががん治療薬候補として開発が行われている[17][18][19]。
ソラフェニブ
[編集]
ソラフェニブ(ネクサバール、BAY43-9006)は原発性肝臓がんと腎臓がんの治療に対するFDAの承認を受けた、V600E変異型B-Rafとc-Rafの阻害薬である。ソラフェニブは酵素を不活性型に固定することで、キナーゼドメインを不活化する。ソラフェニブはキナーゼドメインに高い親和性で結合し、ATP結合ポケットを遮断する。その後、活性化ループやDFGモチーフの残基と結合し、活性型コンフォメーションへの移動を防ぐ。最後に、トリフルオロメチルフェニル部分が活性化ループやDFGモチーフの活性型コンフォメーション部位を立体的に遮断し、キナーゼドメインのコンフォメーション変化による活性化を不可能にする[17]。
より具体的には、ピリジン環部分がキナーゼドメインのN-ローブの疎水的なヌクレオチド結合ポケット内に固定され、W531、F583、F595と相互作用する。触媒ループのF583やDFGモチーフのF595との疎水的相互作用は不活性型コンフォメーションを安定化し、酵素の活性化の可能性を低下させる。中央部のフェニル環はK483、L514、T529と疎水的に相互作用し、キナーゼドメインに対する親和性を高める。また、フェニル環とF595との疎水的相互作用はDFGモチーフのコンフォメーション変化のエネルギー的な有利さを弱める。E501とC532はそれぞれ尿素、ピリジン環部分と水素結合し、尿素のカルボニル基はD594の主鎖のアミドの窒素と水素結合を形成してDFGモチーフを固定する[17]。トリフルオロメチルフェニル部分は不活性型コンフォメーションの熱力学な有利さを高め、活性型コンフォメーションとなった際にDFGモチーフと活性化ループが位置するαC、αEヘリックス間の疎水的ポケットを立体的に遮断する[17]。
ベムラフェニブ
[編集]
ベムラフェニブ(PLX4032)は、進行期メラノーマの治療に対してFDAの承認を受けたV600変異型B-Raf阻害薬である[13]。不活性型キナーゼドメインに結合するソラフェニブとは異なり、ベムラフェニブは活性型である"DFG-in"型の構造のATP結合部位に固定されることで阻害を行う[18][19]。活性型のキナーゼのみを標的とすることで、ベムラフェニブはB-Rafが調節を受けていない細胞(通常がんの原因となる)の増殖を選択的に阻害する。
ベムラフェニブとその前駆体であるPLX4720は、薬物動態学的理由によってフェニル環が付加されていることのみが異なり[19]、両者の作用機序は同一である。PLX4720の7-アザインドール二環とアデニンとの差異は2か所の窒素原子が炭素で置換されている点のみで、N7とC532、N1とQ530との水素結合などの分子間相互作用は保存されているため、ATP結合部位に対して高い親和性を有する。ATP結合疎水的ポケット(C532、W531、T529、L514、A481)内への優れたフィッティングも結合親和性を高めている。ケトンリンカーの水分子との水素結合やジフルオロフェニル部分の2つ目の疎水的ポケット(A481、V482、K483、V471、I527、T529、L514、F583)へのフィッティングも非常に高い親和性での結合に寄与している。活性型Rafへの選択的な結合は末端のプロピル基が担っており、αCヘリックスの移動によって形成されたRaf選択的ポケットに結合する。活性型コンフォメーションへの選択性はpH依存的に脱プロトン化されるスルホンアミド基によってさらに高められており、活性化状態のD594の主鎖のアミドと水素結合を形成する。不活性状態では阻害剤のスルホンアミド基は主鎖のカルボニルと相互作用し、反発する。そのため、ベムラフェニブはB-Rafキナーゼドメインの活性化状態に選択的に結合する[18][19]。
臨床的意義
[編集]BRAF遺伝子の変異は2つの方法で疾患の原因となる。遺伝性の変異は先天性の欠陥の原因となり、よりのちの段階で獲得された変異はがんの原因となる。
この遺伝子の遺伝性変異はCFC症候群の原因となる。この疾患は、心臓の欠陥、精神遅滞、特徴的顔貌によって特徴づけられる[24]。
この遺伝子の変異は、非ホジキンリンパ腫、大腸がん、メラノーマ、甲状腺乳頭がん、非小細胞肺がん、肺腺がん、膠芽腫や多形黄色星細胞腫などの脳腫瘍といったがんや、エルドハイム・チェスター病などの炎症性疾患でみられる[10]。
BRAF遺伝子のV600E変異は有毛細胞白血病と関係していることが多くの研究で示されている[25]。また、この変異はリンチ症候群の診断の際にMLH1遺伝子のシーケンシングを行う必要性のある患者の数を減らすためのスクリーニング検査への利用が提案されている[26]。
変異
[編集]ヒトのがんと関係しているBRAF遺伝子の変異は30種類以上同定されている。BRAFの変異の頻度はがんの種類によって異なり、メラノーマや色素性母斑では80%以上の頻度であるのに対し、その他のがんでは0–18%であり、肺がんでは1–3%、大腸がんでは5%である[27]。変異症例の90%では、1799番ヌクレオチドのアデニンがチミンに置換されている。その結果、BRAFタンパク質の600番コドンのバリン(V)がグルタミン酸(E)に置換され(そのためV600Eと呼ばれる)、活性化型として存在する[28]。この変異は、甲状腺乳頭がん、大腸がん、メラノーマ、非小細胞肺がんで広く観察される[29][29][30][31][32][33][34][35]。また、ランゲルハンス細胞組織球症の患者の57%に存在する[36]。V600E変異は有毛細胞白血病の症例の100%でドライバー変異となっている可能性が高い[37][38]。BRAF V600E変異は、良性であるものの局所浸潤性を有する歯原性新生物であるエナメル上皮腫でも高頻度で検出される[39]。また頭蓋咽頭腫の特定の症例において、V600E変異が腫瘍発生の単一のドライバー変異として関係している可能性もある[40][41]。
その他の見つかっている変異としては、R461I、I462S、G463E、G463V、G465A、G465E、G465V、G468A、G468E、G469R、N580S、E585K、D593V、F594L、G595R、L596V、T598I、V599D、V599E、V599K、V599R、V600K、A727Vなどがある。こうした変異の大部分は、Nローブのグリシンに富むPループ、そして活性化ループとその隣接配列という2つの領域に密集している[17]。これらの変異は不活性化状態から活性化状態へのへっかを引き起こす。一例として、V599の脂肪族側鎖はPループのF467のフェニル環と相互作用している。この中程度の大きさで疎水的なバリン側鎖がヒトのがんでみられるより大きな荷電残基(グルタミン酸、アスパラギン酸、リジン、アルギニン)に置換されることで、DFGモチーフを不活性コンフォメーションに維持している相互作用は不安定化され、活性化位置への移動が生じると考えられる。変異の種類によって、MEKに対するキナーゼ活性も変化する可能性がある。変異体の大部分はMEKに対するB-Rafのキナーゼ活性を促進するが、いくつかの変異体ではMEKに対する活性は低下する。これらの変異体は野生型c-Rafを活性化するコンフォメーションをとり、その後ERKにシグナルを伝達する。
BRAF-V600E
[編集]BRAF V600E変異は、プロテアソーム阻害薬に対する感受性の決定因子である。プロテアソーム阻害薬に対する脆弱性は持続的なBRAFシグナルに依存しており、PLX4720によるBRAF-V600Eの遮断はBRAF変異型大腸がん細胞のカルフィルゾミブに対する感受性を反転させる。プロテアソームの阻害はBRAF V600E変異型大腸がんに対する有用な戦略標的となる可能性がある[42]。
BRAF阻害薬
[編集]BRAFの理解は進んでおり、また効果の大きい標的であるため、抗がん薬としての利用を目的として変異型BRAFの特異的阻害剤が開発が行われている[18][43]。ベムラフェニブ(RG7204、PLX4032)は、第III相臨床試験の結果に基づいて2011年8月に転移性メラノーマに対する治療がFDAによって認可された。生存率の改善が観察され、また治療の奏効率も53%と、それまで最善の化学治療薬であったダカルバジンの7–12%から改善した[44]。こうした高い有効性の一方で、腫瘍の20%は治療に対する抵抗性を獲得した。マウスでは、腫瘍の20%が56日後に抵抗性を獲得する[45]。この抵抗性の機構には議論があるが、BRAFの過剰発現による高濃度のベムラフェニブに対する補償[45]や上流の成長シグナルのアップレギュレーション[46]といった仮説が立てられている。
相互作用
[編集]BRAFは次に挙げる因子と相互作用することが示されている。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000157764 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000002413 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Complete coding sequence of a human B-raf cDNA and detection of B-raf protein kinase with isozyme specific antibodies”. Oncogene 5 (12): 1775–80. (December 1990). PMID 2284096.
- ^ “B-raf and a B-raf pseudogene are located on 7q in man”. Oncogene 7 (4): 795–9. (April 1992). PMID 1565476.
- ^ “Mutations of the BRAF gene in human cancer”. Nature 417 (6892): 949–54. (June 2002). Bibcode: 2002Natur.417..949D. doi:10.1038/nature00766. PMID 12068308.
- ^ "FDA Approves Zelboraf (Vemurafenib) and Companion Diagnostic for BRAF Mutation-Positive Metastatic Melanoma, a Deadly Form of Skin Cancer" (Press release). Genentech. 2011年8月17日閲覧。
- ^ “Twenty years on: the impact of fragments on drug discovery”. Nature Reviews. Drug Discovery 15 (9): 605–619. (September 2016). doi:10.1038/nrd.2016.109. PMID 27417849.
- ^ a b “Entrez Gene: BRAF”. 2022年10月16日閲覧。
- ^ “The ins and outs of Raf kinases”. Trends in Biochemical Sciences 19 (11): 474–80. (November 1994). doi:10.1016/0968-0004(94)90133-3. PMID 7855890.
- ^ a b c d “Autoregulation of the Raf-1 serine/threonine kinase”. Proceedings of the National Academy of Sciences of the United States of America 95 (16): 9214–9. (August 1998). Bibcode: 1998PNAS...95.9214C. doi:10.1073/pnas.95.16.9214. PMC 21318. PMID 9689060.
- ^ a b c “Vemurafenib: the first drug approved for BRAF-mutant cancer”. Nature Reviews. Drug Discovery 11 (11): 873–86. (November 2012). doi:10.1038/nrd3847. PMID 23060265.
- ^ a b c d “Serine/threonine protein kinase B-rAF”. 4 Mar 2013閲覧。
- ^ a b “The complexity of Raf-1 regulation”. Current Opinion in Cell Biology 9 (2): 174–9. (April 1997). doi:10.1016/S0955-0674(97)80060-9. PMID 9069260.
- ^ a b c d e f g h i j k l “Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification”. FASEB Journal 9 (8): 576–96. (May 1995). doi:10.1096/fasebj.9.8.7768349. PMID 7768349.
- ^ a b c d e f g h i . Cancer Genome Project“Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF”. Cell 116 (6): 855–67. (March 2004). doi:10.1016/S0092-8674(04)00215-6. PMID 15035987.
- ^ a b c d e f “Discovery of a selective inhibitor of oncogenic B-Raf kinase with potent antimelanoma activity”. Proceedings of the National Academy of Sciences of the United States of America 105 (8): 3041–6. (February 2008). Bibcode: 2008PNAS..105.3041T. doi:10.1073/pnas.0711741105. PMC 2268581. PMID 18287029.
- ^ a b c d e “Clinical efficacy of a RAF inhibitor needs broad target blockade in BRAF-mutant melanoma”. Nature 467 (7315): 596–9. (September 2010). Bibcode: 2010Natur.467..596B. doi:10.1038/nature09454. PMC 2948082. PMID 20823850.
- ^ “The protein kinase family: conserved features and deduced phylogeny of the catalytic domains”. Science 241 (4861): 42–52. (July 1988). Bibcode: 1988Sci...241...42H. doi:10.1126/science.3291115. PMID 3291115.
- ^ “Eukaryotic protein kinases”. Curr. Opin. Struct. Biol. 1 (3): 369–383. (June 1991). doi:10.1016/0959-440X(91)90035-R.
- ^ “[2] Protein kinase catalytic domain sequence database: Identification of conserved features of primary structure and classification of family members”. Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members. Methods in Enzymology. 200. (1991). pp. 38–62. doi:10.1016/0076-6879(91)00126-H. ISBN 9780121821012. PMID 1956325
- ^ “Serine and tyrosine phosphorylations cooperate in Raf-1, but not B-Raf activation”. The EMBO Journal 18 (8): 2137–48. (April 1999). doi:10.1093/emboj/18.8.2137. PMC 1171298. PMID 10205168.
- ^ “The cardiofaciocutaneous syndrome”. Journal of Medical Genetics 43 (11): 833–42. (November 2006). doi:10.1136/jmg.2006.042796. PMC 2563180. PMID 16825433.
- ^ “Real-time PCR-based analysis of BRAF V600E mutation in low and intermediate grade lymphomas confirms frequent occurrence in hairy cell leukaemia”. Hematological Oncology 30 (4): 190–3. (December 2012). doi:10.1002/hon.1023. PMID 22246856.
- ^ “EGAPP supplementary evidence review: DNA testing strategies aimed at reducing morbidity and mortality from Lynch syndrome”. Genetics in Medicine 11 (1): 42–65. (January 2009). doi:10.1097/GIM.0b013e31818fa2db. PMC 2743613. PMID 19125127.
- ^ “Clinical implication of hot spot BRAF mutation, V599E, in papillary thyroid cancers”. The Journal of Clinical Endocrinology and Metabolism 88 (9): 4393–7. (September 2003). doi:10.1210/jc.2003-030305. PMID 12970315.
- ^ “Detection of BRAF V600E mutation by pyrosequencing”. Pathology 40 (3): 295–8. (April 2008). doi:10.1080/00313020801911512. PMID 18428050.
- ^ a b “BRAF mutations are associated with distinctive clinical, pathological and molecular features of colorectal cancer independently of microsatellite instability status”. Molecular Cancer 5 (1): 2. (January 2006). doi:10.1186/1476-4598-5-2. PMC 1360090. PMID 16403224.
- ^ “Detection of BRAF V600E mutation in colorectal cancer: comparison of automatic sequencing and real-time chemistry methodology”. The Journal of Molecular Diagnostics 8 (5): 540–3. (November 2006). doi:10.2353/jmoldx.2006.060070. PMC 1876165. PMID 17065421.
- ^ “BRAF mutation is frequently present in sporadic colorectal cancer with methylated hMLH1, but not in hereditary nonpolyposis colorectal cancer”. Clinical Cancer Research 10 (1 Pt 1): 191–5. (January 2004). doi:10.1158/1078-0432.CCR-1118-3. PMID 14734469.
- ^ “BRAF mutations in conjunctival melanoma”. Investigative Ophthalmology & Visual Science 45 (8): 2484–8. (August 2004). doi:10.1167/iovs.04-0093. PMID 15277467.
- ^ “Determinants of BRAF mutations in primary melanomas”. Journal of the National Cancer Institute 95 (24): 1878–90. (December 2003). doi:10.1093/jnci/djg123. PMID 14679157.
- ^ “BRAF(V599E) mutation is the leading genetic event in adult sporadic papillary thyroid carcinomas”. The Journal of Clinical Endocrinology and Metabolism 89 (5): 2414–20. (May 2004). doi:10.1210/jc.2003-031425. PMID 15126572.
- ^ “BRAF(V600E) mutation and outcome of patients with papillary thyroid carcinoma: a 15-year median follow-up study”. The Journal of Clinical Endocrinology and Metabolism 93 (10): 3943–9. (October 2008). doi:10.1210/jc.2008-0607. PMID 18682506.
- ^ “Recent advances in the understanding of Langerhans cell histiocytosis”. British Journal of Haematology 156 (2): 163–72. (January 2012). doi:10.1111/j.1365-2141.2011.08915.x. PMID 22017623.
- ^ Tiacci, Enrico; Trifonov, Vladimir; Schiavoni, Gianluca; Holmes, Antony; Kern, Wolfgang; Martelli, Maria Paola; Pucciarini, Alessandra; Bigerna, Barbara et al. (2011-06-16). “BRAF mutations in hairy-cell leukemia”. The New England Journal of Medicine 364 (24): 2305–2315. doi:10.1056/NEJMoa1014209. ISSN 1533-4406. PMC 3689585. PMID 21663470.
- ^ “Research on hairy-cell leukaemia shows the promise of new DNA-scanning technologies”. Cancer Research UK. 2022年11月3日閲覧。
- ^ “High frequency of BRAF V600E mutations in ameloblastoma”. The Journal of Pathology 232 (5): 492–8. (April 2014). doi:10.1002/path.4317. PMC 4255689. PMID 24374844.
- ^ Brastianos, Priscilla K.; Taylor-Weiner, Amaro; Manley, Peter E.; Jones, Robert T.; Dias-Santagata, Dora; Thorner, Aaron R.; Lawrence, Michael S.; Rodriguez, Fausto J. et al. (2014-02). “Exome sequencing identifies BRAF mutations in papillary craniopharyngiomas”. Nature Genetics 46 (2): 161–165. doi:10.1038/ng.2868. ISSN 1546-1718. PMC 3982316. PMID 24413733.
- ^ “Single driver mutation found in rare brain tumor” (英語). Broad Institute (2014年1月30日). 2022年11月3日閲覧。
- ^ “BRAF V600E is a determinant of sensitivity to proteasome inhibitors”. Molecular Cancer Therapeutics 12 (12): 2950–61. (December 2013). doi:10.1158/1535-7163.MCT-13-0243. hdl:2318/140935. PMID 24107445.
- ^ “Demonstration of a genetic therapeutic index for tumors expressing oncogenic BRAF by the kinase inhibitor SB-590885”. Cancer Research 66 (23): 11100–5. (December 2006). doi:10.1158/0008-5472.CAN-06-2554. PMID 17145850.
- ^ . BRIM-3 Study Group“Improved survival with vemurafenib in melanoma with BRAF V600E mutation”. The New England Journal of Medicine 364 (26): 2507–16. (June 2011). doi:10.1056/NEJMoa1103782. PMC 3549296. PMID 21639808.
- ^ a b “Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance”. Nature 494 (7436): 251–5. (February 2013). Bibcode: 2013Natur.494..251D. doi:10.1038/nature11814. PMC 3930354. PMID 23302800.
- ^ “Melanomas acquire resistance to B-RAF(V600E) inhibition by RTK or N-RAS upregulation”. Nature 468 (7326): 973–7. (December 2010). Bibcode: 2010Natur.468..973N. doi:10.1038/nature09626. PMC 3143360. PMID 21107323.
- ^ “Negative regulation of the serine/threonine kinase B-Raf by Akt”. The Journal of Biological Chemistry 275 (35): 27354–9. (September 2000). doi:10.1074/jbc.M004371200. PMID 10869359.
- ^ “Active Ras induces heterodimerization of cRaf and BRaf”. Cancer Research 61 (9): 3595–8. (May 2001). PMID 11325826.
- ^ “Interaction of activated Ras with Raf-1 alone may be sufficient for transformation of rat2 cells”. Molecular and Cellular Biology 17 (6): 3047–55. (June 1997). doi:10.1128/MCB.17.6.3047. PMC 232157. PMID 9154803.
- ^ “Biochemical analysis of MEK activation in NIH3T3 fibroblasts. Identification of B-Raf and other activators”. The Journal of Biological Chemistry 270 (13): 7644–55. (March 1995). doi:10.1074/jbc.270.13.7644. PMID 7706312.
- ^ “Large-scale mapping of human protein-protein interactions by mass spectrometry”. Molecular Systems Biology 3 (1): 89. (2007). doi:10.1038/msb4100134. PMC 1847948. PMID 17353931.
- ^ “Cell type-specific regulation of B-Raf kinase by cAMP and 14-3-3 proteins”. The Journal of Biological Chemistry 275 (41): 31921–9. (October 2000). doi:10.1074/jbc.M003327200. PMID 10931830.
関連文献
[編集]- “Guilty as charged: B-RAF is a human oncogene”. Cancer Cell 6 (4): 313–9. (October 2004). doi:10.1016/j.ccr.2004.09.022. PMID 15488754.
- “Evidence that one subset of anaplastic thyroid carcinomas are derived from papillary carcinomas due to BRAF and p53 mutations”. Cancer 103 (11): 2261–8. (June 2005). doi:10.1002/cncr.21073. PMID 15880523.
- “The role of tuberin in cellular differentiation: are B-Raf and MAPK involved?”. Annals of the New York Academy of Sciences 1059 (1): 168–73. (November 2005). Bibcode: 2005NYASA1059..168K. doi:10.1196/annals.1339.045. PMID 16382052.
- “RET/PTC rearrangements and BRAF mutations in thyroid tumorigenesis”. Endocrinology 148 (3): 936–41. (March 2007). doi:10.1210/en.2006-0921. PMID 16946010.
- “Targeting BRAF in thyroid cancer”. British Journal of Cancer 96 (1): 16–20. (January 2007). doi:10.1038/sj.bjc.6603520. PMC 2360215. PMID 17179987.
- “Noonan Syndrome”. GeneReviews [Internet]. Seattle WA: University of Washington, Seattle. (8 August 2019). PMID 20301303
- “Cardiofaciocutaneous Syndrome”. GeneReviews [Internet]. Seattle WA: University of Washington, Seattle. (3 March 2016). PMID 20301365
- “LEOPARD Syndrome”. GeneReviews [Internet]. Seattle WA: University of Washington, Seattle. (14 May 2015). PMID 20301557
外部リンク
[編集]- “BRAF gene”. NCI Dictionary of Cancer Terms. 2007年11月25日閲覧。
- Finding faults in BRAF — Cancer Research UK blog post about the discovery of cancer-causing BRAF mutations (incl video)
- Human BRAF genome location and BRAF gene details page in the UCSC Genome Browser.