ヘパリン
 ヘパリンの基本単位 (例) | |
| データベースID | |
|---|---|
| CAS番号 | 9005-49-6 |
| PubChem | SID: 96024437 |
| KEGG | D07510 |
| ChEBI | CHEBI:28304 |
| 日化辞番号 | J293.322E |
| 化学的データ | |
| 化学式 | (C26H40N2O36S5)n |
| 分子量 | 1116.91×n 約3,000 - 35,000Da[1] |
| データベースID | |
|---|---|
| CAS番号 | 9041-08-1 |
| PubChem | SID: 7849173 |
| KEGG | D02112 |
| 日化辞番号 | J209.198D |
ヘパリン (heparin) は抗凝固薬の一つであり、血栓塞栓症や播種性血管内凝固症候群 (DIC) の治療、人工透析、体外循環での凝固防止などに用いられる。ヘパリンの原料は牛や豚の腸粘膜から採取されるが、牛海綿状脳症 (BSE) 発生後の現在は健康な豚から採取されたものがほとんどである。
肝細胞から発見されたため "heparin" と名付けられた(hepato- は「肝の」という意味)が、小腸、筋肉、肺、脾や肥満細胞など体内で幅広く存在する。化学的にはグリコサミノグリカンであるヘパラン硫酸の一種であり、β-D-グルクロン酸あるいは α-L-イズロン酸と D-グルコサミンが 1,4 結合により重合した高分子で、ヘパラン硫酸と比べて硫酸化の度合いが特に高いという特徴がある。この分子中に多数含まれる硫酸基が負に帯電しているため、種々の生理活性物質と相互作用する。
生体内において肝臓で生成される。ヘパリンは細胞表面に存在し、種々の細胞外マトリクスタンパク質と相互作用している。それらのタンパク質の中には、上記の抗凝固作用に関与する凝固系や線溶系のタンパク質の他に、種々の成長因子、脂質代謝関連タンパク質など100を超える種類のタンパク質が含まれ、細胞増殖や脂質代謝にも関与している。
歴史
[編集]- 1916年、ジョンズ・ホプキンス大学の医学生ジェイ・マクリーン(Jay McLean)がイヌの肝臓から抗凝固物質ヘパリンを発見した。
作用機序
[編集]
アンチトロンビンを活性化し、抗凝血作用能の賦活を通して凝固系を抑制する(APTTを延長する)。アンチトロンビンIIIはトロンビン、第Xa因子(第X因子の活性型)およびその他のセリンプロテアーゼを、その活性セリン部位と結合することで阻害する。ヘパリンはこのアンチトロンビンIIIと結合し、構造を変化させて阻害作用を活性化する。トロンビンはヘパリン-アンチトロンビンIII複合体に対して、第Xa因子よりも高い親和性を有する。
トロンビンの阻害には、アンチトロンビンIIIおよびトロンビンの両分子がヘパリンに結合している必要があるが、第Xa因子の阻害では、ヘパリンと第Xa因子の結合は必要でなく、ヘパリンとアンチトロンビンIIIの結合だけでよい。
低分子量ヘパリン (LMWH, Low Molecular Weight Heparin) は出血の副作用が少なく、近年使用頻度が増えてきている。低分子量ヘパリンは、糖鎖が短いためアンチトロンビンIIIとは結合できるが、トロンビンとは結合できないことから、トロンビンの作用を阻害せず、アンチトロンビンIIIとヘパリンの結合のみでよい第Xa因子の作用は阻害する。
薬物動態
[編集]ヘパリンは、分子サイズが大きく表面電荷が高いために腸管からは吸収されない。したがって、通常静脈内注射あるいは皮下注射により投与される。ただし、筋肉注射は血腫の危険性が高いため行われない。
未分画ヘパリンの静脈内投与は、血液中からの急速な消失相とそれに続く緩慢な消失相がある。前者は上皮細胞やマクロファージへの結合で、後者は腎臓からの排泄に起因する。静脈内投与では、作用が速やかに現れるが、皮下投与では作用が現れるまで約60分要する。血中半減期は約40–90分である。
低分子量ヘパリンは、皮下注射により投与され、未分画ヘパリンよりも長い半減期(腎排泄のみ)を有する。その消失は一相性であり、血中濃度の予測が未分画ヘパリンよりも容易で、急速な消失がないため投与頻度も少なくて済む。また、低分子量ヘパリンはAPTTを延長しない。
用途
[編集]血栓塞栓症や播種性血管内凝固症候群 (DIC) の治療、人工透析、人工心肺での凝固防止などに、日常的に広く用いられている。採血した血液の凝固防止にも用いられる。
ヘパリン置換
[編集]ヘパリン置換とは、抗血小板薬や抗凝固薬を服用している患者が外科手術や内視鏡的治療を受ける際に、これらの薬をヘパリンに変更すること。ヘパリンブリッジとも呼ばれる。術前に抗血小板薬や抗凝固薬を服用している患者は、凝固系の働きが抑えられているため、外科手術や内視鏡的治療によって出血してしまうと、止血に難渋する、と考えられてきた。ワーファリンなどの薬がその対象であるが、半減期が長いため手術の数日前から服用を止めなければ周術期の出血リスクが高まる。
抗凝固薬の休薬ができる場合は休薬とするが、血栓塞栓症のハイリスク患者では逆に周術期の血栓塞栓症リスクが高まる。そこで、内服している抗凝固薬の代わりにヘパリンを経静脈投与することでそのリスクを減らすべきとされてきた。
ヘパリンを用いることの利点
[編集]抗血小板療法に対するヘパリン置換の衰退
[編集]抗凝固薬であるワーファリンと同じ抗凝固薬であり、半減期が短いヘパリンで置換することに関しては病態生理学的合理性があるが、抗血小板薬を作用機序の異なるヘパリンで置換することに関しては、半減期が短い抗血小板薬が臨床的に利用できない現状、ヘパリンで代替するしかなく、賛否両論が長く続いてきた。しかし、ヘパリン置換による有益性を示すエビデンスがほとんど報告されていないことから、近年は、抗血小板薬の内服はできるだけ継続し、ヘパリン置換は行わないことが各種ガイドラインで推奨されている[3][4]。
ヘパリンの拮抗薬
[編集]硫酸プロタミンがヘパリンの抗凝固作用を打ち消すために投与されてきた(過去6時間以内に投与されたヘパリン100単位あたり1mg)[2]。ヘパリンを過剰投与された患者やヘパリンが不要になった患者に、その作用を逆転させる目的で使用される[5]。
副作用
[編集]ヘパリンの重大な副作用として、血小板が免疫反応の標的となり血小板が分解されて血小板減少症を引き起こすヘパリン起因性血小板減少症(HIT)が知られている。不顕性の血小板数減少と症候性の血栓症(動静脈血栓の発生、増加、拡大)を特徴とする。この症状は通常、投与を中止すると回復し、一般に合成ヘパリンを使用することで回避できる。また、ヘパリン使用初期に良性の血小板減少症がみられるが、これはヘパリンを中止しなくても消失する。
他の副作用として、2つの非出血性副作用が知られている。一つは血清アミノ基転移酵素値の上昇で、ヘパリン投与患者の80%に見られると報告されている。この異常は肝機能障害とは無関係であり、本剤の投与を中止すると消失する。もう一つの合併症は高カリウム血症で、ヘパリン投与患者の5 - 10%に認められ、ヘパリンによるアルドステロン抑制の結果である。高カリウム血症は、ヘパリン治療開始後数日以内に現れることが多い。さらに稀に、慢性的な使用により脱毛や骨多孔症が起こり得る。
多くの薬剤と同様に、ヘパリンの過剰摂取は致命的となる可能性がある。2006年9月、インディアナポリスの病院で3人の早産児が誤ってヘパリンを過剰投与され死亡し、ヘパリンは世界的に注目された[6]。
禁忌
[編集]ヘパリンは下記の患者には禁忌である。
- 出血している患者
- 血小板減少性紫斑病、血管障害による出血傾向、血友病その他の血液凝固障害(汎発性血管内血液凝固症候群<DIC>を除く)、月経期間中、手術時、消化管潰瘍、尿路出血、喀血、流早産・分娩直後など性器出血を伴う妊産褥婦、頭蓋内出血の疑いのある患者など
- 出血する可能性のある患者
- 内臓腫瘍、消化管の憩室炎、大腸炎、亜急性細菌性心内膜炎、重症高血圧症、重症糖尿病の患者など
- 重篤な肝障害のある患者
- 重篤な腎障害のある患者
- 中枢神経系の手術または外傷後日の浅い患者
- 製剤成分に対し過敏症の既往歴のある患者
- ヘパリン起因性血小板減少症(HIT:heparin-induced thrombocytopenia)の既往歴のある患者
化学的特徴
[編集]分子構造
[編集]
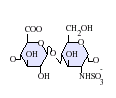
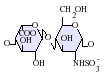
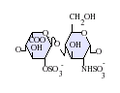
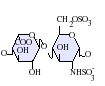
ヘパリンは分子量3 - 30kDaのポリマーであるが、市販されている多くのヘパリン製剤の平均分子量は12 - 15kDaの範囲にある[7]。ヘパリンはグリコサミノグリカンという糖質(近縁の分子であるヘパラン硫酸を含む)の一員であり、可変的に硫酸化された繰り返し2糖単位から構成されている[8]。ヘパリンに存在する主な2糖単位を以下に示す。最も一般的な2糖単位は、2-O-硫酸化イズロン酸(IdoA)と6-O-硫酸化、N-硫酸化グルコサミン(GlcN)、IdoA(2S)-GlcNS(6S)から構成される。例えば、牛肺由来のヘパリンの85%、豚腸管粘膜由来のヘパリンの約75%がこれで構成されている[9]。
3-O-硫酸化グルコサミン(GlcNS(3S,6S))や遊離アミン基(GlcNH3+)を含む2糖類も稀に存在するが、以下に示していない。生理的条件下では、エステル硫酸基とアミド硫酸基は脱プロトン化され、正電荷の対イオンを引きつけ、ヘパリン塩を形成する。ヘパリンは通常この形で抗凝固剤として投与される。
-
GlcA-GlcNAc -
GlcA-GlcNS -
IdoA-GlcNS -
IdoA(2S)-GlcNS -
IdoA-GlcNS(6S) -
IdoA(2S)-GlcNS(6S)
- GlcA = β-D-glucuronic acid,
- IdoA = α-L-iduronic acid,
- IdoA(2S) = 2-O-sulfo-α-L-iduronic acid,G
- lcNAc = 2-deoxy-2-acetamido-α-D-glucopyranosyl,
- GlcNS = 2-deoxy-2-sulfamido-α-D-glucopyranosyl,
- GlcNS(6S) = 2-deoxy-2-sulfamido-α-D-glucopyranosyl-6-O-sulfate
ヘパリン1単位(ハウエル単位)は、純ヘパリン0.002mgにほぼ相当する量であり、猫の血液1mlを0℃で24時間保持するのに必要な量である[10]。
三次元構造
[編集]
ヘパリンの立体構造は、オリゴ糖の内部に位置するイズロン酸が2つの低エネルギーの立体配座のどちらかで存在するため、複雑である。この立体配座平衡は、隣接するグルコサミン糖の硫酸化状態に影響される[11]。しかしながら、6つのGlcNS(6S)-IdoA(2S)繰り返しユニットからなるヘパリン12糖の溶液構造がNMR分光法と分子モデリング技術の組み合わせにより決定されている[12]。すべてのIdoA(2S)が2S0立体配座にあるモデル(右図のAおよびB)と、1C4立体配座にあるモデル(以下のCおよびD)の2つのモデルが構築された。しかし、これらの立体配座間の変化が協調的に起こることを示す証拠はない。これらのモデルは、タンパク質データバンクコード1HPNに対応している[13]。
関連項目
[編集]外部リンク
[編集]- ヘパリン研究データ{en}
- ワクチン後の血栓症、原因は? 薬の副作用に類似と報告(朝日新聞2021年4月15日、コロナ感染症関連記事)
- 重篤副作用疾患別対応マニュアル ヘパリン起因性血小板減少症(HIT)平成22年3月 厚生労働省
- ヘパリン起因性血小板減少症(HIT)厚生労働省
参考資料
[編集]- ^ 辻肇 (2008). “ヘパリン類の適正使用”. 日本血栓止血学会誌 19 (2): 187-190.
- ^ a b Internal medicine, Jay H. Stein, p. 635
- ^ “2022年改訂版 非心臓手術における合併心疾患の評価と管理に関するガイドライン”. 日本循環器学会. p. 53. 2023年1月22日閲覧。
- ^ “抗血栓療法患者の抜歯に関するガイドライン 2020年版”. 日本有病者歯科医療学会. 2023年1月22日閲覧。
- ^ “Protamine Sulfate”. The American Society of Health-System Pharmacists. 6 November 2016時点のオリジナルよりアーカイブ。8 December 2016閲覧。
- ^ “3rd Ind. preemie infant dies of overdose”. Associated Press. Fox News. (20 September 2006). オリジナルの2007年10月18日時点におけるアーカイブ。 2007年1月8日閲覧。
- ^ “Chapter 21. Principles of Antithrombotic Therapy”. Williams Hematology (7th ed.). (2006). ISBN 978-0-07-143591-8. オリジナルの2011-07-07時点におけるアーカイブ。
- ^ “Synthesis and heparin-like biological activity of amino acid-based polymers”. Polymers for Advanced Technologies 11 (8–12): 377–387. (2000). doi:10.1002/1099-1581(200008/12)11:8/12<377::AID-PAT985>3.0.CO;2-D.
- ^ “Studies on the Conformation of Heparin by1H and13C NMR Spectroscopy”. Macromolecules 12 (5): 1001–1007. (1979). Bibcode: 1979MaMol..12.1001G. doi:10.1021/ma60071a044. ISSN 0024-9297.
- ^ “Online Medical Dictionary”. Centre for Cancer Education (2000年). 2007年8月13日時点のオリジナルよりアーカイブ。2008年7月11日閲覧。
- ^ “Conformer populations of L-iduronic acid residues in glycosaminoglycan sequences”. Carbohydrate Research 195 (2): 157–67. (January 1990). doi:10.1016/0008-6215(90)84164-P. PMID 2331699.
- ^ “N.m.r. and molecular-modelling studies of the solution conformation of heparin”. The Biochemical Journal 293 (Pt 3): 849–58. (August 1993). doi:10.1042/bj2930849. PMC 1134446. PMID 8352752.
- ^ “N.M.R. and molecular-modeling studies of the solution conformation of heparin”. 2021年12月23日閲覧。