コーリー・バクシ・柴田還元
| コーリー・バクシ・柴田還元 | |
|---|---|
| 名の由来 | イライアス・コーリー ラマン・バクシ 柴田サイゾウ |
| 種類 | 有機酸化還元反応 |
| 識別情報 | |
| Organic Chemistry Portal | corey-bakshi-shibata-reduction |
コーリー・バクシ・柴田還元(コーリー・バクシ・しばたかんげん、英語: Corey–Bakshi–Shibata reduction)は、キラルなオキサザボロリジンを触媒としてボランにより光学不活性ケトンを不斉還元して光学活性な2級アルコールを得る還元反応のことである。CBS還元と略されることも多い。1987年にイライアス・コーリー、ラマン・バクシ、柴田サイゾウによって報告された[1][2]。オキサボロリジンを用いたケトンの不斉還元は、これ以前の1981年に伊津野真一らによって報告されている[3]。

CBS還元は、アキラルなケトンの不斉還元の信頼できる方法として、有機化学者に用いられてきた。特に、数多くの天然物合成に用いられるだけでなく、工業的な大スケール反応でも用いられている。詳しくは総説を参照のこと[4][5][6]。
概要
[編集]この還元反応の原型は1981年に伊津野真一らによって報告されたアミノ酸を還元して得られるアミノアルコールをボランとともに用いる不斉還元反応である[3]。伊津野らは1983年にボランとアミノアルコールを2:1のモル比で反応させると最も高い光学純度で生成物のアルコールが得られること、還元の活性種はオキサザボロリジンにボランが配位したものと考えられることを報告していた[7]。また1985年にはアルコールの結合した炭素上にフェニル基を2つ導入したアミノアルコールが特に高い光学純度で生成物を与えることを報告していた[8]。コーリーらは伊津野らによって推定されていたオキサザボロリジンを実際に単離、構造決定し、これは触媒量使用するだけでも不斉還元が可能なこと、特にプロリンに2つフェニル基を導入したオキサザボロリジンが触媒活性、生成物の光学純度ともに優れていることを報告した[1][2]。
触媒のオキサザボロリジンはアミノ酸から誘導したアミノアルコールとボランを混合するだけで調製することが可能である。ボランの代わりにブチルホウ酸や3,5-ビストリフルオロメチルフェニルホウ酸ジクロリドを使用する調製法も知られている。還元剤にはボランの他、カテコールボランも使用できる。カテコールボランはボランに比べると反応性が穏やかなため、副反応を抑えることができる。
オキサザボロリジンはケトンとボラン双方を活性化させることでこの反応を触媒する。ケトンはカルボニル酸素がルイス酸性を持つオキサザボロリジンのホウ素に配位して活性化され、一方還元剤のボランはルイス塩基性を持つオキサザボロリジンの窒素に配位して活性化される。反応のエナンチオ選択性はこのケトンの配位の際にかさ高い置換基がオキサザボロリジンのconcave面側にある方が立体反発が小さく、この状態で隣りの窒素上のボランが付加してくるというモデルで説明されている。
変法としてO-アルキルオキシムをこの方法で還元して光学活性アミンを合成する方法がある。また、オキサザボロリジンをポリマーに結合させて触媒の再利用を容易にした方法も開発されている。
反応機構
[編集]コーリーらは、触媒的還元反応によって得られる選択性を説明するため以下の反応機構を初め提唱した[1][2]。
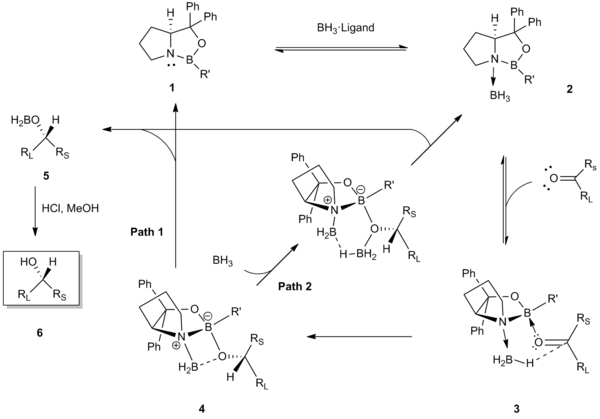
反応機構の最初の段階は、BH3のオキサボロリジンCBS触媒 1 の窒素原子への配位である。この配位によりBH3がヒドリド供与体として活性化され、触媒の環内のホウ素のルイス酸性が高まる[5]。触媒-ボラン配位錯体 2 のX線結晶構造解析および11B NMR分光分析は、この配位が開始段階であることを支持している[5][9]。次に、環内のホウ素原子が立体的に接近しやすいケトンの孤立電子対(すなわちより小さい置換基 Rs に近い方の孤立電子対)に配位する。3 におけるこの選択的結合は、ケトン(嵩高い置換基 RL)と触媒の R' 基との立体障害を最小化し、カルボニル基と配位ボランを、六員環遷移状態 4 を経て面選択的ヒドリド転移が起こるように整列させる[10][11]。ヒドリド転移によって対応するキラルボロンエノラート 5 が得られ、酸性ワークアップによりキラルアルコール 6 が得られる。触媒が再生する最終段階は、2つの異なる経路(Path 1 あるいは 2)で起こる[12][13][14]。
この面選択的、分子内ヒドリド転移の支配的な駆動力は、同時に起こるルイス塩基窒素原子への配位によるボラン試薬の活性化とケトンに配位するための触媒環内のホウ素原子のルイス酸性の増強である[5]。
範囲と限界
[編集]立体および化学選択性
[編集]CBS還元は、様々な種類のケトンを立体選択的、化学選択的に還元する効果的かつ強力な手法であることが証明されている。基質としては、様々なアリール-アリファティック、ジアリファティック、ジアリール、α,β-不飽和エノンおよびイノン系、ヘテロ原子を含むケトンが使用できる[5][15]。異なる種類のCBS触媒とボラン還元試薬の組み合わせが、エナンチオ選択性を最適化するために使用される。

ジアリルケトン 9 では、ケトン置換基の立体的性質が同等であるにもかかわらず比較的高い立体選択性が得られている。このことは、立体反発に加えて電気的性質がCBS還元の立体選択性において重要であることを示唆している[5]。イノン 11 および 12 のアルキン基における置換基の違いによって、選択性が逆転している。α,β不飽和系を有する 10-12では、想定される副反応であるC-C不飽和結合へのヒドロホウ素化が起こらず、ケトンの効率的還元が起こっている。またCBS還元は、ボランに配位することのできるヘテロ原子を含むケトン 13 でも適応可能であった。
実験的考察および限界
[編集]本反応系における水の存在は、エナンチオマー過剰率に著しい影響を与えることから、CBS還元は無水条件で行なわなければならない[16]。温度もまた立体選択性において非常に重要である。一般的に、低い温度でエナンチオマー過剰率 (ee) は得られる。しかしながら、昇温していくとエナンチオマー過剰率はある温度で最大値に逹する。これは使用する触媒構造とボラン還元試薬に依存する[17]。ボラン試薬のカテコールボランの使用は、低温で低下するエナンチオマー過剰率を改善する有力な解決策である[18][19]。カテコールボランを使用することで、−126 °Cまで下げた温度でCBS還元を行い優れたエナンチオ選択性が得られることが明らかにされている。
CBS還元における還元試薬にBH3を使用することと関連したエナンチオ選択性の問題について報告されている。Nettlesらは、市販のBH3•THFを評価し、ごく微量のボロヒドリド種(非選択的還元を起こしエナンチオ選択性を低下させる)が含まれていることを明らかにした[20]。ボロヒドリド種が触媒する還元経路はCBS触媒による還元よりもかなり遅いが、この副反応はまだ立体選択性を最適化できる余地があることを示している。
変法
[編集]コーリーによって開発されたCBS触媒 1 はCBS還元反応における一般的な触媒となっているが、その他の触媒派生物を用いた方法も開発され、うまく利用されている。CBS触媒のR' 基は還元のエナンチオ選択性に需要な役割を果たしており、上で図で示しているように、R' 基を変化させたCBS触媒が選択性を最適化するために用いられている[5][15]。
応用
[編集]過去数十年に渡って、CBS還元はラクトン、テルペノイド、アルカロイド、ステロイド、ビオチンを含む膨大な天然物合成において、顕著な合成的有用性を得てきた[5][6][21]。このエナンチオ選択的還元は工業的な大スケールでも用いられている。Jonesらは、MK-0417(眼圧の低下のために用いられる水溶性炭酸脱水酵素阻害剤)の全合成にCBS還元を利用した[16]。鍵二環性スルホン中間体の不斉還元は、R' 基としてメチル基を有するCBSオキサボロリジン触媒によって達成された。

脚注
[編集]- ^ a b c Corey, E. J.; Bakshi, R. K.; Shibata, S. (1987). “Highly enantioselective borane reduction of ketones catalyzed by chiral oxazaborolidines. Mechanism and synthetic implications”. J. Am. Chem. Soc. 109: 5551. doi:10.1021/ja00252a056.
- ^ a b c Corey, E. J.; Bakshi, R. K.; Shibata, S.; Chen, C. P.; Singh, V. K. (1987). “A stable and easily prepared catalyst for the enantioselective reduction of ketones. Applications to multistep syntheses”. J. Am. Chem. Soc. 109: 7925. doi:10.1021/ja00259a075.
- ^ a b Hirao, A.; Itsuno, S.; Nakahama, S.; Yamazaki, N. (1981). “Asymmetric reduction of aromatic ketones with chiral alkoxy-amineborane complexes”. J. Chem. Soc., Chem. Commun. 7: 315. doi:10.1039/C39810000315.
- ^ Deloux, L.; Srebnik, M. (1993). “Asymmetric boron-catalyzed reactions”. Chem. Rev. 93: 763. doi:10.1021/cr00018a007.
- ^ a b c d e f g h Corey, E. J.; Helal, C. J. (1998). “Reduction of Carbonyl Compounds with Chiral Oxazaborolidine Catalysts: A New Paradigm for Enantioselective Catalysis and a Powerful New Synthetic Method”. Angew. Chem. Int. Ed. 37: 1986. doi:10.1002/(sici)1521-3773(19980817)37:15<1986::aid-anie1986>3.0.co;2-z.
- ^ a b Cho, B. T. (2006). “Recent advances in the synthetic applications of the oxazaborolidine-mediated asymmetric reduction”. Tetrahedron 62: 7621. doi:10.1016/j.tet.2006.05.036.
- ^ Itsuno, S.; Hirao, A.; Nakahama, S.; Yamazaki, N. (1983). “Asymmetric synthesis using chirally modified borohydrides. Part 1. Enantioselective reduction of aromatic ketones with the reagent prepared from borane and (S)-valinol”. J. Chem. Soc., Perkin Trans. 1: 1673-1676. doi:10.1039/P19830001673.
- ^ Itsuno, S.; Ito, K.; Hirao, A.; Nakahama, S. (1983). “Asymmetric reduction of aromatic ketones with the reagent prepared from (S)-(–)-2-amino-3-methyl-1,1-diphenylbutan-1-ol and borane”. J. Chem. Soc., Chem. Commun. 8: 469-470. doi:10.1039/C39830000469.
- ^ Corey, E. J.; Azimioara, M.; Sarshar, S. (1992). “X-Ray crystal structure of a chiral oxazaborolidine catalyst for enantioselective carbonyl reduction”. Tetrahedron Lett. 33: 3429. doi:10.1016/s0040-4039(00)92654-6.
- ^ Evans, D. (1988). “Stereoselective organic reactions: catalysts for carbonyl addition processes”. Science 240: 420. doi:10.1126/science.3358127.
- ^ Jones, D. K.; Liotta, D. C.; Shinkai, I.; Mathre, D. J. (1993). “Origins of the enantioselectivity observed in oxazaborolidine-catalyzed reductions of ketones”. J. Org. Chem. 58: 799. doi:10.1021/jo00056a001.
- ^ Corey, E. J. (1990). “New enantioselective routes to biologically interesting compounds”. Pure Appl. Chem. 62: 1209. doi:10.1351/pac199062071209.
- ^ Nevalainen, V. (1994). “Quantum chemical modeling of chiral catalysis. Part 15. On the role of hydride-bridged borane - alkoxyborane complexes in the catalytic enantioselective reduction of ketones promoted by chiral oxazaborolidines”. Tetrahedron: Asymmetry 5: 289. doi:10.1016/s0957-4166(00)86186-8.
- ^ Quallich, G. J.; Blake, J. F.; Woodall, T. M. (1994). “A combined synthetic and ab initio study of chiral oxazaborolidines structure and enantioselectivity relationships”. J. Am. Chem. Soc. 116: 8516. doi:10.1021/ja00098a012.
- ^ a b Quallich, G. J.; Woodall, T. M. (1993). “Enantioselective oxazaborolidine reduction of ketones containing heteroatoms”. Tetrahedron Lett. 34: 785. doi:10.1016/0040-4039(93)89012-f.
- ^ a b Jones, T. K.; Mohan, J. J.; Xavier, L. C.; Blacklock, T. J.; Mathre, D. J.; Sohar, P.; Jones, E. T. T.; Reamer, R. A.; Roberts, F. E.; Grabowski, E. J. J. (1991), “An asymmetric synthesis of MK-0417. Observations on oxazaborolidine-catalyzed reductions”, J. Org. Chem. 56: 763, doi:10.1021/jo00002a050
- ^ Bulliard, Michael (1999). “Chapter 11.1: Asymmtric Reduction of Prochiral Ketones Catalyzed by Oxazaborolidines”. In Ager, David. Handbook of Chiral Chemicals. Marcel Decker. pp. 211–225. ISBN 0824710584
- ^ Corey, E. J.; Link, J. O. (1989), “A new chiral catalyst for the enantioselective synthesis of secondary alcohols and deuterated primary alcohols by carbonyl reduction”, Tetrahedron Lett. 30: 6275, doi:10.1016/s0040-4039(01)93871-7
- ^ Corey, E. J.; Bakshi, R. K. (1990), “A new system for catalytic enantioselective reduction of achiral ketones to chiral alcohols. Synthesis of chiral α-hydroxy acids”, Tetrahedron Lett. 31: 611, doi:10.1016/s0040-4039(00)94581-7
- ^ Nettles, S. M.; Matos, K.; Burkhardt, E. R.; Rouda, D. R.; Corella, J. A. (2002), “Role of NaBH4 Stabilizer in the Oxazaborolidine-Catalyzed Asymmetric Reduction of Ketones with BH3-THF”, J. Org. Chem. 67: 2970, doi:10.1021/jo016257c
- ^ Stemmler, R. T. (2007), “CBS Oxazaborolidines - Versatile Catalysts for Asymmetric Synthesis”, Synlett 6: 997, doi:10.1055/s-2007-973876
