L-リブロース-5-リン酸-4-エピメラーゼ
| L-リブロース-5-リン酸-4-エピメラーゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| EC番号 | 5.1.3.4 | ||||||||
| CAS登録番号 | 9024-19-5 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
L-リブロース-5-リン酸-4-エピメラーゼ (L-ribulose-5-phosphate 4-epimerase、EC 5.1.3.4) は、ペントースリン酸経路において、以下の反応を触媒する酵素である[1]。
L-リブロース-5-リン酸-4-エピメラーゼの分子量は102 kDaで、4つの相同な25.5 kDaのサブユニットで構成されていると考えられている。異性化酵素、特に炭水化物及びその類縁体に作用するラセマーゼ、エピメラーゼに分類される[2]。系統名は、L-リブロース-5-リン酸 4-エピメラーゼである。その他、phosphoribulose isomerase、ribulose phosphate 4-epimerase、L-ribulose-phosphate 4-epimerase、L-ribulose 5-phosphate 4-epimerase、AraD及びL-Ru5P等とも呼ばれる。この酵素は、ペントースとグルクロン酸の相互変換、またアスコルビン酸を経由したアルダル酸の代謝に関与している。
機構
[編集]

L-リブロース-5-リン酸-4-エピメラーゼは逆アルドール反応とアルドール反応によって、L-リブロース-5-リン酸をエピマー化してD-キシルロース-5-リン酸に変換する。提案されている機構は、C-4位のヒドロキシル基からプロトンを引き抜き、その後C-3位とC-4位の間の結合を切断して、亜鉛によって安定化されたエンジオラート中間体とグリコールアルデヒドリン酸の断片が生じるというものである。その後、グリコールアルデヒドリン酸のC-C結合が180°回転してC-3位とC-4位の間のC-C結合が再生されることで、C-4位の立体化学が反転する[3]。
上記の反応機構は、配列の高度な類似性を示すL-フクロース-リン酸アルドラーゼにより触媒される反応と逆アルドール切断機構が類似していることや[2]、13Cと重水素を用いた速度論的同位体効果の分析[3]から支持される。C-3位とC-4位に重水素同位体効果による差はほとんど現れないと報告されており、これらのC-H結合はエピマー化の際に壊れていないことが示唆される。同時に、かなり大きな13Cの同位体効果が現れ、アルドール機構で予想されるような律速となるC-C結合の開裂があることが示唆される[3]。この機構以外のスキームとして脱水反応によるものが考えられているが、脱水機構の場合はC-H結合の開裂が律速段階となり、C-3位を水素から重水素へ置換することでその速度がかなり変化する(同位体効果が変化する)はずである[3]。
構造
[編集]-
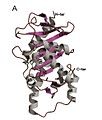
L-Ru5Pの四量体構造
-
L-Ru5Pのモノマー
-
L-Ru5Pの活性部位
構造はホモ四量体で、C4対称性を示す[4]。各サブユニットは、βシートとαヘリックスから構成された1つのタンパク質ドメインからなる。βシートは9つのβストランド (b1-b9) からできており、b7とb8の間以外は逆平行である。8つのαヘリックスは2つの層を形成し、中央のβシートを両側から挟んでいる。活性部位は2つの隣接サブユニットの間に位置しており、Asp76、His95、His97、His171が亜鉛結合残基である。この構造はL-フクロース-リン酸アルドラーゼに非常に似ている[2]。これは、両酵素が金属によって安定化されたエノラート中間体を介してC-C結合の切断反応を触媒する、エピメラーゼ/アルドラーゼのスーパーファミリーに属していることと合致する。
生物学的機能
[編集]本酵素は、よく研究されたL-アラビノースオペロンに位置する。このオペロンはaraAからaraHの8つの遺伝子から構成され、本酵素の遺伝子はaraDと呼ばれる。このアラビノースシステムにより、ペントースであるL-アラビノースの取り込みが可能となり、araB、araA、araDの3つの遺伝子の産物による3段階の反応で、取り込まれたアラビノースがD-キシルロース-5-リン酸に変換される[5]。
| 遺伝子 | タンパク質の機能 |
|---|---|
| araA | イソメラーゼ |
| araB | リブロキナーゼ |
| araC | 発現制御 |
| araD | エピメラーゼ |
| araE | 取り込み |
| araF | 取り込み |
| araG | 取り込み |
| araH | 取り込み |
進化
[編集]L-リブロース-5-リン酸-4-エピメラーゼとL-フクロース-リン酸アルドラーゼは進化的に関係のある酵素で、配列の26%が同一であり、構造の類似性も非常に高い[2]。どちらも触媒作用中のエノラートの安定のために2価カチオンを用い、またどちらもホスホケトースのC-4位のヒドロキシル基を脱プロトン化することができる。これらの多くの類似性にもかかわらず、微細な違いが存在するため、触媒する反応は異なったものとなる[6]。
出典
[編集]- ^ Englesberg, E.; R.L. Anderson, R. Weinberg (29 January 1962). “L-Arabinose-Sensitive, L-Ribulose 5-phosphate 4-Epimerase-Deficient Mutants of Escherichia coli”. Journal of Bacteriology 84 (137) 17 May 2011閲覧。.
- ^ a b c d Yu, Luo; Jomy Samuel; Steven C Mosimann; Jeffrey E Lee; Martin E Tanner; Natalie CJ Strynadka (2001). “The Structure of Ribulose-5-Phosphate 4-Epimerase: An Aldolase-like Platform for Epimerization”. Biochemistry (40): 14763-14771. doi:10.1021/bi0112513. PMID 11732895 16 May 2011閲覧。.
- ^ a b c d Lee LV, Vu MV, Cleland WW (April 2000). “13C and deuterium isotope effects suggest an aldol cleavage mechanism for L-ribulose-5-phosphate 4-epimerase”. Biochemistry 39 (16): 4808-20. doi:10.1021/bi992894+. PMID 10769138.
- ^ Andersson, Arnold; Gunter Schneider (15 May 1995). “Purification and preliminary X-ray crystallographic studies of recombinant ~-ribulose-5-phosphate 4-epimerase from Escherichia coli”. Protein Science 4 (12): 1648-1650. doi:10.1002/pro.5560040823. PMC 2143197. PMID 8520491.
- ^ Schleif, R. (2000-12). “Regulation of the L-arabinose operon of Escherichia coli”. Trends in genetics: TIG 16 (12): 559–565. doi:10.1016/s0168-9525(00)02153-3. ISSN 0168-9525. PMID 11102706.
- ^ Samuel, Jomy; Yu Luo; Paul M Morgan; Natalie CJ Strynadka; Martin E Tanner (9 November 2001). “Catalysis and binding in L-Ribulose 5-Phosphate 4-Epimerase: A Comparison with L-Fuculose Phosphate Aldolase”. Biochemistry 40 (49): 14772-14780. doi:10.1021/bi011252v. PMID 11732896 17 May 2011閲覧。.
関連文献
[編集]- BURMA DP, HORECKER BL (1958). “Pentose Fermentation by Lactobacillus Plantarum: IV. L-Ribulose-5-phosphate 4-Epimerase”. J. Biol. Chem. 231 (2): 1053–64. PMID 13539036.
- Deupree JD; Wood WA (1970). “L-Ribulose 5-phosphate 4-epimerase of Aerobacter aerogenes. Evidence for nicotinamide adenine dinucleotide-independent 4-epimerization by the crystalline enzyme”. J. Biol. Chem. 245 (15): 3988–95. PMID 4395381.
- Lee N, Patrick JW, Masson M (1968). “Crystalline L-ribulose 5-phosphate 4-epimerase from Escherichia coli”. J. Biol. Chem. 243 (18): 4700–5. PMID 4879898.
- WOLIN MJ, SIMPSON FJ, WOOD WA (1958). “Degradation of L-arabinose by Aerobacter aerogenes. III Identification and properties of L-ribulose-5-phosphate 4-epimerase”. J. Biol. Chem. 232 (1): 559–75. PMID 13549442.