Mad2
| Mitotic spindle checkpoint component Mad2 | |||||||
|---|---|---|---|---|---|---|---|
| 識別子 | |||||||
| 由来生物 | |||||||
| 3文字略号 | Mad2 | ||||||
| 代替略号 | YJL030W | ||||||
| Entrez | 853422 | ||||||
| RefSeq (mRNA) | NM_001181464 | ||||||
| RefSeq (Prot) | NP_012504 | ||||||
| UniProt | P40958 | ||||||
| 他データ | |||||||
| 染色体 | X: 0.39 - 0.39 Mb | ||||||
| |||||||
Mad2(mitotic arrest deficient 2)は、紡錘体チェックポイントに必要不可欠なタンパク質である。紡錘体チェックポイントは、細胞周期の中期から後期への移行を制限する調節システムである。 Mad2の遺伝子は出芽酵母Saccharomyces cerevisiaeにおいて、変異によって微小管毒に対する感受性が出現する遺伝子のスクリーニングから最初に同定された[1]。Mad2のヒトオルソログ(MAD2L1とMAD2L2)は、キネトコア結合タンパク質を喪失した酵母株の微小管毒感受性をレスキューするヒトcDNAの探索からクローニングされた[2]。Mad2タンパク質は未接着のキネトコアに存在することが示されており、微小管毒ノコダゾールに応答して中期から後期への移行を防止するために必要不可欠であることが抗体を用いた阻害研究から明らかにされている[2]。その後ヒト配列との共通性からアフリカツメガエルXenopus laevisのオルソログがクローニングされ、卵抽出液を用いてチェックポイントの特徴付けを行うことが可能となった[3]。
中期から後期への移行
[編集]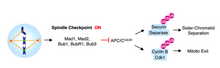
中期から後期への進行は、姉妹染色分体の分離によって特徴づけられる。姉妹染色分体の分離と後期への移行を防ぐ細胞周期監視機構は紡錘体チェックポイント(SAC)と呼ばれる。紡錘体チェックポイントは染色体分離のエラーに対する安全装置として機能し、すべての姉妹染色分体が二方向型(bi-oriented)配置となるまで後期への移行を遅らせる。
微小管がキネトコアに接着すると染色体は中期板(metaphase plate)に整列し、適切な二方向型配置が達成されるとSACは不活性化される。後期への移行はAPCCdc20の活性化によって媒介される。APCCdc20はユビキチンリガーゼであり、セキュリンに分解のためのタグをつける。セキュリンの分解によって、セキュリンに結合しているプロテアーゼであるセパラーゼが解放されて活性化される。セキュリンに結合したセパラーゼは阻害状態であるが、この阻害が解除されると、活性化されたセパラーゼは姉妹染色分体を結び付けているコヒーシン複合体を切断する[5]。
Cdc20が存在しない場合、APCは活性化されず、後期は開始されない。Mad2はAPC、Cdc20と三者複合体を形成し、直接的な物理的相互作用によってAPCの活性を阻害することが示されている[6][7]。微小管に接着していないキネトコアはMad2によるCdc20の隔離を触媒する。中期の哺乳類細胞を紡錘体脱重合剤であるノコダゾールで処理すると、Mad2は全ての姉妹染色分体のキネトコアに局在するようになる[5]。
Mad2のコンフォマー
[編集]![[4]](http://upload.wikimedia.org/wikipedia/commons/0/0b/Mad2conformers.png)
Mad2は多量体形成が可能であり、少なくとも2つのコンフォメーションをとる。開いたコンフォメーション(O-Mad2)と閉じたコンフォメーション(C-Mad2)が存在し、両者はC末端の50残基の配置が異なる。この領域は安全ベルト(safety belt)またはシートベルト(seat belt)などと呼ばれ、C-Mad2では結合したリガンドを巻くように相互作用する。Mad2の結合パートナーにはCdc20やMad1があるが、Cdc20とMad1はMad2の同じ部位に対して同じように結合するため、一度に結合できるのはいずれか1つのみである[5]。
紡錘体チェックポイントにおけるMad2の活性化
[編集]
未接着のキネトコアによってSACが確立されて維持されると、こうした正しく配置されていない姉妹染色分体の分離を防ぐためにMad2がキネトコアへリクルートされる。Mad2はMad1を結合し、C-Mad2/Mad1複合体を形成する。C-Mad2/Mad1は安定な複合体であり、またCdc20とMad1はMad2の同じ部位に結合するため、C-Mad2がMad1を放出してCdc20と複合体を形成することはかなり起こりにくい。
Mad2とCdc20の複合体形成のモデルでは、まずC-Mad2/Mad1複合体が最初に形成される。そして、細胞質の遊離O-Mad2がC-Mad2/Mad1の鋳型へリクルートされる。このC-Mad2/Mad1との相互作用によってO-Mad2はC-Mad2へのコンフォメーション変化が可能となり、Cdc20と相互作用できるようになると考えられている。その後C-Mad2/Cdc20複合体は遊離し、C-Mad2/Mad1の鋳型には再び遊離O-Mad2が結合する[8]。
このモデルでは、C-Mad2/Cdc20複合体が形成されると細胞質の遊離O-Mad2とCdc20のC-Mad2/Cdc20複合体への変換が促進され、それによって後期に入るをの待てというシグナルが増幅されると考えられている。このシグナルはキネトコア複合体から拡散して伝播していくため、未接着のキネトコア1つであっても中期から後期への移行を完全に停止させることができる[9]。
展望
[編集]紡錘体チェックポイントシグナル伝達やBub1、BubR1、Bub3などの他の紡錘体チェックポイントタンパク質の寄与については、多くのことが未解明である。BubR1やBub3はCdc20と複合体を形成することができるが、これらのタンパク質がO-Mad2へのCdc20の結合を促進するかどうかは不明である[9]。
また、p31cometがどのようにチェックポイントに拮抗し、C-Mad2/Cdc20の解離を促進するかに関しても多くが不明である。De AntoniらはMad2鋳型モデルに関連して、p31cometはO-Mad2と競合してC-Mad2/Mad1に結合することを示唆している。p31cometがどのようにして紡錘体チェックポイントを不活性化しているのかについての研究が行われている[10]。
出典
[編集]- ^ “Feedback control of mitosis in budding yeast”. Cell 66 (3): 519–31. (1991). doi:10.1016/0092-8674(81)90015-5. PMID 1651172.
- ^ a b “Identification of a human mitotic checkpoint gene: hsMAD2”. Science 274 (5285): 246–8. (1996). doi:10.1126/science.274.5285.246. PMID 8824189.
- ^ “Association of spindle assembly checkpoint component XMAD2 with unattached kinetochores”. Science 274 (5285): 242–6. (October 1996). doi:10.1126/science.274.5285.242. PMID 8824188.
- ^ a b “Structural activation of Mad2 in the mitotic spindle checkpoint: the two-state Mad2 model versus the Mad2 template model”. J. Cell Biol. 173 (2): 153–7. (April 2006). doi:10.1083/jcb.200601172. PMC 2063805. PMID 16636141.
- ^ a b c Morgan DL (2007). The cell cycle: principles of control. London: Published by New Science Press in association with Oxford University Press. ISBN 0-87893-508-8
- ^ “MAD2 associates with the cyclosome/anaphase-promoting complex and inhibits its activity”. Proc. Natl. Acad. Sci. U.S.A. 94 (23): 12431–6. (November 1997). doi:10.1073/pnas.94.23.12431. PMC 24983. PMID 9356466.
- ^ “Mad2 transiently associates with an APC/p55Cdc complex during mitosis”. Proc. Natl. Acad. Sci. U.S.A. 95 (19): 11193–8. (September 1998). doi:10.1073/pnas.95.19.11193. PMC 21618. PMID 9736712.
- ^ “Checkpoint signalling: Mad2 conformers and signal propagation”. Curr. Biol. 15 (4): R122–4. (February 2005). doi:10.1016/j.cub.2005.02.008. PMID 15723780.
- ^ a b “How do so few control so many?”. Cell 120 (6): 739–46. (March 2005). doi:10.1016/j.cell.2005.03.006. PMID 15797376.
- ^ “The Mad1/Mad2 complex as a template for Mad2 activation in the spindle assembly checkpoint”. Curr. Biol. 15 (3): 214–25. (February 2005). doi:10.1016/j.cub.2005.01.038. PMID 15694304.
