アゴスティック相互作用
アゴスティック相互作用(あごすてぃっくそうごさよう、英;agostic interaction)は、有機金属化学の専門用語であり、中心遷移金属とその配位子中のC-H結合における三中心二電子結合を意味する。酸化的付加、還元的脱離などの多くの触媒反応が、アゴスティクス相互作用を特徴とする中間体を介して進行すると提案されている。アルキル配位子、アルキリデン配位子およびポリエニル配位子を有する有機金属化合物でアゴスティック相互作用が観察される。
歴史
[編集]「アゴスティック」という用語は、「自分に近づく」という古代ギリシャ語に由来し、古典学の ジャスパーグリフィンの提案に基づいて、 モーリスブルックハートとマルコムグリーンが 造語した。通常、アゴスティクス相互作用は、遷移金属原子の近くにあるアルキル基またはアリール基の炭素水素シグマ結合が関与する。 [1] [2]
炭化水素置換基と配位不飽和金属錯体との相互作用は、1960年代以来注目されてきた。たとえば、二塩化トリス( トリフェニルホスフィン )ルテニウムでは、 ルテニウム (II)の金属中心とフェニル環のオルト位にある1つの水素原子との間に相互作用が観察される [3] 。水素化ホウ素錯体は、 3中心2電子結合モデルとして説明される。
アゴスティック結合の特性
[編集]アゴスティック相互作用の存在は結晶構造解析、特に中性子結晶構造解析によって明瞭に示される。X線結晶構造解析では通常、水素原子の位置を正確に特定できない。中性子回折データは、アゴスティック相互作用に関わるC-H結合距離およびM┄H結合距離が、金属水素化物および炭化水素で予想される距離よりも5〜20%長いことを示す。アゴスティック結合では、金属と水素の間の距離は通常1.8〜2.3 Åであり、M┄H−Cの角度は90°から140°の範囲である。1 H-NMRスペクトロスコピーでは、 アゴスティック水素は通常のアリールまたはアルカンと比べてアップフィールド領域にシフトする。 アゴスティック水素の結合定数1 J CHはsp 3炭素-水素結合から予想される125Hzから通常70〜100Hzに低下する。
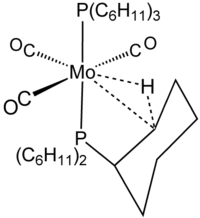
2電子3中心結合の例示として、[Mo(CO)3 (PCy3)2]のシクロヘキシル基を示す[4]。

関連する結合相互作用
[編集]
アゴスティックという用語は、炭素、水素および金属間の2電子3中心結合相互作用を表現するために用いられる。トリフェニルシランが金属中心に結合するとき、アゴスティック相互作用のような3中心SiーH−M相互作用を示す。しかしながら、この相互作用には炭素が含まれていないため、アゴスティックに分類されない。
機能
[編集]アゴスティック相互作用は、 アルケン重合、立体化学などで重要な機能を果たす。
参考文献
[編集]- ^ Brookhart, Maurice; Green, Malcolm L. H. (1983). “Carbon-hydrogen-transition metal bonds”. J. Organomet. Chem. 250: 395–408. doi:10.1016/0022-328X(83)85065-7.
- ^ Brookhart, Maurice; Green, Malcolm L. H.; Parkin, Gerard (2007). “Agostic interactions in transition metal compounds”. Proc. Natl. Acad. Sci. 104 (17): 6908–14. Bibcode: 2007PNAS..104.6908B. doi:10.1073/pnas.0610747104. PMC 1855361. PMID 17442749.

- ^ La Placa, Sam J.; Ibers, James A.. “A Five-Coordinated d6 Complex: Structure of Dichlorotris(triphenylphosphine)ruthenium(II)”. Inorg. Chem.. doi:10.1021/ic50028a002.
- ^ Kubas, G. J. (2001). Metal Dihydrogen and σ-Bond Complexes. New York: Kluwer Academic. ISBN 978-0-306-46465-2
- ^ Z. Dawoodi; M. L. H. Green; V. S. B. Mtetwa; K. Prout; A. J. Schultz; J. M. Williams; T. F. Koetzle (1986). “Evidence for Carbon–Hydrogen–Titanium Interactions: Synthesis and Crystal Structures of the Agostic alkyls [TiCl3(Me2PCH2CH2PMe2)R (R = Et or Me)”]. J. Chem. Soc., Dalton Trans.: 1629. doi:10.1039/dt9860001629.
- ^ Nikonov, G. I. (2005). “Recent Advances in Nonclassical Interligand SiH Interactions”. Adv. Organomet. Chem. 53: 217–309. doi:10.1016/s0065-3055(05)53006-5. ISBN 9780120311538.
