σビスホモ芳香族性
この項目「Σビスホモ芳香族性」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:de:σ-Bishomoaromatizität) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2016年10月) |


σビスホモ芳香族性 (シグマビスホモほうこうぞくせい、英: σ-Bishomoaromaticity, 独: σ-Bishomoaromatizität) とは、化学結合と芳香族性の極端な一例である。プリンツバッハらにより、ドデカヘドラン合成のパゴダン経路における骨格から初めて特定された[1][2][3]。σビスホモ芳香族性により、平面上の原子にわたって環状に電子軌道が非局在化する。ただし、ベンゼンのようなπ共役系とは異なり、平面に垂直方向に並ぶのではなく、結合骨格に沿って2つに分かれるように非局在化する。どちら側にも durch den Raum („through space“) [訳語疑問点]共役が起こっていることが要件である。
背景 I: 「古典的」芳香族性と σ芳香族性
[編集]有機化学において、芳香族性[4]という現象は基礎的な意味を持つ。典型的な例として、4n+2-π電子(ヒュッケル則)環状共役系を持つベンゼンは、明らかな安定化と特異な反応性を示す。安定性向上の他にも、電子の環状非局在化とそれに起因するNMR測定により観測可能な反磁性環電流、さらには共役環に沿った結合長の同一化も起こる(ベンゼンにおける C-C 結合は仮説上のシクロヘキサトリエンにおける C-C 単結合と C=C 二重結合の中間となる)。
π共役系ではなく、同一平面上に存在するσ結合の相互作用による芳香族性を、σ芳香族性と呼ぶ。σ芳香族性は厳しい境界条件に縛られており、 シクロプロパンに例を見ることができる。シクロプロパンの磁性は反磁性環電流の存在を示しており、またシクロブタンと同等程度の歪みエネルギー (120.17 kJ/mol vs. 111.79 kJ/mol) は、強い CH-結合の効果(全部で 33.5 kJ/mol)に加えてσ芳香族性による 47.3 kJ/mol の安定化[5]と固有結合エネルギーに帰せられる。
背景 II: ホモ芳香族性
[編集]古典的な芳香族では芳香族性は、σ結合により形作られる連続した環上のπ電子系における電子の環状非局在化に起因する。このσ環がある点で切れても、適切な幅と向きとが伴えば関連するπ軌道の相互作用がなお存在する場合がある。この様な例を „durch den Raum“/„through space“[訳語疑問点]起こるホモ共役と呼び、これが起こるのに適した系はホモ芳香族性を示す。典型的な例として、ホモトロピリウムカチオンやシクロヘプタトリエンが挙げられる[6]。
σビスホモ芳香族性の例
[編集]適切な条件(剛直なかご型系による厳密な配向)のもとで、2つのC-C二重結合がσ型の重なりを持ち、π軌道がσ平面内で閉じた環を形成し、環状電子非局在化が起こることがある。ここに付随する軌道には図に示したようなものがあり、b1およびb2軌道のエネルギー準位と順序は2つの二重結合の距離に依存する。

このような2つの二重結合の配位が実現する化合物として、ビスセコドデカヘドラジエン(下図右)が挙げられる[7]。

σビスホモ共役軌道系を2つの電子が占有するとき(中性化学種の酸化により、最低エネルギーとなるa1軌道のみが占有されるようにする)、σビスホモ芳香族性に起因する驚くべき安定性を持つ四中心二電子 (4c-2e) ジカチオンが得られる。σ型に重なるC-C二重結合を持つ中性の前駆体の代わりに、中心にシクロブタン環を持つパゴダンを使うこともできる(上図左)。同じ中性化学種をジアニオンへと還元して得られる四中心六電子σビスホモ芳香族は学術的に興味深い(ヒュッケル則)が、いまのところ炭素間結合による生成に成功していない。最初に成功したのは C-C二重結合の代わりにN-N二重結合を用いてである(ビスジアゼン、図参照)[8][9][10]。
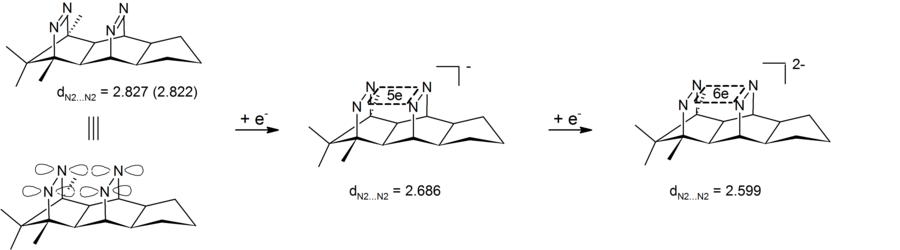
剛性の高い物質を適切に選べば、2電子還元により驚くべき安定性を持つジアニオンを得ることができる。このジアニオンにおいては6電子が環状に平面内に非局在化している(四中心六電子ジアニオン、4N/6e)。ビスジアゼンをビスジアゼンテトロキシドへと酸化した場合、やはり特異的に安定なジカチオンに驚くほど容易に酸化することができる。このジカチオンが2電子 σビスホモ芳香族 (4N/2e) として説明されるのか4O4N/10e系における立方体状非局在化として説明されるのかは未だ明らかでない[11]。
出典
[編集]- ^ Prakash, G. K.; Krishnamurthy, V. V.; Herges, Rainer.; Bau, Robert.; Yuan, Hanna.; Olah, George A.; Fessner, Wolf Dieter.; Prinzbach, Horst. (1986). “Stable carbocations. Part 267. Pagodane dication, a unique 2.pi.-aromatic cyclobutanoid system”. Journal of the American Chemical Society 108 (4): 836–838. doi:10.1021/ja00264a046.
- ^ Prakash, G. K. Surya.; Krishnamurthy, V. V.; Herges, Rainer.; Bau, Robert.; Yuan, Hanna.; Olah, George A.; Fessner, Wolf Dieter.; Prinzbach, Horst. (1988). “Stable carbocations. 273. [1.1.1.1- and [2.2.1.1]Pagodane dications: frozen two-electron Woodward-Hoffmann transition-state models”]. Journal of the American Chemical Society 110 (23): 7764–7772. doi:10.1021/ja00231a029.
- ^ Herges, Rainer; Schleyer, Paul v. R.; Schindler, Michael; Fessner, Wolf Dieter (1991). “Tetramethylene dications (CH2)2+
4: are the norbornadiene dication, the pagodane dication, and related systems aromatic?”. Journal of the American Chemical Society 113 (10): 3649–3656. doi:10.1021/ja00010a003. - ^ Schleyer, Paul von Rague; Jiao, Haijun (1996). “What is Aromtaticity?”. Pure & Applied Chemistry 68 (2): 209–218. doi:10.1351/pac199668020209.
- ^ Exner, Kai; Schleyer, Paul von Ragué (2001). “Theoretical Bond Energies: A Critical Evaluation”. The Journal of Physical Chemistry A 105 (13): 3407–3416. doi:10.1021/jp004193o.および参照文献
- ^ Williams, Richard Vaughan; Edwards, W. Daniel; Zhang, Pengrong; Berg, David J.; Mitchell, Reginald H. (2012). “Experimental Verification of the Homoaromaticity of 1,3,5-Cycloheptatriene and Evaluation of the Aromaticity of Tropone and the Tropylium Cation by Use of the Dimethyldihydropyrene Probe”. Journal of the American Chemical Society 134 (40): 16742–16752. doi:10.1021/ja306868r.
- ^ Prinzbach, H.; Gescheidt, G.; Martin, H.-D.; Herges, R.; Heinze, J.; Prakash, G. K. Surya; Olar, G. A. (1995). “Cyclic electron delocalization in hydrocarbon cages: Pagodanes, isopagodanes, (bisseco/seco-)dodecahedradienes”. Pure & Applied Chemistry 67 (5): 673-682. doi:10.1351/pac199567050673.
- ^ Exner, K. (1998). Hochgradig nahgeordnete Bisdiazene und ihre Oxide. Synthese, Photochemie, (Radikal)Kationen, (Radikal)Anionen, Template für Aza-Käfige (Thesis). Universität Freiburg. doi:10.6094/UNIFR/1。
- ^ Exner, Kai; Hunkler, Dieter; Gescheidt, Georg; Prinzbach, Horst (1998). <1910::AID-ANIE1910>3.0.CO;2-D “Do Nonclassical, Cyclically Delocalized 4N/5e Radical Anions and 4N/6e Dianions Exist?—One- and Two-Electron Reduction of Proximate, Synperiplanar Bis-Diazenes”. Angewandte Chemie International Edition 37 (13-14): 1910–1913. doi:10.1002/(SICI)1521-3773(19980803)37:13/14<1910::AID-ANIE1910>3.0.CO;2-D. ISSN 1521-3773.
- ^ Exner, Kai; Cullmann, Oliver; Vögtle, Markus; Prinzbach, Horst; Grossmann, Birgit; Heinze, Jürgen; Liesum, Lorenz; Bachmann, Rainer et al. (2000). “Cyclic In-Plane Electron Delocalization (σ-Bishomoaromaticity) in 4N/5e Radical Anions and 4N/6e DianionsGeneration, Structures, Properties, Ion-Pairing, and Calculations”. Journal of the American Chemical Society 122 (43): 10650–10660. doi:10.1021/ja0014943.
- ^ Exner, Kai; Prinzbach, Horst; Gescheidt, Georg; Grossmann, Birgit; Heinze, Jürgen (1999). “Nonclassical, Cyclically Delocalized 4N/3e Radical Cations and 4N/2e Dications: One- and Two-Electron Oxidation of Proximate, syn-Periplanar Bisdiazene-Oxides”. Journal of the American Chemical Society 121 (9): 1964–1965. doi:10.1021/ja9837607.
