カルネキシン
カルネキシン(英: calnexin)は、小胞体に位置する67 kDa[5]の膜タンパク質である(ウエスタンブロッティングでは90 kDa、80 kDa、もしくは75 kDaなどさまざまな位置にみられる)。ヒトでは、CANX遺伝子にコードされる。N末端のカルシウム結合ドメイン(小胞体内腔側)、1本の膜貫通ヘリックス、そして短い(90残基)酸性の細胞質テールから構成される[6]。
機能
[編集]カルネキシンはシャペロンとしてタンパク質のフォールディングや品質管理を補助し、適切にフォールディングし組み立てられたタンパク質のみが分泌経路をさらに進行するよう保証している。具体的には、フォールディングしていない、もしくは組み立てられていないN-結合型糖タンパク質を小胞体内に保持する作用を果たす[7]。
カルネキシンは、GlcNAc2Man9Glc1型のオリゴ糖を持つN-結合型糖タンパク質のみに結合する[8]。こうしたモノグルコシル化オリゴ糖は2種類のグルコシダーゼ、IとIIの作用によって形成され、N-結合型糖に当初3つ存在していたグルコース残基のうちの2つが逐次的にトリミングされることで生じる。グルコシダーゼIIは3番目すなわち最後のグルコース残基を除去することもできるが、糖タンパク質が適切にフォールディングしていない場合には、UGGT(UDP-グルコース:糖タンパク質グルコシルトランスフェラーゼ)と呼ばれる酵素によってグルコース残基がオリゴ糖に再付加され、カルネキシンに対する結合能力が再付与される[9]。このようにして不適切なフォールディング状態の糖タンパク質は小胞体にとどまり、適切なフォールディングを行えなかったミスフォールド糖タンパク質は最終的にEDEM/Htm1p[10][11][12]によって9つのマンノース残基のうちの1つが除去されることで分解が決定される。そして、マンノースレクチンYos-9(ヒトではOS-9)がミスフォールドタンパク質を分解のために選別する。Yos-9はα-マンノシダーゼによってミスフォールドタンパク質の外側のマンノースが除去されることで露出したマンノース残基を認識する[13]。
カルネキシンはタンパク質フォールディング酵素ERp57[14]と結合し、糖タンパク質特異的なジスルフィド結合の形成を触媒するとともに、小胞体膜におけるMHCクラスI分子α鎖のフォールディングのシャペロンとしても機能する。新たに合成されたMHCクラスI分子α鎖が小胞体膜へ移行すると、カルネキシンが結合して部分的にフォールディングした状態に保持する[15]。β2-ミクログロブリンがペプチドローディング複合体(PLC)に結合した後、カルネキシンはMHCクラスI分子に対するシャペロン作業をカルレティキュリンとERp57に引き継ぎ、そしてタパシンがPLCと抗原処理関連トランスポーター(TAP)とを関連付ける。この結合によって、MHCクラスI分子が細胞表面に提示する抗原を結合する準備が整ったこととなる。
カルネキシンと変異型PMP22ミスフォールドタンパク質との長期の結合はシャルコー・マリー・トゥース病の原因となることが知られており[16]、PMP22が隔離・分解されることで髄鞘形成のためにシュワン細胞表面への輸送を行うことができなくなる。カルネキシンへの結合が何度か繰り返された後、変異型PMP22はプロテアソームによる分解のためのユビキチン修飾がなされるとともに、ゴルジ体へ逃れたミスフォールドPMP22タンパク質も小胞体への逆送経路によって送り返される[17]。
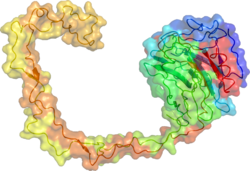
X線結晶構造解析によって、カルネキシンの球状のレクチンドメインと突出した長い疎水的アームの構造が明らかにされている[18]。
補因子
[編集]ATPとカルシウムイオンはカルネキシンの基質結合に関与する補因子である[19]。
出典
[編集]- ^ a b c GRCh38: Ensembl release 89: ENSG00000283777、ENSG00000127022 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000020368 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “UniProt”. www.uniprot.org. 2023年1月29日閲覧。
- ^ “SSR alpha and associated calnexin are major calcium binding proteins of the endoplasmic reticulum membrane”. J Biol Chem 226 (29): 19599–610. (1991). doi:10.1016/S0021-9258(18)55036-5. PMID 1918067.
- ^ “Association of folding intermediates of glycoproteins”. Nature 364 (644): 771–6. (1993). doi:10.1038/364771a0. PMID 8102790.
- ^ “Role of N-linked oligosaccharide recognition, glucose trimming, and calnexin in glycoprotein folding and quality control”. Proc Natl Acad Sci USA 91 (3): 913–7. (1984). doi:10.1073/pnas.91.3.913. PMC 521423. PMID 8302866.
- ^ “A major proportion of N-glycoproteins are transiently glucosylated in the endoplasmic reticulum”. Biochemistry 30 (12): 3098–104. (1991). doi:10.1021/bi00226a017. PMID 1826090.
- ^ “Htm1p, a mannosidase-like protein, is involved in glycoprotein degradation in yeast”. EMBO Rep 2 (5): 423–30. (2001). doi:10.1093/embo-reports/kve089. PMC 1083883. PMID 11375935.
- ^ “A novel ER alpha-mannosidase-like protein accelerates ER-associated degradation”. EMBO Rep 2 (5): 415–2. (2001). doi:10.1093/embo-reports/kve084. PMC 1083879. PMID 11375934.
- ^ “XBP-1 regulates a subset of endoplasmic reticulum chaperone genes in the unfolded protein response”. Mol Cell Biol 23 (21): 5448–59. (2003). doi:10.1128/mcb.23.21.7448-7459.2003. PMC 207643. PMID 14559994.
- ^ “Defining the glycan destruction signal for endoplasmic reticulum-associated degradation”. Mol Cell 32 (6): 870–7. (2008). doi:10.1016/j.molcel.2008.11.017. PMC 2873636. PMID 19111666.
- ^ “Enhanced catalysis of ribonuclease B folding by the interaction of calnexin or calreticulin with ERp57”. J Biol Chem 273 (211): 6009–12. (1998). doi:10.1074/jbc.273.11.6009. PMID 9497314.
- ^ “Calnexin: a membrane-bound chaperone of the endoplasmic reticulum”. Trends Biochem Sci 19 (3): 124–8. (1994). doi:10.1016/0968-0004(94)90205-4. PMID 8203019.
- ^ “Association of calnexin with mutant peripheral myelin protein-22 ex vivo: a basis for "gain-of-function" ER diseases”. Proc Natl Acad Sci USA 99 (15): 9852–7. (2002). Bibcode: 2002PNAS...99.9852D. doi:10.1073/pnas.152621799. PMC 125041. PMID 12119418.
- ^ “Rer1 and calnexin regulate endoplasmic reticulum retention of a peripheral myelin protein 22 mutant that causes type 1A Charcot-Marie-Tooth disease”. Sci Rep 4: 1–11. (2014). Bibcode: 2014NatSR...4E6992H. doi:10.1038/srep06992. PMC 4227013. PMID 25385046.
- ^ “The structure of calnexin, an ER chaperone involved in quality control of protein folding”. Mol Cell 8 (3): 633–44. (2001). doi:10.1016/s1097-2765(01)00318-5. PMID 11583625.
- ^ “Conformational changes induced in the endoplasmic reticulum luminal domain of calnexin by Mg-ATP and Ca2+”. J Biol Chem 270 (30): 18051–9. (1995). doi:10.1074/jbc.270.30.18051. PMID 7629114.
関連文献
[編集]- Protein quality control, retention, and degradation at the endoplasmic reticulum. International Review of Cell and Molecular Biology. 292. (2011). pp. 197–280. doi:10.1016/B978-0-12-386033-0.00005-0. ISBN 9780123860330. PMID 22078962
- “The evolutionary history of calreticulin and calnexin genes in green plants”. Genetica 139 (2): 225–9. (Feb 2011). doi:10.1007/s10709-010-9544-y. PMID 21222018.
- “Protein folding and quality control in the endoplasmic reticulum”. Current Opinion in Cell Biology 16 (4): 343–9. (Aug 2004). doi:10.1016/j.ceb.2004.06.012. hdl:1874/5106. PMID 15261665.
- “Microsequences of 145 proteins recorded in the two-dimensional gel protein database of normal human epidermal keratinocytes”. Electrophoresis 13 (12): 960–9. (Dec 1992). doi:10.1002/elps.11501301199. PMID 1286667.
- “The major histocompatibility complex class I antigen-binding protein p88 is the product of the calnexin gene”. Proceedings of the National Academy of Sciences of the United States of America 89 (18): 8452–6. (Sep 1992). Bibcode: 1992PNAS...89.8452G. doi:10.1073/pnas.89.18.8452. PMC 49938. PMID 1326756.
- “Participation of the endoplasmic reticulum chaperone calnexin (p88, IP90) in the biogenesis of the cystic fibrosis transmembrane conductance regulator”. The Journal of Biological Chemistry 269 (17): 12784–8. (Apr 1994). doi:10.1016/S0021-9258(18)99944-8. PMID 7513695.
- “The molecular chaperones HSP28, GRP78, endoplasmin, and calnexin exhibit strikingly different levels in quiescent keratinocytes as compared to their proliferating normal and transformed counterparts: cDNA cloning and expression of calnexin”. Electrophoresis 15 (3–4): 482–90. (1992). doi:10.1002/elps.1150150166. PMID 8055875.
- “Human, mouse, and rat calnexin cDNA cloning: identification of potential calcium binding motifs and gene localization to human chromosome 5”. Biochemistry 33 (11): 3229–36. (Mar 1994). doi:10.1021/bi00177a013. PMID 8136357.
- “The integrin chains beta 1 and alpha 6 associate with the chaperone calnexin prior to integrin assembly”. The Journal of Biological Chemistry 269 (16): 12263–8. (Apr 1994). doi:10.1016/S0021-9258(17)32710-2. PMID 8163531.
- “Retention of unassembled components of integral membrane proteins by calnexin”. Science 263 (5145): 387–90. (Jan 1994). Bibcode: 1994Sci...263..387R. doi:10.1126/science.8278814. PMID 8278814.
- “Interaction with newly synthesized and retained proteins in the endoplasmic reticulum suggests a chaperone function for human integral membrane protein IP90 (calnexin)”. The Journal of Biological Chemistry 268 (13): 9585–92. (May 1993). doi:10.1016/S0021-9258(18)98391-2. PMID 8486646.
- “Retinol binding protein and transthyretin are secreted as a complex formed in the endoplasmic reticulum in HepG2 human hepatocarcinoma cells”. Experimental Cell Research 222 (1): 77–83. (Jan 1996). doi:10.1006/excr.1996.0010. PMID 8549676.
- “Calreticulin interacts with newly synthesized human immunodeficiency virus type 1 envelope glycoprotein, suggesting a chaperone function similar to that of calnexin”. The Journal of Biological Chemistry 271 (1): 97–103. (Jan 1996). doi:10.1074/jbc.271.1.97. PMID 8550632.
- “A novel interleukin-12 p40-related protein induced by latent Epstein-Barr virus infection in B lymphocytes”. Journal of Virology 70 (2): 1143–53. (Feb 1996). doi:10.1128/JVI.70.2.1143-1153.1996. PMC 189923. PMID 8551575.
- “A "double adaptor" method for improved shotgun library construction”. Analytical Biochemistry 236 (1): 107–13. (Apr 1996). doi:10.1006/abio.1996.0138. PMID 8619474.
- “Calnexin associates exclusively with individual CD3 delta and T cell antigen receptor (TCR) alpha proteins containing incompletely trimmed glycans that are not assembled into multisubunit TCR complexes”. The Journal of Biological Chemistry 271 (16): 9660–5. (Apr 1996). doi:10.1074/jbc.271.16.9660. PMID 8621641.
- “The glut 1 glucose transporter interacts with calnexin and calreticulin”. The Journal of Biological Chemistry 271 (23): 13691–6. (Jun 1996). doi:10.1074/jbc.271.23.13691. PMID 8662691.
- “Effects of inefficient cleavage of the signal sequence of HIV-1 gp 120 on its association with calnexin, folding, and intracellular transport”. Proceedings of the National Academy of Sciences of the United States of America 93 (18): 9606–11. (Sep 1996). Bibcode: 1996PNAS...93.9606L. doi:10.1073/pnas.93.18.9606. PMC 38475. PMID 8790377.
- “Endoplasmic reticulum glucosidase II is composed of a catalytic subunit, conserved from yeast to mammals, and a tightly bound noncatalytic HDEL-containing subunit”. The Journal of Biological Chemistry 271 (44): 27509–16. (Nov 1996). doi:10.1074/jbc.271.44.27509. PMID 8910335.
- “Interactions between newly synthesized glycoproteins, calnexin and a network of resident chaperones in the endoplasmic reticulum”. The Journal of Cell Biology 136 (3): 555–65. (Feb 1997). doi:10.1083/jcb.136.3.555. PMC 2134297. PMID 9024687.
- “Incomplete endoplasmic reticulum (ER) retention in immature thymocytes as revealed by surface expression of "ER-resident" molecular chaperones”. Proceedings of the National Academy of Sciences of the United States of America 94 (5): 1884–9. (Mar 1997). Bibcode: 1997PNAS...94.1884W. doi:10.1073/pnas.94.5.1884. PMC 20012. PMID 9050874.
- “Large-scale concatenation cDNA sequencing”. Genome Research 7 (4): 353–8. (Apr 1997). doi:10.1101/gr.7.4.353. PMC 139146. PMID 9110174.
外部リンク
[編集]- Calnexin - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス