トロポニン
トロポニン(troponin)は横紋筋である骨格筋と心筋のカルシウムイオンによる収縮制御において中心的な役割を担うタンパク質複合体である。平滑筋でも微量のトロポニンサブユニットが発現しており何らかの役割を果たしているものと考えられている[1]。本タンパク質は江橋節郎によって発見、命名されたものである[2]。
役割
[編集]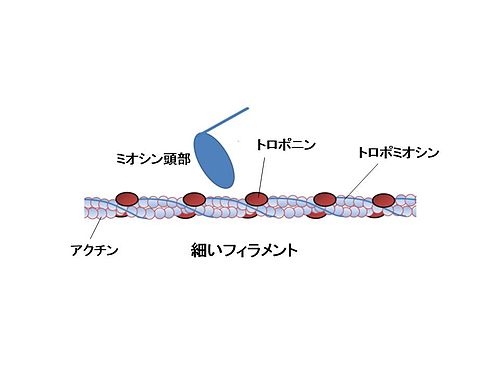
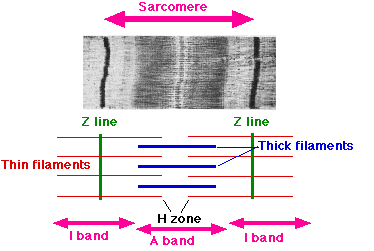
筋肉はミオシンとアクチンの相互作用によってATPに蓄えられた化学エネルギーを力に変換することで収縮する。実際の筋肉では、細胞内のカルシウム濃度が上昇する際に収縮し、下降するとき弛緩する。トロポニンは、このカルシウムによる筋収縮制御を可能にする調節タンパク質である。トロポニンはサルコメア(sarcomere)のZ線(Z line)から伸びているアクチンフィラメントに巻き付いたトロポミオシンの特定部位に結合しており, 細いフィラメント(thin filament)の全長にわたって約38ナノメートルの間隔で周期的に局在している。サルコメアには多数のミオシン分子が対称に会合して形成された太いフィラメント(thick filament)があり、筋収縮はこの太いフィラメントの束であるA帯(A band)の中に細いフィラメントが滑り込むことによって行われる(滑り説)。細胞内のカルシウム濃度が細胞外の1万分の1に抑えられ弛緩した筋肉では、トロポミオシンがアクチン分子上のミオシン頭部結合部位を立体的にブロックすることによって相互作用を抑制している(立体障害説)。筋細胞が活動電位によって刺激され収縮するとき、細胞内のカルシウム貯蔵部位である筋小胞体の膜に存在するカルシウムチャネル(リアノジン受容体)が開口し、濃度勾配に従って細胞質中にごく微量(細胞外カルシウム濃度の千分の1以下)のカルシウムが放出される。放出されたカルシウムの一部はトロポニンに結合し構造変化を引き起こすことによって、分子モーターであるミオシン頭部とアクチンの結合を障害しない位置にトロポミオシンを移動させて筋収縮を可能にする。つまり、筋収縮はミオシンとアクチン間の相互作用に対するトロポニンの抑制作用がカルシウムによって解除(脱抑制)されることで引き起こされる[3]。
トロポニンは、トロポニンC, トロポニンI, トロポニンTと名付けられた構造的にも機能的にも異なる3つのサブユニットからなるタンパク質複合体である。トロポニンCはカルモジュリンを祖先に持つカルシウム結合蛋白質であり、EFハンド構造と呼ばれる特徴的なカルシウム結合部位を持つ。トロポニンIは分子内の抑制領域でアクチンと結合することによって筋収縮を抑制するが、トロポニンCにカルシウムが結合することによってその結合が抑制される。トロポニンTは他のトロポニンサブユニットと結合するとともにトロポミオシンに結合することによって、トロポニン複合体を細いフィラメントの特定の位置に繋ぎとめている。骨格筋はさらに速筋と遅筋に分けられるが、速筋、遅筋、心筋においてそれぞれ異なる遺伝子にコードされた特異的なトロポニンのアイソフォームが発現しており、筋肉の種類に応じて最適なカルシウムによる収縮制御を行っている。例えば、速筋トロポニンCは筋収縮を制御する機能的役割を担うN末端側のカルシウム結合部位を2つ持つが、遅筋・心筋トロポニンCは1つしか持たない。すなわち、遅筋と心筋は1分子のトロポニンに1個のカルシウムイオンが結合解離することで制御されているのに対して、速筋は2個のカルシウムイオンが協同的に結合解離することで制御されている。これによって、速筋は非常に狭い範囲の細胞内カルシウム濃度の変化によって”全か無か”様の素早い応答が可能になっている。また、心筋トロポニンIのN末端には骨格筋トロポニンIよりも30個ほど長いアミノ酸が付加しており、自律神経による心機能の調節において重要な働きをしている。
遺伝病
[編集]心筋と骨格筋のトロポニン遺伝子の突然変異は、ミオフィラメント(細いフィラメント)のカルシウム感受性を増加あるいは低下させることによって心筋症と遠位関節拘縮症[4]をそれぞれ引き起こす。
診断用途
[編集]トロポニンサブユニットの組織特異的アイソフォーム(心筋トロポニンIと心筋トロポニンT)は非常に感受性が高く、心筋梗塞などにおける心筋(myocardium)の損傷を免疫測定法によって確認するための非常に優れたバイオマーカーである。
トロポニンTとトロポニンIの測定キットには各製品にそれぞれ特徴があるが、総じてトロポニンIの方が感度・特異度のバランスに優れている[5][6][7]。
資料
[編集]- Antman EM, Tanasijevic MJ, Thompson B, Schactman M, McCabe CH, Cannon CP, Fischer GA, Fung AY, Thompson C, Wybenga D, Braunwald E. Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute coronary syndromes. NEJM.1996;335:1342-9. PMID 8857017.
- Ammann P, Pfisterer M, Fehr T, Rickli H. Raised cardiac troponins. BMJ 2004;328:1028-9. PMID 15117768.
- Collinson PO, Boa FG, Gaze DC. Measurement of cardiac troponin. Ann Clin Biochem 2001;38:423-449. PMID 11587122.
- Gaze DC, Collinson PO. Cardiac troponins as biomarkers of drug- and toxin-induced cardiac toxicity and cardioprotection. Expert Opin Drug Metab Toxicol 2005;1:715-725. PMID 16863435.
- Gaze DC. The role of existing and novel cardiac biomarkers for cardioprotection. Curr. Opin. Invest. Drugs 2007;8:711-7. PMID 17729182.
脚注
[編集]- ^ Kajioka et al., Endogenous cardiac troponin T modulates Ca2+-mediated smooth muscle contraction. Scientific Reports 2, Article number: 979. PMID 23248744
- ^ Ohtsuk I., Morimoto S. Troponin: regulatory function and disorders. Biochem. Biophys. Res. Commun. 369:62–73, 2008. PMID 18154728
- ^ Iwao Ohtsuki, Troponin: Structure, Function and Dysfunction. In Regulatory Mechanisms of Striated Muscle Contraction. Advances in Experimental Medicine and Biology Volume 592, 2007, pp 21-36. PMID 17278353
- ^ Nigel F. Clarke, Skeletal Muscle Disease Due to Mutations in Tropomyosin, Troponin and Cofilin. In The Sarcomere and Skeletal Muscle Disease. Advances in Experimental Medicine and Biology Volume 642, 2008, pp 40-54. PMID 19181092
- ^ Keller T, et al. Sensitive troponin I assay in early diagnosis of acute myocardial infarction. N Engl J Med. 2009 Aug 27;361(9):868-77.
- ^ Reichlin T, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med. 2009 Aug 27;361(9):858-67.
- ^ http://rockymuku.sakura.ne.jp/zyunnkannkinaika/toroponinnTtoroponinnI.pdf
