ナイスタチン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Mycostatin, Nystop, others[1] |
| Drugs.com | monograph |
| MedlinePlus | a682758 |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 0% on oral ingestion |
| 代謝 | None (not extensively absorbed) |
| 半減期 | Dependent upon GI transit time |
| 排泄 | Fecal (100%) |
| データベースID | |
| CAS番号 |
1400-61-9 |
| ATCコード | A07AA02 (WHO) D01AA01 (WHO) G01AA01 (WHO) |
| PubChem | CID: 14960 |
| DrugBank |
DB00646 |
| ChemSpider |
23078586 |
| UNII |
BDF1O1C72E |
| KEGG |
D00202 |
| ChEBI |
CHEBI:473992 |
| ChEMBL |
CHEMBL229383 |
| NIAID ChemDB | 004993 |
| 化学的データ | |
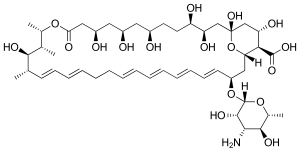
| 化学式 | C47H75NO17 |
| 分子量 | 926.09 |
| |
| |
ナイスタチン(ニスタチン、Nystatin)はポリエン系抗生物質の一つである。細胞膜のエルゴステロールと結合し、膜に小孔を作り、細胞内物質の流出と細胞外物質の流入を引き起こすことにより殺菌的に作用する[1]。カンジダの治療に使用されるが、腎毒性が強いため、消化管カンジダ症目的の経口投与を含めて“局所的”に使用される。海外ではおむつかぶれや皮膚カンジダ症、食道カンジダ症、膣内イースト菌感染症に使用される[1]。感染リスクの高い患者に対して予防的にも用いられる。
皮膚に塗布した場合に多く見られる副作用は灼熱感、瘙痒、発疹である。経口投与時の副作用は嘔吐および下痢である。妊婦の膣カンジダ症への局所使用は安全であるとされるが他の剤形では検討されていない。
1950年、放線菌のストレプトマイセス属に属するStreptomyces noursei からエリザベス・ヘイゼンとレイチェル・フラー・ブラウンが発見し[2]、発見地のニューヨーク州の頭文字を取って命名された。
WHO必須医薬品モデル・リストに収載されている[3]。なお、日本では2018年に製造販売が中止された。
効能・効果
[編集]皮膚、膣、口腔、食道のカンジダ感染症は通常ナイスタチン加療に良好に反応する。海外では多様な剤形が存在する。
経口ナイスタチンはCD4+数が減少しているAIDS患者やがん化学療法施行中の患者等、真菌感染症リスクの高い患者に対して予防的に用いられる。肝移植後の患者への適応についても検討されたが、予防効果、侵襲的感染治療、致死的感染の回復についてはフルコナゾールのほうが優っていた[4]。
極低出生体重児(出生時体重<1,500g)の侵襲的感染症罹患および死亡の予防に有効であることが知られており、臨床的にも使われるが、フルコナゾールの方が効果が高い。ガイドラインでは、新生児集中治療室で真菌感染症リスクの高い超低出生体重児(出生時体重<1,000g)のみに使用を限るべきとしている[5]。
リポソーム封入ナイスタチンは市販されていないが、in vitro での活性はアムホテリシンBのコロイド製剤よりも高く、一部のアムホテリシンB耐性真菌にも有効である[6]。これは侵襲性アスペルギルス症やアムホテリシンB耐性真菌などの治療困難な全身性感染症への選択肢と成る可能性を示唆している。さらに、リポソームナイスタチンはアムホテリシンBよりも腎毒性が低いと思われる[6]。
クリプトコッカス属もまたナイスタチンに感性である。英国では、乳児カンジダ症への経口投与は1ヶ月齢以上に制限されている。1ヶ月齢未満の新生児にはミコナゾールが用いられる[要出典]。
投与量は“単位”と呼ばれ、海外での投与量は口腔感染症に用いる10万単位から腸管感染症の100万単位まで様々である。消化管からは吸収されないので、薬物相互作用を考慮する必要は普通はない。しかし、経口、経膣、経皮投与後に吸収されて血中に現れることが時折あり、毒性が出現する。
日本でも販売されていたが、2018年で販売中止された[7]。嘗て承認されていた効能・効果は、カンジダによる消化管カンジダ症である[8]。
副作用
[編集]添付文書に記載されている重大な副作用は、皮膚粘膜眼症候群(Stevens-Johnson症候群)(0.1%未満)である[8]。
日本で使用される錠剤の場合は、5%以上(または頻度不明)に発疹、瘙痒感などの過敏症状が、0.1%以上5%未満に悪心、嘔吐、食欲不振、下痢などの消化器症状が出現する。
海外の経口懸濁液では下痢、腹痛のほか、稀に頻脈、気管支痙攣、顔面腫脹、筋痛が出現する[9]。経口剤と外用剤に共通する副作用として[10]、過敏症状、スティーブンス・ジョンソン症候群、発疹、瘙痒感、灼熱感、急性汎発性発疹性膿疱症がある[11]。
作用機序
[編集]アムホテリシンBやナタマイシンと同じく、ナイスタチンは真菌の細胞膜の主成分であるエルゴステロールに結合する。濃度が充分に高ければ、ナイスタチンは細胞膜に孔を形成し、細胞内K+の漏出と酸性化を導き、細胞死に至らしめる[12]。エルゴステロールは真菌に特異的な成分であり、動物細胞や植物細胞には作用しない。しかしながら、哺乳類のステロールであるコレステロールに対しても結合するため、様々な全身効果、毒性が現れる。ナイスタチンが血中に現れた場合に出現する腎毒性もその一つである。
生合成
[編集]ナイスタチンA1(単にナイスタチンとも呼ばれる)はStreptomyces noursei によって生合成される[13]。この活性な化合物の構造はポリエンマクロライド環とデオキシアミノ糖の一種であるD-ミコサミドを特徴とする[13]。ナイスタチンのゲノム配列は、ポリケチド読み込みモジュール(nysA)、5つのポリケチド合成酵素モジュール(nysB、nysC、nysI、nysJ、nysK)、2つのチオエステラーゼ(nysK、nysE)が存在することを明らかにした[13]。これによりマクロライドの生合成がポリケチド合成酵素I経路によることが判明した[14]。
マクロライド環の生合成に続けて、GDP-マンノース脱水酵素(nysIII)、P450一酸化酵素(nysL、nysN)、アミン転移酵素(nyaDII)、糖転移酵素(nysDI)が環の後修飾を実施する[13]。以下に酵母ナイスタチンの生合成経路を示す。
-
Loading to 5
-
Modules 6-12
-
Modules 13 -18
-
Completed molecule
開発の経緯
[編集]
他の多くの抗真菌剤と同じ様に、ナイスタチンは真正細菌由来の物質である。1950年に初めて土壌細菌であるStreptomyces noursei から分離された。細菌名のnoursei は土壌を採取した農場の所有者に因む[15]。NYStatinの名前は研究所(現ワズワースセンター)のあるニューヨーク州(New York State)の頭文字を取って1954年に命名された。
その他の用途
[編集]
細胞生物学の研究では、ナイスタチンは哺乳動物細胞の脂質ラフトカベオラエンドサイトーシス経路の阻害剤として、3µg/mL前後の濃度で使用されている。
特定の場合、ナイスタチンは美術品の防黴に応用される。例えば、1966年のイタリアアルノ川の洪水の遺物等である。
ナイスタチンは電気生理学の分野では細胞の穿孔パッチクランプ記録法に利用される。記録ピペットにロードされた時にのみ一価イオンに対する透過性を持つ細胞膜孔を形成するので、細胞の内容物を流出させる事なく電流の測定を可能にする[16]。
剤形
[編集]- 経口懸濁液[注 1]:口腔・咽頭表在性カンジダ症の予防・治療
- 錠剤:腸管カンジダ症
- 軟膏・クリーム剤[注 1][注 2]:皮膚表在性カンジダ症
- リポソーム製剤[注 1]:1980年代に研究されていた。リポソーム剤はナイスタチンの低溶解度と全身毒性から生じる問題の改善を意図していた。
血中濃度が高い場合の毒性の高さから、注射剤の形では用いられないが、過去に研究された事がある[6]。
脚注
[編集]注釈
[編集]出典
[編集]- ^ a b c “Nystatin”. The American Society of Health-System Pharmacists. Jan 2016閲覧。
- ^ Espinel-Ingroff, Ana Victoria (2013). Medical Mycology in the United States a Historical Analysis (1894-1996). Dordrecht: Springer Netherlands. p. 62. ISBN 9789401703116
- ^ “WHO Model List of Essential Medicines” (PDF). World Health Organization (October 2013). 22 April 2014閲覧。
- ^ Gøtzsche PC, Johansen HK (2014). “Nystatin prophylaxis and treatment in severely immunodepressed patients”. Cochrane Database Syst Rev 9: CD002033. doi:10.1002/14651858.CD002033.pub2. PMID 25188770.
- ^ Pappas, PG; Kauffman CA; Andes D (2009). “Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America.”. Clin Infect Dis 48 (5): 503–35. doi:10.1086/596757. PMID 19191635.
- ^ a b c Dismukes, WE. Clinical Mycology. Oxford University Press. pp. 50–53
- ^ “ナイスタチン錠50万単位「明治」製造販売中止のご案内”. 2022年7月26日閲覧。
- ^ a b “ナイスタチン錠50万単位 インタビューフォーム”. 2022年7月26日閲覧。
- ^ “Micromedex Detailed Drug Information”. Apr 1, 2014閲覧。
- ^ “FDA approved package insert”. 2016年4月29日閲覧。
- ^ Rosenberger A, Tebbe B, Treudler R, Orfanos CE (1998). “[Acute generalized exanthematous pustulosis, induced by nystatin”] (German). Hautarzt 49 (6): 492–5. PMID 9675578. オリジナルの2001年5月16日時点におけるアーカイブ。 2015年1月14日閲覧。.
- ^ Hammond, S.M. (1977). “Biological activity of polyene antibiotics.”. Progress in medicinal chemistry 14 (105-179): 105–79. PMID 345355.
- ^ a b c d Fjaervik E, Zotchev SB (2005). “Biosynthesis of the polyene macrolide antibiotic nystatin in Streptomyces noursei”. Appl. Microbiol. Biotechnol. 67 (4): 436–443. doi:10.1007/s00253-004-1802-4. PMID 15700127.
- ^ Dewick, Paul M. (2009). Medicinal Natural Products: A Biosynthetic Approach (3rd ed.). UK: John Wiley & Sons Ltd. ISBN 0-471-97478-1
- ^ Ana Espinel-Ingroff, Medical mycology in the United States: a historical analysis (1894-1996), Springer, 2003, p. 62.
- ^ Akaike N, Harata N (1994). “Nystatin perforated patch recording and its applications to analyses of intracellular mechanisms”. Jpn. J. Physiol. 44 (5): 433–73. doi:10.2170/jjphysiol.44.433. PMID 7534361.



