ニトロソニウムイオン
| ニトロソニウムイオン | |
|---|---|
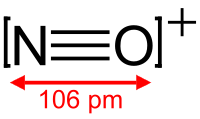
| |
ニトロソニウム | |
イミノオキシダニウム | |
| 識別情報 | |
| 略称 | NO(+) |
| CAS登録番号 | 14452-93-8 |
| PubChem | 84878 |
| ChemSpider | 76569? |
| ChEBI | |
| Gmelin参照 | 456 |
| |
| |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ニトロソニウムイオン (英: nitrosonium ion) は、化学式 NO+ と表されるオキシカチオンである。ニトロシルカチオン(nitrosyl cation)と呼ばれることもある。窒素原子と酸素原子は結合次数3で共有結合しており、全体的に正電荷を帯びている。 このイオンは CO や N2 と等電子的である。 NO+は、NOClO4、NOSO4H(正確には ONOSO2OH、すなわち混合酸無水物である)、NOBF4 (英語版) のような塩として存在する。ClO4- や BF4- との塩はアセトニトリルにわずかに溶ける。NOBF4 は、200-250 °C、0.01 mmHg (1.3 Pa) で昇華によって精製することができる。
NO+は酸性条件下、亜硝酸との平衡にある。ただし、亜硝酸は不安定であるため、NO+を発生させる目的には通常、亜硝酸塩や亜硝酸エステルが用いられる。
- HONO + H+
 NO+ + H2O
NO+ + H2O
化学的性質
[編集]加水分解
[編集]- NOBF4 + H2O → HONO + HBF4
このために、NOBF4 は水または湿った空気から保護されなければならない。塩基との反応では亜硝酸塩が生じる。
- NOBF4 + 2 NaOH → NaNO2 + NaBF4 + H2O
ジアゾ化剤
[編集]
NO+ は、アリールアミン ArNH2 と反応してジアゾニウムイオン ArN2+ を与える。結果として生じるジアゾニオ基は、アミノ基と違い、いろいろな求核剤によって容易に脱離反応を起こす。
酸化剤
[編集]- ジクロロメタン中の NO+ に対する Fe(Cp)2/Fe(Cp)2+ 系の酸化還元電位は1.00 Vである (1.46-1.48 V vs SCE)。
- アセトニトリル中の NO+ に対する Fe(Cp)2/Fe(Cp)2+ 系の酸化還元電位は0.87 Vである (1.25-1.27 V vs SCE)。
気体の副生物である NO は、反応で使用する窒素気流で取り除くことができるため、NOBF4 は便利な酸化剤である。NO は空気と接触すると直ちに NO2 となり、これが取り除かれないと余計な反応を引き起こすことがある。NO2 は、その特徴的なオレンジ色のためにすぐに発見できる。
アレーンのニトロシル化
[編集]電子豊富なアレーンは、NOBF4 によってニトロシル化(ニトロソ化とも)される[2]。例としてアニソールのニトロシル化が挙げられる。
- CH3OC6H5 + NOBF4 → CH3OC6H4-4-NO + HBF4
ニトロソニウムイオン NO+ は、ニトロ化反応の活性種であるニトロニウムイオン NO2+ と混同される場合がある。しかし、これらは全く異なる化学種である。前者が弱酸(亜硝酸)、後者が強酸(硝酸)に由来するという事実によって予想されるように、NO2+は NO+より強力な求電子剤である。
NO 錯体の原料
[編集]NOBF4 はいくつかの金属カルボニルと反応して、対応する金属ニトロシルを与える[3]。NO+ による配位子置換反応の際は、空気による酸化に注意しなければならない。
- (C6Et6)Cr(CO)3 + NOBF4 → [(C6Et6)Cr(CO)2(NO)]BF4 + CO
出典
[編集]- ^ N. G. Connelly, W. E. Geiger (1996). “Chemical Redox Agents for Organometallic Chemistry”. Chem. Rev. 96: 877–910. doi:10.1021/cr940053x. PMID 11848774.
- ^ E. Bosch and J. K. Kochi, "Direct Nitrosation of Aromatic Hydrocarbons and Ethers with the Electrophilic Nitrosonium Cation" Journal of Organic Chemistry, 1994, volume 59, pp. 5573–5586.
- ^ T. W. Hayton, P. Legzdins, W. B. Sharp "Coordination and Organometallic Chemistry of Metal-NO Complexes" Chemical Reviews 2002, volume 102, pp. 935–991
