硫酸水素ニトロシル
表示
| 硫酸水素ニトロシル | |
|---|---|
| |

| |
Nitrosylsulfuric acid | |
別称 nitrosonium bisulfate, chamber crystals | |
| 識別情報 | |
| CAS登録番号 | 7782-78-7 |
| PubChem | 82157 |
| ChemSpider | 74147 |
| UNII | 40K942UPM8 |
| |
| |
| 特性 | |
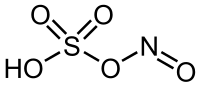
| 化学式 | HSO 4NO |
| モル質量 | 127.08 g/mol |
| 外観 | 淡黄色結晶[1] |
| 密度 | 1.865 g/mL (40%硫酸溶液) [2] |
| 融点 |
70 °C, 343 K, 158 °F [1] |
| 沸点 |
分解 |
| 水への溶解度 | 分解 |
| 溶解度 | 硫酸に溶ける[1] |
| 危険性 | |
| 主な危険性 | 酸化剤 |
| 関連する物質 | |
| その他の陰イオン | 塩化ニトロシル |
| その他の陽イオン | 硫酸水素ナトリウム |
| 関連物質 | テトラフルオロホウ酸ニトロソニウム |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
硫酸水素ニトロシル(りゅうさんすいそ—、nitrosyl bisulfate)は化学式 NOHSO4 で表される無機化合物で、ニトロシル硫酸 (nitrosylsulfuric acid) とも呼ばれる。白色の固体で融点は 73.5 ℃。
硫酸の水素 (H−) の1個がニトロソ基 NO− で置換された構造を持ち、硫酸と亜硝酸の混合酸無水物に相当する。
性質
[編集]乾燥空気中では安定であるが、湿った空気中では酸化を受けながら硫酸と硝酸とに分解する。求電子的なニトロソ化剤として知られている。
合成
[編集]鉛室法による硫酸製造の中間体として存在する。発煙硝酸に二酸化硫黄を作用させる方法、クロロ硫酸に二酸化窒素を作用させる方法などによって得られる。
出典
[編集]- ^ a b c George A. Olah, G. K. Surya Prakash, Qi Wang, Xing-Ya Li (2001). “Nitrosylsulfuric Acid”. Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rn060. ISBN 978-0471936237
- ^ “Nitrosylsulfuric acid solution”. Merck. 2024年8月閲覧。
