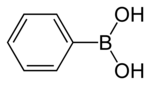
フェニルボロン酸
| フェニルホウ酸 | |
|---|---|
| |
| |
Phenylboronic acid | |
| 識別情報 | |
| CAS登録番号 | 98-80-6 |
| PubChem | 66827 |
| ChemSpider | 60191 |
| EC番号 | 202-701-9 |
| DrugBank | DB01795 |
| ChEBI | |
| ChEMBL | CHEMBL21485 |
| |
| |
| 特性 | |
| 化学式 | C6H7BO2 |
| モル質量 | 121.93 g/mol |
| 外観 | 白または黄色の粉末 |
| 匂い | 無臭 |
| 融点 |
216 °C, 489 K, 421 °F |
| 水への溶解度 | 10 g/L (20 °C)[1] |
| 溶解度 | ジエチルエーテル、エタノールに可溶 |
| 酸解離定数 pKa | 8.83 |
| 構造 | |
| 分子の形 | 平面形 |
| 熱化学 | |
| 標準生成熱 ΔfH |
-719.6 kJ/mol |
| 危険性 | |
| 安全データシート(外部リンク) | [1] |
| Rフレーズ | 22 |
| 半数致死量 LD50 | 740 mg/ml (ラット、経口) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
フェニルボロン酸、フェニルホウ酸(英: Phenylboronic acid、中国語: 苯硼酸)あるいはベンゼンホウ酸(英: benzeneboronic acid)はホウ素原子に2つのヒドロキシ基と1つのフェニル基が結合した化合物である。しばしばフェニル基 (C6H5-) を Ph と略して PhB(OH)2と書かれる。フェニルホウ酸は白い粉で有機合成において一般的に使われている。ホウ酸は弱いルイス酸であり、グリニャール試薬などに比べ扱いやすいことから有機合成に重要である。
性質
[編集]フェニルホウ酸は極性のある有機溶媒に可溶であるが、ヘキサンや四塩化炭素などにはほとんど溶けない。この平面化合物はC2vの分子対称性を持っている。ホウ素原子がsp2-混成して空のp軌道を持っている。直方晶系であるフェニルホウ酸の分子結晶は2分子間で水素結合を形成して成り立っている[2]。この二量体ユニットは水素結合ネットワークに繋がっている。平面形の2分子はC-B結合を挟んでわずかに曲がって水素結合しており、2つのPhB(OH)2分子の平面がなす角度はそれぞれ6.6°と21.4°である[3]。
合成
[編集]フェニルホウ酸を合成するのに多くの方法が知られている。1つはもっとも一般的な方法で、臭化フェニルマグネシウムとホウ酸トリメチルを反応させてPhB(OMe)2というエステルを作り、これを加水分解する方法である[4]。
- PhMgBr + B(OMe)3 → PhB(OMe)2 + MeOMgBr
- PhB(OMe)2 + H2O → PhB(OH)2 + MeOH
他の方法としては求電子剤のホウ酸塩をハロゲン化フェニルまたはオルトメタル化によって合成したフェニル-金属中間体に捕捉させる方法である[3]。フェニルシランやフェニルスタンナンはBBr3とトランスメタル化反応を起こし、生成物が加水分解を起こしてフェニルホウ酸を生成する。ハロゲン化アリールやトリフルオロメタンスルホナートは遷移金属触媒を用いてジボロニル試薬と結合させることができる。芳香族のC-H活性化も同じく遷移金属触媒を用いて行うことができる。
反応性
[編集]フェニルボロン酸が脱水反応を起こすと三量体無水物であるボロキシンを与える。脱水反応は熱的に進行し、乾燥剤(英語版)を加える場合もある[5]。
フェニルボロン酸はフェニル基を含む多くのクロスカップリング反応に使用される。その例の一つが鈴木・宮浦カップリングで、パラジウム触媒と塩基、フェニルボロン酸とハロゲン化ビニルを反応させてフェニルアルケンを合成する反応である[6]。この方法はハロゲン化アリールとフェニルボロン酸を反応させてビアリールを合成する方法として一般化されている。
C-C結合形成プロセスではフェニルボロン酸がしばしば試薬として登場する。α-アミノ酸はα-ケト酸、アミン、フェニルボロン酸を触媒を使用せずに反応させると合成できる[7]。ヘック反応でフェニルボロン酸とアルケンもしくはアルキンを使う反応も示されている[8]。
アリールアジドやニトロ化合物もフェニルボロン酸によって合成することができる[3]。フェニルボロン酸も塩素、臭素、ヨウ素と水中で反応させることで位置選択的にハロデボロン化することが可能である[9]。
- PhB(OH)2 + Br2 + H2O → PhBr + B(OH)3 + HBr
ボロン酸とアルコールの縮合反応によってボロン酸エステルが生成する。生成するものは単純にヒドロキシ基をアルコキシ基やアリルオキシ基に置換したものである[3]。この可逆反応は水を除くためにディーン・スターク装置や乾燥剤を使って行われることが多い。
- PhB(OH)2 + 2 ROH
 PhB(OR)2 + 2 H2O
PhB(OR)2 + 2 H2O
この反応の拡張として、PhB(OH)2をジオールやジアミンの保護基にする方法がある。この反応性によりフェニルボロン酸は炭化水素のセンサーやレセプター、抗生物質や酵素阻害剤に利用されたり、中性子捕捉療法に使われたり、膜透過輸送や生体共役反応、タンパク質のラベリングなど生体反応に用いることができる[3]。
脚注
[編集]- ^ http://m.chemicalbook.com/ChemicalProductProperty_EN_CB5323625.htm
- ^ “Crystal and molecular structure of phenylboronic acid, C6H5B(OH)2”. Canadian Journal of Chemistry 55: 3071–3075. (1977).
- ^ a b c d e Hall, D. G. Boronic Acids; WILEY-VCH: Edmonton, Canada, 2005. ISBN 3-527-30991-8
- ^ Washburn, RM; Levens, E; Albright, CF; Billig, FA (1963). "Benzeneboronic anhydride". Organic Syntheses (英語).; Collective Volume, vol. 4, p. 68
- ^ Snyder, H. R.; Kuck, J. A.; Johnson, J. R. (1938). “Organoboron Compounds, and the Study of Reaction Mechanisms. Primary Aliphatic Boronic Acids”. 米国化学会誌 60: 105. doi:10.1021/ja01268a033.
- ^ Miyaura, N.; Suzuki, A. (1979). “Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst”. J. Chem. Soc., Chem. Commun. (19): 866. doi:10.1039/C39790000866.
- ^ Petasis, N. A.; Xavialov, I. A. (1997). “A New and Practical Synthesis of α-Amino Acids from Alkenyl Boronic Acids”. 米国化学会誌 119 (2): 445. doi:10.1021/ja963178n.
- ^ Sakai, M.; Hayashi, H.; Miyaura, N. (1998). “Rhodium-Catalyzed Addition of Organoboronic Acids to Aldehydes”. Angew. Chem. Int. Ed. 37 (23): 3279. doi:10.1002/(SICI)1521-3773(19981217)37:23<3279::AID-ANIE3279>3.0.CO;2-M.
- ^ Ainley, A. D.; Challenger, F. (1930). “Studies of the boron–carbon linkage. Part I. The oxidation and nitration of phenylboric acid”. J. Chem. Soc.: 2171. doi:10.1039/JR9300002171.
参考文献
[編集]- Brown, H.C. Organic Synthesis via Boranses, Wiley, New York, 1975.
- Matteson, D. S. Stereodirected Synthesis with Organoboranes, Springer, Berlin, 1995. ISBN 978-3-540-59182-5
- Lappert, M. F. (1956). “Organic Compounds Of Boron”. Chem. Rev. 56 (5): 959. doi:10.1021/cr50011a002.
- Pelter, A.; Smith, K.; Brown, H. C. Borane Reagents, Academic Press, New York, 1988.
- Mikhailov, B. M.; Bubnov, Y. N. Organoboron Compounds in Organic Synthesis, Harwood Academics, Glasgow, 1984. ISBN 3-7186-0113-3

