フェルミウム
| |||||||||||||||||||||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 不明 | |||||||||||||||||||||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | フェルミウム, Fm, 100 | ||||||||||||||||||||||||||||||||||||||||||
| 分類 | アクチノイド | ||||||||||||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | n/a, 7, f | ||||||||||||||||||||||||||||||||||||||||||
| 原子量 | [257] | ||||||||||||||||||||||||||||||||||||||||||
| 電子配置 | [Rn] 5f12 7s2 | ||||||||||||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 32, 30, 8, 2(画像) | ||||||||||||||||||||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||||||||||||||||||||
| 相 | 固体 | ||||||||||||||||||||||||||||||||||||||||||
| 融点 | 1800 K, 1527 °C, 2781 °F | ||||||||||||||||||||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||||||||||||||||||||
| 酸化数 | 2, 3 | ||||||||||||||||||||||||||||||||||||||||||
| 電気陰性度 | 1.3(ポーリングの値) | ||||||||||||||||||||||||||||||||||||||||||
| イオン化エネルギー | 1st: 627 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||
| 共有結合半径 | 167 pm | ||||||||||||||||||||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||||||||||||||||||||
| CAS登録番号 | 7440-72-4 | ||||||||||||||||||||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||||||||||||||||||||
| 詳細はフェルミウムの同位体を参照 | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
フェルミウム(英: fermium [ˈfɜrmiəm])は、元素記号Fm、原子番号100の人工放射性元素である。アクチノイドの1つである。フェルミウムはより軽い元素への中性子照射で生成する最も重い元素であり、そのためマクロ量で生成しうる最後の元素である。しかし、純粋な金属としてのフェルミウムはまだ生成されていない[1][2]。19個の同位体が知られており、その中でフェルミウム257が100.5日と最長の半減期を持つ。
フェルミウムは、1952年の最初の水素爆発の塵の中から発見された。化学的性質はアクチノイド後半の元素に典型的なもので、原子価は+3が優占的だが、+2も取り得る。半減期が短く生成量が少ないため、現在は基礎科学研究用途以外ではほとんど用いられていない。他の人工放射性元素が全てそうであるように、フェルミウムの同位体は全て放射性であり、高い毒性を持つと考えられている。
名称
[編集]原子核物理学のパイオニアの1人でノーベル物理学賞受賞者のエンリコ・フェルミに因んで名付けられた。
発見
[編集]

フェルミウムは、1952年11月1日に行われた最初の成功した水素爆弾実験アイビー作戦(アイビー・マイク)で発生した放射性降下物の中から発見された[3][4][5]。当初の塵の分析では、ウラン238が6個の中性子を吸収し、その後2回ベータ崩壊した時にのみ生成しうるプルトニウムの新しい同位体であるプルトニウム244が検出された。当時は、重い原子核が中性子を吸収するのは珍しい過程だと考えられていたが、プルトニウム244の検出により、さらに多くの中性子がウラン原子核に吸収される可能性が表れ、新しい元素の発見につながった[5]。
元素99(アインスタイニウム)は、爆発の雲の中を漂っていたろ紙の中からすぐに発見された(プルトニウム244の検出と同じサンプリング手法)[5]。これは、1952年12月にカリフォルニア大学バークレー校のアルバート・ギオルソらによって発見された[3][4][5]。彼らが発見したのは、ウラン238が中性子を15個吸収し、その後7回ベータ崩壊してできる、半減期20.5日のアインスタイニウム253であった。
さらに、ウラン238がこれ以上(恐らくは16個か17個)の中性子を吸収することもあると考えられた。
元素100(フェルミウム)は、元素99よりも1桁少ない収率になると予測されたため、その発見には、さらに多くの材料が必要であった。そのため、ローレンス・バークレー国立研究所の調査団は、船で汚染されたサンゴを回収し、分析した。水素爆弾実験から約2ヶ月後、高エネルギーのアルファ粒子(7.1MeV)を放出する半減期がほぼ1日の新しい成分が分離された。その短い半減期から、このような同位体が生じるのはアインスタイニウムがベータ崩壊した時のみであるため、新しい元素100だと考えられ、実際にすぐにフェルミウム255(半減期20.07時間)と確認された[5]。
この新しい元素の発見と新しい中性子捕獲のデータは、冷戦の緊張の下、アメリカ軍の要請を受けて1955年まで明らかにされなかった[5][6][7]。アイビー・マイクの研究成果が公表されたのは、1955年になってからだった[6]。
同位体
[編集]
NUBASE2003には[8]、原子量242から260までの19個のフェルミウムの同位体が掲載されている。その中で、フェルミウム257は100.5日という最も長い半減期を持つ。フェルミウム253は3日の半減期を持ち、フェルミウム251、252、254、255、256の半減期は、それぞれ5.3時間、25.4時間、3.2時間、20.1時間、2.6時間である。また、残りの同位体の半減期は、全て30分からミリ秒以下である[8]。フェルミウム257が中性子を捕獲して生成するフェルミウム258は、370ミリ秒で自発的核分裂を起こす。フェルミウム259と260もどちらも不安定で、それぞれ1.5秒、4ミリ秒で自発的核分裂を起こす[8]。これは、核爆発中以外では、中性子捕獲が質量数257以上の原子核を作れないことを意味する。フェルミウム257はアルファ崩壊しカリホルニウム253になるため、フェルミウムは中性子捕獲過程で生成する最後の元素でもある[1][9]。
製造
[編集]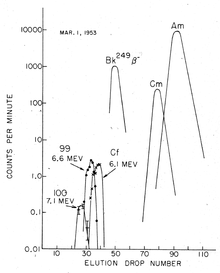
フェルミウムは、核施設において、より軽いアクチノイドの原子核に中性子を衝突させることで製造される。フェルミウム257は、中性子捕獲によって得られる最も重い原子核であり、ナノグラム程度の量しか製造できない[10]。主要な製造元は、85MWの出力を持ちキュリウム以上(Z > 96)の原子核を作る専門施設であるオークリッジ国立研究所の高中性子束同位体生産炉である[11]。この炉の通常の稼働では、数十gのキュリウムが放射線照射を受けて0.1gの桁のカリホルニウム、mgの桁のバークリウムとアインスタイニウム、ピコグラムの桁のフェルミウムが生産される[12]。しかし、特定の条件の実験では、ナノグラム[13]やマイクログラム[9]の桁のフェルミウムが生産される場合もある。20から200キロトンの熱核爆発で得られるフェルミウムはミリグラムの桁だと考えられているが、これは莫大な量の塵の中に混ざっており、例えば、1969年7月16日の「ハッチ」実験では、10kgの塵の中から40pgのフェルミウム257が回収された[14]。
製造後のフェルミウムは他のアクチノイドとランタノイドから分離する必要があるが、これは、通常は、α-ヒドロキシイソブチル酸アンモニウムに溶解させ、Dowex 50やTEVA等の陽イオン交換樹脂を用いたイオン交換クロマトグラフィーを用いて行われる[1][15]。小さな陽イオンは、α-ヒドロキシイソブチル酸アンモニウム陰イオンと結合してより安定な複合体を作り、そのためカラムから溶出しやすくなる[1]。高速分画結晶法が用いられる場合もある[1][16]。
フェルミウムの最も安定な同位体は、半減期が100.5日のフェルミウム257であるが、アインスタイニウム255の崩壊生成物として容易に分離できることから、最も研究されている同位体は、半減期20.07時間のフェルミウム255である[1]。
核爆発における合成
[編集]10メガトン級のアイビー・マイクの塵の分析は、長期のプロジェクトの一環として行われ、その目的の一つは高エネルギーの核爆発における超ウラン元素の生成の効率に関する研究であった。核爆発は最も強力な中性子源であり、ミリ秒の間にcm2当たり1023個の中性子密度を作る。これと比較して、高中性子束同位体生産炉での中性子密度は、ミリ秒の間にcm2当たり1012個である。いくつかの同位体は、米国本国に運ぶまでの間に崩壊してしまうため、研究所はエニウェトク環礁で塵の予備分析を行った。研究所は、実験後できるだけ早く、ろ紙を備えた飛行機で環礁の周りを飛び、サンプルを回収した。この分析で、フェルミウムよりも重い元素が発見されることが期待されたが、1954年から1956年にこの環礁で行われた何度かのメガトン級の核爆発後の分析でも発見されなかった[17]。

天然での生成
[編集]フェルミウムは全ての同位体の半減期が短いため、地球形成以来、生成したフェルミウムは全て崩壊している。天然の地殻に存在するウランやトリウムからのフェルミウムを生成するには中性子捕獲が多数回必要なため、非常に珍しいと考えられる。そのため、地球上のほとんどのフェルミウムは実験室や高エネルギーの原子炉、核実験でできたものであり、生成してから数年間のみしか検出されない。アインスタイニウムとフェルミウムはオクロの天然原子炉でも生成されていたが、現在は停止している[19]。
化学的性質
[編集]フェルミウムの化学的性質は、溶液状態で研究されたのみであり、固体状態は作られていない。通常の状態では、フェルミウムは溶液中に三価の陽イオンFm3+として存在し、水和数は16.9、酸解離定数は1.6×10-4(pKa=3.8)である[20][21]。三価のフェルミウムイオンは、酸素のような硬いドナーとともに広範な有機リガンドに結合し、これらの錯体は他のアクチノイドの錯体よりも安定である[1]。また、塩化物や硝酸塩と陰イオン錯体 も作り、やはりこれらもアインスタイニウムやカリフォルニウムの錯体よりも安定であるようである[22]。後半のアクチノイドの錯体の結合は、イオン性が強いと考えられている。フェルミウムの有効核電荷が高いため、フェルミウムイオンは他のアクチノイドイオンよりも小さいと考えられ、そのためフェルミウムは 、より短く強い金属-リガンド結合を作る[1]。
三価のフェルミウムは、例えば塩化サマリウム等で共沈させることで[23][24]、かなり容易に二価のフェルミウムに還元される[25]。電極電位は、イッテルビウム(III)/(II)対と同程度で、基準電極に対して約-1.15 Vと推定され[26]、これは理論的な計算とも合致する。Fm2+/Fm0対の電極電位は、ポーラログラフィー測定によると-2.37Vである[27]。
毒性
[編集]フェルミウムに触れる者はほとんどいないが、国際放射線防護委員会は、2つの同位体について年間曝露限界を定めている。フェルミウム253に対しては、摂取限界107ベクレル、吸入限界105ベクレル、フェルミウム257に対しては、摂取限界105ベクレル、吸入限界4000ベクレルである[28]。
出典
[編集]- ^ a b c d e f g h Silva, Robert J. (2006). “Fermium, Mendelevium, Nobelium, and Lawrencium”. In Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean (PDF). The Chemistry of the Actinide and Transactinide Elements. 3 (3rd ed.). Dordrecht: Springer. pp. 1621–1651. doi:10.1007/1-4020-3598-5_13.
- ^ Choppin, G. R.; Harvey, B. G.; Thompson, S. G. (1956). “A new eluant for the separation of the actinide elements”. J. Inorg. Nucl. Chem. 2 (1): 66–68. doi:10.1016/0022-1902(56)80105-X.
- ^ a b “Einsteinium”. 2007年10月26日時点のオリジナルよりアーカイブ。2007年12月7日閲覧。
- ^ a b Fermium – National Research Council Canada. Retrieved 2 December 2007
- ^ a b c d e f Ghiorso, Albert (2003). “Einsteinium and Fermium”. Chemical and Engineering News 81 (36).
- ^ a b Ghiorso, A.; Thompson, S.; Higgins, G.; Seaborg, G.; Studier, M.; Fields, P.; Fried, S.; Diamond, H. et al. (1955). “New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100”. Phys. Rev. 99 (3): 1048–1049. Bibcode: 1955PhRv...99.1048G. doi:10.1103/PhysRev.99.1048.
- ^ Fields, P. R.; Studier, M. H.; Diamond, H.; Mech, J. F.; Inghram, M. G. Pyle, G. L.; Stevens, C. M.; Fried, S.; Manning, W. M. (Argonne National Laboratory, Lemont, Illinois); Ghiorso, A.; Thompson, S. G.; Higgins, G. H.; Seaborg, G. T. (University of California, Berkeley, California): "Transplutonium Elements in Thermonuclear Test Debris", in: Fields, P.; Studier, M.; Diamond, H.; Mech, J.; Inghram, M.; Pyle, G.; Stevens, C.; Fried, S. et al. (1956). “Transplutonium Elements in Thermonuclear Test Debris”. Physical Review 102: 180. Bibcode: 1956PhRv..102..180F. doi:10.1103/PhysRev.102.180.
- ^ a b c Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003), "The NUBASE evaluation of nuclear and decay properties", Nucl. Phys. A 729: 3–128, Bibcode 2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b Greenwood, Norman N.; Earnshaw, A. (1984), Chemistry of the Elements, Oxford: Pergamon, p. 1262, ISBN 0-08-022057-6
- ^ Luig, Heribert; Keller, Cornelius; Wolf, Walter; Shani, Jashovam; Miska, Horst; Zyball, Alfred; Gerve, Andreas; Balaban, Alexandru T. et al. (2000). Radionuclides. doi:10.1002/14356007.a22_499.
- ^ “High Flux Isotope Reactor”. Oak Ridge National Laboratory. 2010年9月23日閲覧。
- ^ Porter, C. E.; Riley, F. D., Jr.; Vandergrift, R. D.; Felker, L. K. (1997). “Fermium Purification Using Teva Resin Extraction Chromatography”. Sep. Sci. Technol. 32 (1-4): 83-92. doi:10.1080/01496399708003188.
- ^ Sewtz, M.; Backe, H.; Dretzke, A.; Kube, G.; Lauth, W.; Schwamb, P.; Eberhardt, K.; Gruning, C. et al. (2003). “First Observation of Atomic Levels for the Element Fermium (Z = 100)”. Phys. Rev. Lett. 90 (16): 163002. Bibcode: 2003PhRvL..90p3002S. doi:10.1103/PhysRevLett.90.163002.
- ^ Hoff, R. W.; Hulet, E. K. (1970). Engineering with Nuclear Explosives. 2. pp. 1283-1294.
- ^ Choppin, G. R.; Harvey, B. G.; Thompson, S. G. (1956). “A new eluant for the separation of the actinide elements”. J. Inorg. Nucl. Chem. 2 (1): 66-68. doi:10.1016/0022-1902(56)80105-X.
- ^ Mikheev, N. B.; Kamenskaya, A. N.; Konovalova, N. A.; Rumer, I. A.; Kulyukhin, S. A. (1983). “High-speed method for the separation of fermium from actinides and lanthanides”. Radiokhimiya 25 (2): 158-161.
- ^ Seaborg, p. 39
- ^ Seaborg, p. 40
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7
- ^ Lundqvist, Robert; Hulet, E. K.; Baisden, T. A.; Nasakkala, Elina; Wahlberg, Olof (1981). “Electromigration Method in Tracer Studies of Complex Chemistry. II. Hydrated Radii and Hydration Numbers of Trivalent Actinides”. Acta Chem. Scand., Ser. A 35: 653-661. doi:10.3891/acta.chem.scand.35a-0653.
- ^ Hussonnois, H.; Hubert, S.; Aubin, L.; Guillaumont, R.; Boussieres, G. (1972). Radiochem. Radioanal. Lett. 10: 231-238.
- ^ Thompson, S. G.; Harvey, B. G.; Choppin, G. R.; Seaborg, G. T. (1954). “Chemical Properties of Elements 99 and 100”. J. Am. Chem. Soc. 76 (24): 6229-6236. doi:10.1021/ja01653a004.
- ^ Mikheev, N. B.; Spitsyn, V. I.; Kamenskaya, A. N.; Gvozdec, B. A.; Druin, V. A.; Rumer, I. A.; Dyachkova, R. A.; Rozenkevitch, N. A. et al. (1972). “Reduction of fermium to divalent state in chloride aqueous ethanolic solutions”. Inorg. Nucl. Chem. Lett. 8 (11): 929-936. doi:10.1016/0020-1650(72)80202-2.
- ^ Hulet, E. K.; Lougheed, R. W.; Baisden, P. A.; Landrum, J. H.; Wild, J. F.; Lundqvist, R. F. (1979). “Non-observance of monovalent Md”. J. Inorg. Nucl. Chem. 41 (12): 1743-1747. doi:10.1016/0022-1902(79)80116-5.
- ^ Maly, Jaromir (1967). “The amalgamation behaviour of heavy elements 1. Observation of anomalous preference in formation of amalgams of californium, einsteinium, and fermium”. Inorg. Nucl. Chem. Lett. 3 (9): 373-381. doi:10.1016/0020-1650(67)80046-1.
- ^ Mikheev, N. B.; Spitsyn, V. I.; Kamenskaya, A. N.; Konovalova, N. A.; Rumer, I. A.; Auerman, L. N.; Podorozhnyi, A. M. (1977). “Determination of oxidation potential of the pair Fm2+/Fm3+”. Inorg. Nucl. Chem. Lett. 13 (12): 651-656. doi:10.1016/0020-1650(77)80074-3.
- ^ Samhoun, K.; David, F.; Hahn, R. L.; O'Kelley, G. D.; Tarrant, J. R.; Hobart, D. E. (1979). “Electrochemical study of mendelevium in aqueous solution: No evidence for monovalent ions”. J. Inorg. Nucl. Chem. 41 (12): 1749-1754. doi:10.1016/0022-1902(79)80117-7.
- ^ Koch, Lothar (2000). Transuranium Elements, in Ullmann's Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a27_167


