ベンゾキノン
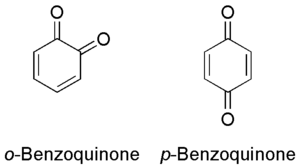
ベンゾキノン (benzoquinone) とは、分子式C6H4O2で表される有機化合物であり、炭素のみで構成された1つの6員環からなるキノンである。2種類の構造異性体が存在し、1,4-ベンゾキノン(パラ-ベンゾキノン、p-ベンゾキノン、パラ-キノン、just quinone)が一般的であり、1,2-ベンゾキノン(オルト-ベンゾキノン、o-ベンゾキノン、オルト-キノン)は一般的ではない。
1,4-ベンゾキノン
[編集]| 1,4-ベンゾキノン | |
|---|---|

|
|
シクロヘキサ-2,5-ジエン-1,4-ジオン | |
別称 p-ベンゾキノン; p-キノン | |
| 識別情報 | |
| CAS登録番号 | 106-51-4 |
| ChemSpider | 4489 |
| UNII | 3T006GV98U |
| KEGG | C00472 |
| ChEMBL | CHEMBL8320 |
| RTECS番号 | DK2625000 |
| |
| |
| 特性 | |
| 化学式 | C6H4O2 |
| モル質量 | 108.095 g/mol |
| 外観 | 黄色固体 |
| 密度 | 1.318 g/cm3 at 20 ℃, 固体 |
| 融点 |
115 ℃ |
| 沸点 |
昇華 |
| 水への溶解度 | 難溶 |
| 溶解度 | 石油エーテルに難溶、アセトンに可溶、エタノール、ベンゼン、ジエチルエーテルに易溶 |
| 危険性 | |
| 主な危険性 | 毒物 |
| Rフレーズ | R23/25 R36/37/38 R50 |
| Sフレーズ | S26 S28 S45 S61 |
| 関連する物質 | |
| 関連する構造異性体 | 1,2-ベンゾキノン |
| 関連物質 | ヒドロキノン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
純粋な1,4-ベンゾキノンは塩素に似た特徴的な刺激臭のする黄色結晶を形成する。純粋でないものは、1,4-ベンゾキノンとヒドロキノンの1:1の混合物であるキンヒドロンが不純物として含まれるため、しばし暗色を呈する。この6員環化合物は、1,4-ヒドロキノンの酸化誘導体として得られる[1]。1,4-ベンゾキノンの分子は多数の性質を有している。ケトンの性質としてオキシムを形成し、酸化剤の性質として(酸化剤として反応した際に自身は還元されるため)ジヒドロキシ誘導体(1,4-ヒドロキノン)を形成し、アルケンの性質として付加反応を経てα,β-不飽和ケトンを形成する。1,4-ベンゾキノンは強い鉱酸およびアルカリの両方に対して敏感であり、化合物の縮合と分解の原因となる。
合成
[編集]1,4-ベンゾキノンはアニリンやp-フェニレンジアミンを酸化させることによって得られる[2]。また、フェノールをアセトニトリル溶媒中において過酸化水素で酸化させることによって、カテコール、ヒドロキノンとの混合物として得られる[3]。
有機合成への利用
[編集]1,4-ベンゾキノンは有機合成において水素アクセプターおよび酸化剤として用いられる[4]。また、脱水素剤としても利用できる。ディールス・アルダー反応における親ジエン体としても用いられる[5]。
ベンゾキノンは無水酢酸および硫酸と反応してヒドロキシキノールの3酢酸塩を与え、この反応は1898年にこれを初めて記述したJohannes ThieleにちなんでThiele reactionと呼ばれる[6]。これは全合成において発見された[7]。
ベンゾキノンはオレフィン・メタセシス反応中の二重結合の組み換えを抑制するためにも用いられる。
ヨウ化カリウムの酸性溶液は1,4-ベンゾキノンを1,4-ヒドロキノンに還元させる。また、硝酸銀水溶液は1,4-ヒドロキノンを1,4-ベンゾキノンに酸化させる。
重合禁止剤
[編集]ポリエステル樹脂の原料は反応性が高くゲル化しやすいため、重合禁止剤としてベンゾキノンが用いられる[8]。アクリル樹脂の原料に対しては重合禁止剤としては十分に作用しない[2]。反応機構は明らかになっていないが、活性種が1,4-ベンゾキノン上の酸素に直接付加することで重合禁止剤として働くと考えられている[2]。
関連物質
[編集]1,4-ベンゾキノンの誘導体および類似体の例を以下に挙げる。
- 1,4-ナフトキノン - 三酸化クロム存在下でナフタレンを酸化させることで得られる[9]。
- 2,3-ジクロロ-5,6-ジシアノ-p-ベンゾキノン (DDQ) - ベンゾキノンよりも強力な酸化剤、脱水素剤[10]。
- クロラニル - 1,4-C6Cl4O2、ベンゾキノンよりも強力な酸化剤、脱水素剤。
- ユビキノン-1 - 天然に存在する1,4-ベンゾキノン誘導体。
- クロロ-p-ベンゾキノン (CAS No. [695-99-8])[11]
1,2-ベンゾキノン
[編集]| 1,2-ベンゾキノン | |
|---|---|

|

|
Cyclohexa-3,5-diene-1,2-dione | |
別称
| |
| 識別情報 | |
| CAS登録番号 | 583-63-1 |
| PubChem | 11421 |
| ChemSpider | 10941 |
| 日化辞番号 | J7.445D |
| KEGG | C02351 |
| |
| |
| 特性 | |
| 化学式 | C6H4O2 |
| モル質量 | 108.0964 g/mol |
| 密度 | 1.256 g/cm3 |
| 沸点 |
213.3 ℃ @760 mmHg |
| 危険性 | |
| 引火点 | 76.4 ℃ |
| 関連する物質 | |
| 関連する構造異性体 | 1,4-ベンゾキノン |
| 関連物質 | カテコール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
1,2-ベンゾキノンは、カテコール水溶液を空気酸化させることによって得られる[12][13]。もしくは、フェノールのオルト酸化によっても得られる[12]。亜硫酸などの還元剤と反応させることでカテコールに還元される[2]。メラニンの前駆体である[14]。水溶性の赤色の物質であり、ジエチルエーテルには不溶である。不安定な物質であり合成後1日ほどで分解する[2]。昇華性のある1,4-ベンゾキノンとは異なり不揮発性である[2]。
バクテリアであるPseudomonas mendocina (en)の菌株は安息香酸の代謝によってカテコールを介して最終生成物として1,2-ベンゾキノンを得ている[13]。
出典
[編集]- ^ H. W. Underwood, Jr. and W. L. Walsh (1943). "Quinone". Organic Syntheses (英語).; Collective Volume, vol. 2, p. 553
- ^ a b c d e f 化学大辞典編集委員会, ed (1981). 化学大辞典8縮刷版 (第26版 ed.). 共立出版. pp. p.518. ISBN 4320040155
- ^ 原田幸明 (2008). レアメタルの代替材料とリサイクル. シーエムシー出版. pp. pp.153-154. ISBN 4781300022
- ^ Yang, T.-K.; Shen, C.-Y. “1,4-Benzoquinone” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- ^ Oda, M.; Kawase, T.; Okada, T.; Enomoto, T. (1998). "2-Cyclohexene-1,4-dione". Organic Syntheses (英語).; Collective Volume, vol. 9, p. 186
- ^ Thiele, Johannes (1898). “Ueber die Einwirkung von Essigsäure-anhydrid auf Chinon und auf Dibenzoylstyrol”. Berichte der deutschen chemischen Gesellschaft (Wiley Online Library) 31 (1): 1247-1249. doi:10.1002/cber.189803101226.
- ^ Stereoselective Total Synthesis and Enantioselective Formal Synthesis of the Antineoplastic Sesquiterpene Quinone Metachromin A Wanda P. Almeida, and Carlos Roque D. Correia J. Braz. Chem. Soc., Vol. 10, No. 5, 401–414, 1999 doi:10.1590/S0103-50531999000500011.
- ^ 前田豊 (2008). 炭素繊維の応用と市場. シーエムシー出版. pp. p.60. ISBN 9784781300061
- ^ E. A. Braude E. A.; Fawcett, J. S. (1963). "1,4-Naphthoquinone". Organic Syntheses (英語).; Collective Volume, vol. 4, p. 698
- ^ Vogel, E.; Klug, W.; Breuer, A. (1988). "1,6-Methano[10]annulene". Organic Syntheses (英語).; Collective Volume, vol. 6, p. 731
- ^ Harman, R. E. (1963). "Chloro-p-benzoquinone". Organic Syntheses (英語).; Collective Volume, vol. 4, p. 148
- ^ a b Magdziak, D., Rodriguez, A. A.; Van De Water, R. W.; Pettus, T. R. R. (2002). “Regioselective oxidation of phenols to o-quinones with o-iodoxybenzoic acid (IBX)”. Org. Lett. 4 (2): 285–288. doi:10.1021/ol017068j. PMC 1557836. PMID 11796071.
- ^ a b Parulekar, Chanda and Mavinkurve, Suneela (2006-02). “Formation of ortho-benzoquinone from sodium benzoate by Pseudomonas mendocina P2d”. Indian Journal of Experimental Biology (CSIR) 44 (02): 157-162. ISSN 0975-1009.
- ^ Enzymatic Browning in Fruits, Vegetables and Seafoods Archived 2011年8月22日, at the Wayback Machine.Section 2.3.2
関連項目
[編集]ミイデラゴミムシ - 体内に過酸化水素とヒドロキノンを貯めておき、これらを反応させ蒸気とベンゾキノンから成る高温の気体を噴射する。

