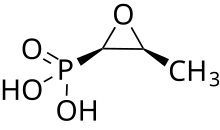
ホスホマイシン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | ホスミシン, Monurol |
| Drugs.com | monograph |
| MedlinePlus | a697008 |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 30–37% (oral, fosfomycin tromethamine); varies with food intake |
| 血漿タンパク結合 | 2.16% |
| 代謝 | ほとんど未変化体で尿中へ排泄 |
| 半減期 | 5.7 時間 |
| 排泄 | 尿中排泄 |
| データベースID | |
| CAS番号 |
23155-02-4 |
| ATCコード | J01XX01 (WHO) |
| PubChem | CID: 446987 |
| DrugBank |
DB00828 |
| ChemSpider |
394204 |
| UNII |
2N81MY12TE |
| KEGG |
D04253 |
| ChEBI |
CHEBI:28915 |
| ChEMBL |
CHEMBL1757 |
| 化学的データ | |
| 化学式 | C3H7O4P |
| 分子量 | 138.059 g/mol |
| |
| 物理的データ | |
| 融点 | 94 °C (201 °F) |
ホスホマイシン(Fosfomycyn、Phosphomycin、Phosphonomycin)とは、ストレプトマイセス属の真正細菌が産生する抗菌スペクトルの広い抗生物質[1]の一つである。商品名ホスミシン。カルシウム塩が経口剤、ナトリウム塩が注射剤と点耳剤として製造されている。構造は単純で類似構造を持つ抗生物質は未だに確認されていない。
禁忌
[編集]製剤成分に過敏症の既往を有する患者のほか、低張性脱水症の患者は脱水が増悪する可能性があるので注射剤は禁忌である[2]。
副作用
[編集]経口剤の添付文書に記載されている重大な副作用は、血便を伴う重篤な大腸炎(偽膜性大腸炎等)である[3]。注射剤にはそれに加えて、ショック、アナフィラキシー様症状、汎血球減少、無顆粒球症、血小板減少、肝機能障害、黄疸、痙攣が記載されている[2]。点耳剤に重大な副作用は設定されていない[4]。
効能・効果
[編集]- グラム陽性菌:ブドウ球菌属☆※*、
- グラム陰性菌:大腸菌☆※、セラチア属☆※、プロテウス属☆※*、モルガネラ・モルガニー☆※、プロビデンシア・レットゲリ☆※、緑膿菌☆※*、赤痢菌※、サルモネラ属※、カンピロバクター属※
が原因である敗血症☆、急性気管支炎☆、肺炎☆、肺膿瘍☆、膿胸☆、慢性呼吸器病変の二次感染☆、膀胱炎☆※、腎盂腎炎☆※、感染性腸炎※、腹膜炎☆、バルトリン腺炎☆、子宮内感染☆、子宮付属器炎☆、子宮旁結合織炎☆、深在性皮膚感染症※、涙嚢炎※、麦粒腫※、瞼板腺炎※、中耳炎※*、外耳炎*、副鼻腔炎※
☆:注射剤に記載、※:経口剤に記載、*:点耳剤に記載
ホスホマイシンは各種の尿路感染症に短期間大量投与される。単回経口多量投与の報告もある[5]。 トブラマイシンとの合剤が嚢胞性線維症患者の肺感染症治療に応用された[6][7]。
ホスホマイシンの忍容性は高く、副作用は少ないとされる[5]が、治療中の耐性の出現率が高く、重症感染症の治療継続ができない場合が多い。小児ならびに75歳以上の高齢者には推奨されない[8]。
さらなる使用方法が提案されている[9]。 世界的な耐性菌出現が近年問題視されている[10]。
動物用医薬品としては、牛の大腸菌性下痢症及びサルモネラ症に使用され、飼料添加物としても使用されている。また、すずき目魚類の類結節症及びエドワジェラ症に対して飼料添加物として使用される。
作用機序
[編集]ホスホマイシンはMurAと呼ばれるUDP-N-アセチルグルコサミンエノールピルビン酸トランスフェラーゼ酵素を失活させる事で殺菌的に作用する[11]。MurAはペプチドグリカンの生合成過程の内、ホスホエノールピルビン酸(PEP)をUDP-N-アセチルグルコサミンの3'位の水酸基へ移動させる役割を持っており、このピルビン酸基はペプチドグリカンのペプチド部分とグリカン部分を繋ぐ役目を果たす。ホスホマイシンはPEPの代わりにMurAに結合し、その活性部位であるシステイン残基(Escherichia coli の場合は115番)をアルキル化して作用を封じる[12]。この様にホスホマイシンは、細菌の細胞壁のペプチドグリカン合成を阻害することにより抗菌力を発揮する。βラクタム系の様に細胞壁のムレイン架橋を阻害するのではなく、ムレイン単体生合成を阻害することが特徴である。ムレイン単体合成阻害薬には他にバンコマイシンがある。
ホスホマイシンはバクテリア体内へグリセロールリン酸輸送体にて取り込まれる[13]。
抗菌スペクトルと感性
[編集]ホスホマイシンの抗菌活性はグラム陽性菌とグラム陰性菌の両方に対して有効であり、E. faecalis、E. coli、シトロバクター属、プロテウス属等のグラム陰性菌を殺菌できる。低pH環境下ではより活性が強く、尿中に未変化の活性体が排泄されるので尿路病原菌起因性の予防・治療に適している。 注目すべき点は、S. saprophyticus、クレブシエラ属、エンテロバクター属に対する活性一定ではないので、最小発育阻止濃度(MIC)を確認した上で用いるべきである点であろう。他の抗生物質と交差耐性を持たないので、基質特異性拡張型βラクタマーゼ(ESBL)を産生する病原体に対する活性は、特にESBL産生型E. coli において良好または著効である。 ホスホマイシンに感性の起因菌による単純性尿路感染症に対する臨床データがある。しかし、感性の判断基準である64mg/Lは全身性感染症については適用すべきでない。欧州抗菌薬感受性試験委員会(EUCAST)は、感性の基準として32mg/Lを採用している[14]。
急性毒性
[編集]LD50:1,200mg/kg(ナトリウム塩、マウス投与時)
耐性
[編集]非必須なグリセロールリン酸輸送体の不活性化によってホスホマイシン耐性が出現する[15][16]。
ホスホマイシン耐性酵素
[編集]ホスホマイシンの耐性に寄与する酵素群の遺伝子が、染色体とプラスミドの両方から見付かっている[17]。
ホスホマイシン耐性に関する3つの遺伝子(FosA、FosB、FosX)はグリオキシラーゼに分類される酵素をコードする。これらの酵素はホスホマイシンの1位の炭素に求核反応してエポキシ環を開き、ホスホマイシンを不活化させる。求核反応に用いる基質に応じてFosA(グルタチオン)、FosB(バシリチオール[18][19])、FosX(水(H2O)[17])に分類されている。一般にFosAおよびFosXはグラム陰性菌が、FosBはグラム陽性菌が産生する[17]。
FosCはホスホマイシンにATPのリン酸基を転移させる酵素であり、この反応によってもホスホマイシンは不活化される[20]。
生合成遺伝子群
[編集]Streptomyces fradiae が持つホスホマイシンを生合成する遺伝子群を全てStreptomyces lividans に移植する試みが2006年に成功した[21]。
開発の経緯
[編集]ホスホマイシンは最初、土壌サンプルの培養液中に含まれていたStreptomyces fradiaeから、発育中のバクテリアをスフェロプラスト化させた事から発見され、1969年に出版された論文集の中で報告された[22]。1971年に工業的に生産される様になった[23]。
出典
[編集]- ^ “In vitro activity of fosfomycin in combination with various antistaphylococcal substances”. The Journal of Antimicrobial Chemotherapy 48 (2): 209–17. (Aug 2001). doi:10.1093/jac/48.2.209. PMID 11481290.
- ^ a b c “ホスミシンSバッグ1g点滴静注用/ホスミシンSバッグ2g点滴静注用 添付文書” (2011年4月). 2016年4月23日閲覧。
- ^ a b “ホスホマイシンカルシウムカプセル250mg「日医工」/ホスホマイシンカルシウムカプセル500mg「日医工」/ホスホマイシンカルシウムドライシロップ40%「日医工」 添付文書” (2012年6月). 2016年4月23日閲覧。
- ^ a b “ホスミシンS耳科用3% 添付文書” (2011年4月). 2016年4月23日閲覧。
- ^ a b “Fosfomycin tromethamine. A review of its antibacterial activity, pharmacokinetic properties and therapeutic efficacy as a single-dose oral treatment for acute uncomplicated lower urinary tract infections”. Drugs 53 (4): 637–656. (Apr 1997). doi:10.2165/00003495-199753040-00007. PMID 9098664.
- ^ “Fosfomycin/tobramycin for inhalation in patients with cystic fibrosis with pseudomonas airway infection”. American Journal of Respiratory and Critical Care Medicine 185 (2): 171–8. (Jan 2012). doi:10.1164/rccm.201105-0924OC. PMID 22095545.
- ^ 臨床試験番号 NCT00794586 研究名 "Study Evaluating Fosfomycin/Tobramycin for Inhalation in Cystic Fibrosis Patients With Pseudomonas Aeruginosa Lung Infection" - ClinicalTrials.gov
- ^ “MONURIL SACHETS 3G”. May 26, 2014閲覧。
- ^ “Fosfomycin: use beyond urinary tract and gastrointestinal infections”. Clinical Infectious Diseases 46 (7): 1069–77. (Apr 2008). doi:10.1086/527442. PMID 18444827.
- ^ “Potential of old-generation antibiotics to address current need for new antibiotics”. Expert Review of Anti-Infective Therapy 6 (5): 593–600. (Oct 2008). doi:10.1586/14787210.6.5.593. PMID 18847400.
- ^ “MurA (MurZ), the enzyme that catalyzes the first committed step in peptidoglycan biosynthesis, is essential in Escherichia coli”. Journal of Bacteriology 177 (14): 4194–7. (Jul 1995). PMC 177162. PMID 7608103.
- ^ “Cell Envelope.1995”. 2009年3月30日時点のオリジナルよりアーカイブ。2008年11月8日閲覧。
- ^ “Interaction of fosfomycin with the glycerol 3-phosphate transporter of Escherichia coli.”. Biochimica et Biophysica Acta 1810 (12): 1323–1329. (Jul 2011). doi:10.1016/j.bbagen.2011.07.006. PMID 21791237.
- ^ Pasteran F, Lucero C, Rapoport M, Guerriero L, Barreiro I, Albornoz E et al. (2012). “Tigecycline and intravenous fosfomycin zone breakpoints equivalent to the EUCAST MIC criteria for Enterobacteriaceae.”. J Infect Dev Ctries 6 (5): 452-6. doi:10.3855/jidc.2238. PMID 22610713.
- ^ “The mechanism of action of fosfomycin (phosphonomycin)”. Annals of the New York Academy of Sciences 235 (0): 364–386. (May 1974). Bibcode: 1974NYASA.235..364K. doi:10.1111/j.1749-6632.1974.tb43277.x. PMID 4605290.
- ^ a b c Fosfomycin Resistance Proteins: A Nexus of Glutathione Transferases and Epoxide Hydrolases in a Metalloenzyme Superfamily. “Fosfomycin resistance proteins: a nexus of glutathione transferases and epoxide hydrolases in a metalloenzyme superfamily”. Methods in Enzymology. Methods in Enzymology 401: 367–379. (2005). doi:10.1016/S0076-6879(05)01023-2. ISBN 9780121828066. PMID 16399398.
- ^ “Chemical and Chemoenzymatic syntheses of bacillithiol: a unique low-molecular-weight thiol amongst low G + C Gram-positive bacteria”. Angewandte Chemie 50 (31): 7101–7104. (Jul 2011). doi:10.1002/anie.201100196. PMID 21751306.
- ^ “Mechanistic studies of FosB: a divalent-metal-dependent bacillithiol-S-transferase that mediates fosfomycin resistance in Staphylococcus aureus”. The Biochemical Journal 451 (1): 69–79. (Apr 2013). doi:10.1042/BJ20121541. PMID 23256780.
- ^ “Product of fosC, a gene from Pseudomonas syringae, mediates fosfomycin resistance by using ATP as cosubstrate”. Antimicrobial Agents and Chemotherapy 39 (7): 1569–73. (Jul 1995). doi:10.1128/aac.39.7.1569. PMC 162783. PMID 7492106.
- ^ “Heterologous production of fosfomycin and identification of the minimal biosynthetic gene cluster”. Chemistry & Biology 13 (11): 1171–82. (Nov 2006). doi:10.1016/j.chembiol.2006.09.007. PMID 17113999.
- ^ Silver, L.L. Rational approaches to antibiotic discovery: pre-genomic directed and phenotypic screening, 2.4.2 Screens for spheroplast formation. In: Thomas Dougherty, Michael J. Pucci, Antibiotic Discovery and Development. Chap. 2, p. 46.
- ^ Encros About us: Our history.
